pH胁迫对刺参存活、生长及抗氧化酶活性的影响*
韩 莎 胡 炜 李成林 朱夕波 赵 斌 张少春 孙永军
pH胁迫对刺参存活、生长及抗氧化酶活性的影响*
韩 莎1胡 炜1李成林1①朱夕波2赵 斌1张少春1孙永军3
(1. 山东省海洋生物研究院 青岛 266104;2. 日照市岚山区渔业技术推广站 日照 276800;3. 好当家集团有限公司 威海 264300)
本研究比较分析了在对照组(pH为8.4)、低pH胁迫组(pH为6.8、7.0、7.2、7.4、7.6和7.8)和高pH胁迫组(pH为8.6、8.8、9.0、9.2、9.4和9.6)的养殖水环境下,胁迫36 d对刺参(Selenka)存活、生长及抗氧化酶活性的影响。结果显示,不同pH对刺参存活、生长及抗氧化酶活性有显著影响。在pH 7.4~9.0范围内,刺参存活率为100%,随着pH胁迫强度和胁迫时间的增加,刺参存活率逐渐降低,当pH为6.8、7.0和9.6时,自第3天起,刺参处于过度应激状态,继而有死亡个体出现,至30 d时刺参死亡率为100%。不同pH显著影响刺参生长,刺参特定生长率随pH胁迫程度增加呈下降趋势,当pH为9.0时,刺参出现负增长。各pH胁迫组刺参超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性均高于对照组,且随pH胁迫程度的增加呈先升高后下降的变化趋势。在低pH组中,以pH=7.4时刺参SOD和CAT活性最高,分别达到(74.92±2.24) U/ml和(14.99±2.38) U/ml,显著高于对照组;而在高pH组中,SOD和CAT活性分别以pH 8.8和9.0时最高,分别达到(72.90±1.10) U/ml和(15.68±0.89) U/ml,显著高于对照组。结果表明,pH在7.4~9.0范围内是刺参存活与生长的适宜水环境,过高或过低均会引起刺参不同程度的应激反应,进而导致刺参的死亡。
刺参;pH;存活;生长;抗氧化酶
刺参(Selenka)以极高的营养价值和经济价值成为海水养殖单品种产值最高的品种,近年来,刺参养殖产业发展迅猛,养殖规模和空间拓展不断扩大。目前,我国刺参增养殖面积为20余万hm2,年产量约20.4万t,年产值超过350亿元(李成林等, 2010、2017)。然而,在刺参产业迅猛发展的同时,生产中也出现了一系列不同程度的瓶颈问题,诸如养殖生态环境恶化、种质资源退化、病害频繁发生等,严重制约了刺参养殖产业的持续稳定发展(常亚青等, 2006; 李成林等, 2010、2017)。其中,环境胁迫是人工养殖条件下导致刺参应激或发病的主要因素之一。在环境因子胁迫下,刺参会产生不同程度的应激反应,过度的应激反应会使刺参出现异常的生理状态,进而导致其生长缓慢、免疫力降低,大大增加感染疾病的几率。目前,许多学者对刺参的环境胁迫适应机制进行了研究,多集中在盐度(胡炜等, 2012; 董晓亮等, 2013; 庚辰帆等, 2015; 赵斌等, 2015)、温度(董云伟等, 2009)、低溶氧(李根瑞等, 2016)、氨氮(臧元奇等, 2012)、亚硝态氮(陈芸燕等, 2013)等胁迫因子的研究上,而有关环境因子中pH对刺参生理生态影响的研究甚少。
酸碱度作为水环境生态平衡的关键指标之一,是水中化学性状和生命活动的综合反映(赵先银等, 2011),不仅直接影响水生生物的存活、生长等生理机能,还会影响水体中氨态氮、硫化氢和重金属离子等化学物质的存在形式及含量,间接影响水生生物的生长、存活与繁殖(曾媛媛等, 2008)。通常情况下,自然海水pH范围为7.8~8.5,水质条件的变化时常会导致水体pH在4~10范围内波动变化(Zhao, 2010)。在刺参养殖池塘中,水体pH常因连续阴天、持续高温、骤降暴雨、水质污染、生物种群突变、底质老化等因素的影响而发生变化,时常呈现周期性或临时性的波动。
迄今为止,有关pH对刺参生理生态影响的研究仅限于对刺参苗期存活率、生长指标及免疫功能等的评价(Zhao, 2010; Yuan, 2010),而对其在养殖期间生理指标变化的研究尚未见相关报道。本实验以大规格刺参为研究对象,研究了不同pH对刺参存活、生长及免疫功能的影响,旨在进一步探明刺参对pH的适应性,以及在pH胁迫下的刺参免疫调节机制,以期为刺参健康养殖过程中水环境调控提供科学依据和理论参考。
1 材料与方法
1.1 实验材料
实验用刺参取自山东省海洋生物研究院种质资源研究中心,选取表观正常、伸展自如、健康活力强的刺参,平均体重为(7.02±0.81) g,置于容积为1.0 m3的圆形玻璃钢水槽中暂养,实验于2016年4月在本中心实验室进行。实验用水为经沉淀、砂滤的自然海水,温度为18.8~23.9℃,盐度为31.3±0.6。实验期间,24 h充气,日投喂人工配合饲料1次,投喂量为刺参体重的3%~5%,每天全量换水并清除残饵和粪便,暂养适应15 d后进行实验。
1.2 实验设计
实验共设12个pH处理组,分别为6个低pH组(pH为6.8、7.0、7.2、7.4、7.6和7.8)和6个高pH组(pH为8.6、8.8、9.0、9.2、9.4和9.6),并设对照组(pH=8.4)。各处理组和对照组实验刺参均为10头,放养于80 cm´60 cm´48 cm的整理箱中,每处理组均设3个平行。各实验组使用1 mol/L的HCl和1 mol/L的NaOH调节pH,整个实验期间,每日定时采用哈纳HI98185多参数水质分析仪测定并及时校正水的pH值,变化幅度不超过±0.05个单位。pH调节采取逐步变化的方式,日全量换水1次,pH日变化幅度为0.2个单位,各实验组pH达到实验设计pH时,开始胁迫实验。
实验期间,观测刺参存活、摄食及活动情况,发现死亡个体及时清除,每6 d统计各pH组刺参死亡数量,每12 d测定1次生长情况,实验周期为36 d。
1.3 样品采集与免疫酶指标测定
在胁迫实验结束时,从每个处理组中随机选取刺参3~5头,用5.0 ml一次性注射器抽取刺参体腔液,将其在4℃下以1000 r/min离心10 min,取上清液分装于500ml灭菌离心管中,置于–80℃冰箱中待测。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性的测定均采用南京生物工程研究所研制的试剂盒测定。
1.4 存活和生长指标的计算
实验期间刺参累计死亡率采用以下公式计算:
累计死亡率(%)=t/0×100
式中,0为实验开始时刺参头数,t为实验期间测定时刺参累计死亡头数。
实验期间刺参特定生长率(Specific growth rate, SGR)采用以下公式计算:
SGR (%/d)=(lnt–ln0)/×100
式中,0为初始体重(g),t为终末体重(g),为实验天数(d)。
通过测定摄食率(Feeding rate, FR)与食物转化率(Food conversion efficiency, FCE),观测pH胁迫对刺参摄食的影响。计算公式如下:
FR(%)=2/[(W+0)]×100
FCE(%)=100×(W−0)/
式中,0为体重初始值(g),W为测定值(g),为实验时间(d),为饲料总摄入量(g)。
1.5 数据统计
采用SPSS 16.0和Excel 2007软件进行统计学分析,利用单因素方差分析(One-way ANOVA)和多重比较分析不同pH组之间的差异。实验所得数据表示为平均值±标准误(Mean±SE),<0.05为差异显著。
2 结果
2.1 pH胁迫对刺参存活的影响
经不同pH胁迫后,刺参的存活情况受到不同程度的影响,刺参累计死亡率如图1所示。至实验结束时,在pH为7.4~9.0处理组中,刺参存活率最高,均为100%;存活率最低的为pH 6.8、7.0和9.6组,至实验结束时刺参存活率均为0;其余各pH处理组刺参存活率差异较大,随着胁迫程度的加强,存活率显著下降(<0.05)。
在低pH处理组中,pH 6.8和7.0组刺参胁迫至第3天时,开始出现吐肠、化皮等应激反应,胁迫6 d后,刺参累计死亡率呈现显著差异(<0.05),死亡率均为6.67%,且随着实验的持续进行,2组的累计死亡率均大幅升高,至12 d时差异显著(<0.05),至第30天时实验刺参均全部死亡,而pH 7.2组刺参在胁迫12 d后出现死亡个体,随后刺参死亡个体数逐日小幅增加,至实验结束时累计死亡率达到46.67%。
在高pH处理组中,pH9.6组胁迫至第5天时,开始出现化皮现象,至6 d时累积死亡率达到6.67%,且随着实验的持续进行,累计死亡率大幅升高(<0.05),至第30天时实验刺参均全部死亡;而pH 9.0和9.2组刺参在胁迫6 d后才出现死亡个体,之后累计死亡率小幅上升,至实验结束时,pH 9.0和9.2组的累计死亡率分别为36.67%和50.00%。
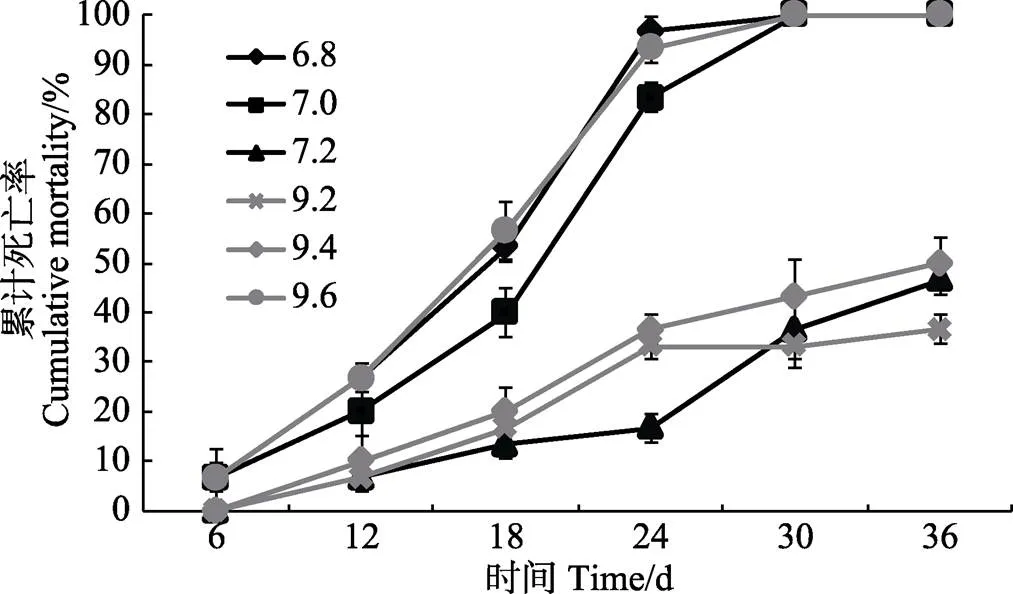
图1 pH胁迫对刺参累计死亡率的影响
2.2 pH胁迫对刺参生长的影响
pH胁迫对刺参生长的影响见表1。由表1可以看出,至胁迫实验结束时,对照组刺参终末体重最高,平均体重达(8.95±2.06) g。随着胁迫程度的加强,各pH处理组刺参终末体重均呈现逐渐下降的趋势,除pH 7.8组外,其他各实验组刺参平均体重均显著低于对照组(<0.05),尤其是pH 9.0组刺参出现体重负增长,体重最低,为(6.44±1.86) g。
表1 pH胁迫对刺参生长的影响

Tab.1 The growth of sea cucumber at different pH
注:不同字母表示组间差异显著(<0.05)。下同
Note: The means with different letters within the same column are significantly different at the 0.05 probability level. The same as below
在低pH处理组中,当pH为7.4~7.8时,至12 d时,刺参SGR1显著高于对照组(<0.05),而随着实验的持续进行,pH 7.4组刺参SGR2逐渐下降且低于对照组,当胁迫时间超过24 d时,刺参SGR3均大幅降低,呈现为负值(<0.05)。
在高pH处理组中,当pH为8.6~8.8时,至12 d时,刺参SGR1高于对照组,而pH 9.0组SGR1显著低于对照组(<0.05);而12 d之后,高pH组刺参SGR2均显著低于对照组(<0.05),尤其是在24 d后,SGR3均降为负值。至实验结束时,对照组SGR为(0.68± 0.19)%/d,其他胁迫组刺参SGR均显著低于对照组,其中,pH 9.0组SGR最低,为(–0.26±0.34)%/d。高pH胁迫对刺参生长的影响更为显著。
2.3 pH胁迫对刺参摄食的影响
不同pH胁迫下刺参摄食率(FR)和刺参食物转化率(FCE)见表2。从表2可以看出,刺参的摄食率以对照组摄食率最大,为(2.26±0.15)%。随着pH胁迫程度的增加,刺参摄食率呈现下降的趋势。在低pH处理组中,低于pH 7.6的实验组刺参摄食率组内差异显著(<0.05),实验刺参所排泄粪便呈细短状;在高pH处理组中,高于pH 8.8的实验组刺参摄食率大幅下降,显著低于对照组(<0.05),实验刺参出现整个身体逐渐收缩至紧缩、体表棘刺短平、活力较弱、排泄粪便不成形等现象。
表2显示,不同pH胁迫对刺参食物转化率有显著影响。pH=7.8时,实验组刺参的FCE达到最大值,为(24.86±1.15)%,但与对照组差异不显著(>0.05),其他各pH胁迫组刺参的FCE均显著低于对照组(<0.05)。从表2明显看出,与低pH胁迫相比,高pH胁迫对刺参食物转化率的影响更为显著。
表2 pH胁迫对刺参摄食率和食物转化率的影响

Tab.2 The feeding rate and food conversion efficiency of sea cucumber at different pH
2.4 pH胁迫对刺参SOD活性的影响
不同pH对刺参体内SOD活性的影响见图2。从图2可以看出,随着高、低pH胁迫程度的加强,刺参体内SOD活性均呈现先升高后降低的峰值变化趋势。在低pH组中,以pH 7.4时刺参体内SOD活性最高,为(74.92±2.24) U/ml,与对照组相比,差异显著(<0.05),而pH 7.6、7.8组SOD活性均与对照组无显著差异(>0.05);在高pH组中,当pH为8.6~8.8时,SOD活性显著增加(<0.05),以pH 8.8组刺参的SOD活性最高,为(72.90±1.10) U/ml,之后随着pH升高SOD活性逐渐下降,但与对照组差异不显著。
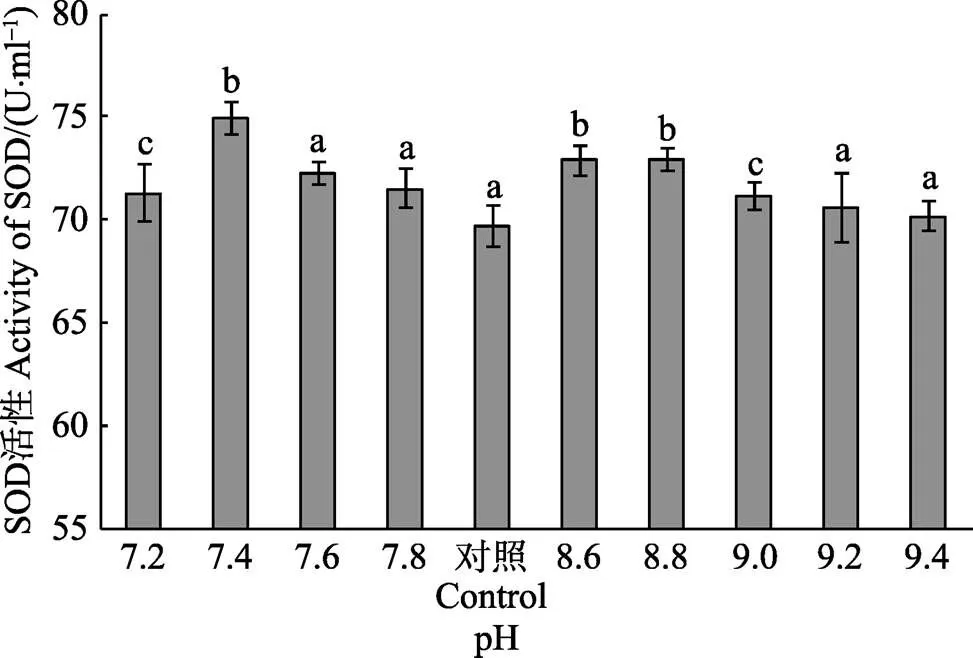
图2 不同pH对刺参体内SOD活性的影响
2.5 pH胁迫对刺参CAT活性的影响
不同pH对刺参体内CAT活性的影响见图3。从图3可以看出,随着高、低pH胁迫程度的加强,刺参CAT活性均呈现先升高后降低的峰值变化趋势。在低pH组中,pH=7.4时达到最高值,为(14.99±2.38) U/ml,各实验组刺参CAT活性均与对照组差异显著(<0.05);在高pH组中,pH=9.0时刺参体内CAT活性达到最高,为(15.68±0.89) U/ml,之后随着pH升高CAT活性继而逐渐下降,各实验组刺参CAT活性均与对照组有显著差异(<0.05)。

图3 不同pH对刺参体内CAT活性的影响
3 讨论
3.1 pH对刺参存活的影响
在自然环境下,pH是随着时间和空间变化而变化的环境理化因子,水生生物的存活、生长和摄食与pH密切相关。不同的水生生物品种和发育阶段适宜的pH不同,毛蚶()稚贝适宜的pH范围为7.5~8.5 (方军等, 2008),中国明对虾()生活在7.6~9.0的海水中最适宜(何玉英等, 2008),黄颡鱼()的适宜生存pH为5.2~7.6 (吴萍等, 2001)。本研究发现,刺参适宜生存的pH范围与大多数海洋生物基本一致。在pH 7.4~9.0条件下,刺参生存状况良好,实验期间内无死亡现象,是刺参生活的相对安全pH值范围。但是,如果刺参生活环境pH值超过此范围时,对刺参的生长发育产生极为不利的影响,致使刺参产生不同程度的应激反应。本研究表明,刺参适宜生活的水环境pH最高值不宜超过9.2,最低值不宜低于7.2,若超出此pH值范围,持续时间均不宜超过6 d,否则会引起刺参的过度应激反应,引发吐肠、化皮、溃烂甚至病变或者死亡。
3.2 pH对刺参摄食和生长的影响
环境因子在适宜的范围内变化,对水生生物存活和生长影响不大,但超过了适宜的范围就会产生抑制作用。水环境pH变化对水生生物是一种应激,本研究发现,pH在适宜的范围内变化或者短时间内变动,对刺参摄食和生长有一定的积极作用。实验结果显示,当pH在7.4~7.8范围时,短时间内(12 d)刺参出现生长速率加快的现象,这说明在一定范围内相对低pH对刺参生长具有一定的积极作用。究其原因,可能是低浓度的H+降低了刺参肠道中的pH值,有利于创造出适合消化酶发挥活性的低pH环境,从而提高饲料的消化吸收来促进刺参生长。本研究结果与添加酸化剂对罗非鱼()的促生长效应规律类似(潘庆等, 2004)。但随着pH胁迫时间的延长,相对低浓度的pH增益效果逐渐消失,刺参生长受到抑制,进而出现负增长。在高pH环境中,当pH高于8.8时,刺参表现为摄食量减少、消化能力差、排泄粪便不成形、个体出现明显萎缩、肉刺呈圆钝状,整个体表逐渐变得平滑,生长受到显著抑制。本结果与在pH 8.5和pH 9.5水体中的鲫()生长较慢的结果(李文祥等, 2011)相似。
本研究中,高、低pH条件对刺参生长和摄食影响不同,反映出刺参对不同pH的耐受范围不同。长期处在pH胁迫环境中,一方面影响刺参对饲料的摄食和消化利用,另一方面使刺参机体大部分能量用于自身代谢进行内环境酸碱平衡调节,而用于生长的能量大幅减少,这一研究结果与鱼类、甲壳类水生动物有相同的变化规律(洪美玲等, 2007; 李波等, 2011)。本研究结果表明,pH在7.6~8.8范围内,如果是在短时间内变动,其对刺参摄食和生长影响不明显,而若超出此范围或者长时间的胁迫,会对刺参生长产生明显的抑制作用。
3.3 pH对刺参抗氧化酶活性的影响
刺参的免疫机制以非特异性免疫反应为主,研究认为,环境胁迫因子中诸如水体pH、温度、盐度等变化诱导的生理效应可能经由氧化还原途径实现,即环境胁迫因子造成生物体有氧代谢异常,活性氧自由基大量积累而引起氧化损伤(Ryter, 2007)。抗氧化酶在清除活性氧自由基、抵御氧化损伤方面发挥着重要作用。因此,可将抗氧化酶作为评估pH胁迫对生物体产生氧化胁迫效应的一类生物标志物,而SOD和CAT是生物体内重要的抗氧化酶,也是反映生物应对各种胁迫的重要指标(沙飞等, 2015)。SOD能将O2–催化歧化为H2O2和O2,H2O2在CAT的作用下分解成H2O和O2,从而联合清除活性氧自由基,维持细胞和机体的正常活动。
本研究中,在pH 7.4~8.8范围内,SOD活性随着pH胁迫程度的升高逐渐上升,这说明在此pH范围胁迫下,刺参体内的SOD能够有效发挥防御作用,而超出此pH范围,随着pH胁迫强度的增强,当大量产生的活性氧自由基超出刺参自身清除阈值时,SOD不能及时补充,导致SOD活性逐渐下降。CAT活性在pH 7.4~9.0范围内与SOD活性变化趋势一致,这说明SOD与CAT二者在功能上具有相对的独立性,SOD被抑制后CAT会显著提高(沙飞等, 2015),二者联合清除活性氧自由基,协同对机体进行免疫保护。研究结果表明,当pH低于7.4或高于9.0时,随着pH胁迫程度的增强,当抗氧化酶难以抵御大量产生的活性自由基时,刺参抗氧化酶SOD和CAT遭到破坏,机体持续受到氧化损伤,逐渐加剧细胞的变性或者死亡,进而导致刺参的高死亡率,这一点与各实验组刺参存活率的变化结果一致。另外,其他环境胁迫因子如亚硝酸氮对刺参抗氧化酶的影响的研究与本研究结果类似,如低于2.3 mg/L的亚硝酸氮胁迫在短期内提高了SOD和CAT活性,而高于11.5 mg/L的亚硝酸氮胁迫却抑制了SOD和CAT活性(陈芸燕等, 2013)。
3.4 刺参对pH变化的生理适应性
本研究发现,刺参在不同pH胁迫环境条件下,其存活、生长、摄食等均受到不同影响,从宏观角度直接反映出刺参对低pH环境相对于高pH环境的适应性更强,其体内抗氧化酶活性的变化趋势与之基本一致。本研究结果表明,在刺参养殖水环境中,pH对刺参存活、摄食和生长具有显著影响,尤其是在刺参池塘养殖过程中,由于受温度、盐度、水体藻菌相失衡、底质老化、浒苔等大型藻类等因素的影响,池中pH常处于动态变化中。因此,在刺参养殖过程中,科学调控水质和底质,稳定水质理化因子,显得尤为重要,关系到刺参养殖的好坏和成败。将刺参栖息生活的水环境pH保持在7.4~9.0范围内,更有利于刺参的生长发育。
Chang YQ, Sui XL, Li J. The current situation, problem and prospect on theaquaculture. Fishery Science, 2006, 25(4): 198–201 [常亚青, 隋锡林, 李俊. 刺参增养殖业现状、存在问题与展望. 水产科学, 2006, 25(4): 198–201]
Chen YY, Tian XL, Yu X,. Effects of nitrite stress on the non-specific immune response and HSP70 expression of sea cucumber. Periodical of Ocean University of China, 2013, 43(11): 35–42 [陈芸燕, 田相利, 于晓, 等. 亚硝酸氮胁迫对刺参体壁非特异性免疫能力及HSP70表达的影响. 中国海洋大学学报, 2013, 43(11): 35–42]
Dong XL, Li CL, Zhao B,. Effects of low salinity stress on the activities of non-specific immune enzymes and antibacterial activity of sea cucumber. Progress in Fishery Sciences, 2013, 34(3): 82–87 [董晓亮, 李成林, 赵斌, 等. 低盐胁迫对刺参非特异性免疫酶活性及抗菌活力的影响. 渔业科学进展, 2013, 34(3): 82–87]
Dong YW, Dong SL. Advances of ecological physiology in sea cucumber,Selenka. Periodical of Ocean University of China, 2009, 39(5): 908–912 [董云伟, 董双林. 刺参对温度适应的生理生态学研究进展. 中国海洋大学学报, 2009, 39(5): 908–912]
Fang J, Yan MC, Zhang JM,Preliminary studies on the effects of pH and ammonia on growth and survival tojuveniles. Journal of Zhejiang Ocean University (Natural Science), 2008, 27(3): 281–285 [方军, 闫茂仓, 张炯明, 等. pH和氨氮对毛蚶稚贝生长与存活影响的初步研究. 浙江海洋学院学报, 2008, 27(3): 281–285]
Geng CF, Tian Y, Zhang YP,Effects of acute low salinity stress on the physiological indices of. Journal of Fishery Science of China, 2015, 22(4): 666–674 [庚辰帆, 田燚, 张宇鹏, 等. 低盐胁迫对仿刺参相关生理指标的影响. 中国水产科学, 2015, 22(4): 666–674]
He YY, Li J, Liu P,Comparison of the resistance to pH value an ammonia in Chinese shrimp () families. Periodical of Ocean University of China, 2008, 38(5): 761–765 [何玉英, 李健, 刘萍, 等. 中国对虾家系幼体对氨氮和pH值的耐受性比较. 中国海洋大学学报, 2008, 38(5): 761–765]
Hong ML, Chen LQ, Gu SZ,. Effects of ammonia exposure on immunity indicators of haemolymph and histological structure of hepatopancreas in Chinese mitten carb (). Journal of Fishery Sciences of China, 2007, 14(3): 412–418 [洪美玲, 陈立侨, 顾顺樟, 等. 氨氮胁迫对中华绒螯蟹免疫指标及肝胰腺组织结构的影响. 中国水产科学, 2007, 14(3): 412–418]
Hu W, Li CL, Zhao B,Effects of low salinity stress on survival, growth and feeding rate of sea cucumber. Progress in Fishery Sciences, 2012, 33(3): 92–97 [胡炜, 李成林, 赵斌, 等. 低盐胁迫对刺参存活、摄食和生长的影响. 渔业科学进展, 2012, 33(3): 92–97]
Li B, Fan QX, Yang K,. Effects of chronic ammonia stress on foraging, growth and haematological parameters of yellow catfish () juveniles. Chinese Journal of Applied and Environmental Biology, 2011, 17(6): 824–829 [李波, 樊启学, 杨凯, 等. 慢性氨氮胁迫对黄颡鱼摄食、生长及血液指标的影响. 应用与环境生物学报, 2011, 17(6): 824–829]
Li CL, Hu W. The development situation, trend and suggestions on theSelenka aquaculture industry of China. Marine Economy of China, 2017(1): 3–20 [李成林, 胡炜. 我国刺参产业发展状况、趋势与对策建议. 中国海洋经济, 2017(1): 3–20]
Li CL, Song AH, Hu W,. Status analysis and sustainable development strategy of sea cucumberSelenka aquaculture industry in Shandong Province. Progress in Fishery Sciences, 2010, 31(4): 126–132 [李成林, 宋爱环, 胡炜, 等. 山东省刺参养殖产业现状分析与可持续发展对策. 渔业科学进展, 2010, 31(4): 126–132]
Li GR, Ren LH, Sun GH,. Effects of hypoxic stress on oxidative stress indices inProgress in Fishery Sciences, 2016, 37(5): 133–139 [李根瑞, 任利华, 孙国华, 等. 低溶氧胁迫对刺参()氧化应激指标的影响. 渔业科学进展, 2016, 37(5): 133–139]
Li WX, Xie J, Song R,. Effects of pH stress on cortisol and non-specific immunity of. Acta Hydrobiologica Sinica, 2011, 35(2): 256–261 [李文祥, 谢骏, 宋锐, 等. 水体pH对异育银鲫皮质醇激素和非特异性免疫的影响. 水生生物学报, 2011, 35(2): 256–261]
Pan Q, Tan YG, Bi YZ,Effects of acid supplement on growth and feed utilization in tilapia´. Journal of Fisheries of China, 2004, 28(6): 682–688 [潘庆, 谭永刚, 毕英佐, 等. 酸制剂对罗非鱼生长和饲料利用的影响. 水产学报, 2004, 28(6): 682–688]
Ryter SW, Kim HP, Hoetzel A,. Mechanisms of cell death in oxidative stress. Antioxidants & Redox Signaling, 2007, 9(1): 49–89
Sha F, Chang YQ, Ding J. Effects of two cooling modes of low temperature stress on antioxidant enzyme activities and malondiadehyde level in sea cucumberJournal of Dalian Ocean University, 2015, 30(1): 25–29 [沙飞, 常亚青, 丁君. 两种降温模式的低温胁迫对刺参抗氧化酶活性及丙二醛含量的影响. 大连海洋大学学报, 2015, 30(1): 25–29]
Wu P, Cao ZH, Yang LR,. Effects of pH on survival and growth to yellow catfish). Reservoir Fisheries, 2001, 21(6): 3–6 [吴萍, 曹振华, 杨立荣, 等. pH对黄颡鱼生存和生长的影响. 水利渔业, 2001, 21(6): 3–6]
Yuan XT, Yang HS, Wang LL,. Effects of salinity on energy budget in pond-cultured sea cucumber(Selenka). Aquaculture, 2010, 306: 348–351
Zang YQ, Tian XL, Dong SL,. The activities of immunoenzymes and heat shock protein 70 content of sea cucumber,(Selenka) to chronic stress of ammonical nitrogen. Periodical of Ocean University of China, 2012, 42: 60–66 [臧元奇, 田相利, 董双林, 等. 氨氮慢性胁迫对刺参免疫酶活性及热休克蛋白表达的影响. 中国海洋大学学报, 2012, 42: 60–66]
Zeng YY, Ai CX, Liu JG,. Effects of pH on some immune factors of mud crab,. Journal of Xiamen University (Natural Science), 2008, 47(3): 413–418 [曾媛媛, 艾春香, 刘建国, 等. pH胁迫对拟穴青蟹体内几种免疫因子的影响. 厦门大学学报(自然科学版), 2008, 47(3): 413–418]
Zhao B, Hu W, Li CL,The effects of low salinity on the growth and activities of digestive enzymes in sea cucumberProgress in Fishery Sciences, 2015, 36(1): 91–96 [赵斌, 胡炜, 李成林, 等. 低盐环境对3种规格刺参()幼参生长与消化酶活力的影响. 渔业科学进展, 2015, 36(1): 91–96]
Zhao W, Liang M, Zhang P. Effect of yeast polysaccharide on the immune function of juvenile sea cucumber,Selenka under pH stress. Aquaculture International, 2010, 18(5): 777–786
Zhao XY, Li J, Chen P,. Effects of pH stress on survival rate and activities of ion-transport enzyme, immune-related enzymes in three species of shrimps. Journal of Shanghai Ocean University, 2011, 20(5): 720–728 [赵先银, 李健, 陈萍, 等. pH胁迫对3种对虾存活率、离子转运酶和免疫酶活力的影响, 上海海洋大学学报, 2011, 20(5): 720–728]
Effects of pH Stress on Survival Rate, Growth and Antioxidant Enzyme Activities of the Sea Cucumber,Selenka
HAN Sha1, HU Wei1, LI Chenglin1①, ZHU Xibo2, ZHAO Bin1, ZHANG Shaochun1, SUN Yongjun3
(1. Marine Biology Institute of Shandong Province, Qingdao 266104; 2. Extension Station of Fishery Technology of Lanshan District, Rizhao 276800; 3. Haodangjia Group Corporation, Weihai 264300)
pH is an important environmental factor affecting the survival, growth, and immunity of aquatic animals. In general, alteration of environmental conditions often results in pH fluctuation in the aquaculture water ofSelenka. However, little is known about the physiological response of sea cucumbers under pH stress. Therefore, the survival rate, growth, and antioxidant enzyme activities of sea cucumbers (7.02±0.81 g) were analyzed under different pH (control group, pH=8.4), low pH (pH 6.8, 7.0, 7.2, 7.4, 7.6, and 7.8), high pH (pH 8.6, 8.8, 9.0, 9.2, 9.4, and 9.6)) stress for 36 days. The survival rate of sea cucumbers decreased gradually with pH intension increasing and time extension, which in the groups ranging from pH 7.4 to pH 9.0 were 100%. There appeared to be a stress response and then death of individuals in the groups of pH 6.8, 7.0 and 9.6 from the third day, in which the whole group of sea cucumbers died after 30 days. Under different pH stress, the growth of the sea cucumbers differed significantly. The specific growth rate decreased with pH intension increasing and growth was negative growth in the group of pH 9.0. The superoxide dismutase (SOD) and catalase (CAT) activity of sea cucumbers among the pH treatment groups increased and was significantly higher than those of the control group, which increased at first and then decreased with pH intension increasing. The activity of SOD and CAT of sea cucumber in low pH groups increased to (74.92±2.24) U/ml and (14.99±2.38) U/ml peaking at pH 7.4, which was significantly higher than the control group. While in high pH groups, the activity of SOD and CAT of sea cucumber increased to (72.90±1.10) U/ml and (15.68±0.89) U/ml, peaking at pH 8.8 and pH 9.0 respectively. The results indicate that the pH range from 7.4 to 9.0 is appropriate for survival and growth of sea cucumbers, otherwise stress responses and even death of sea cucumbers are imminent.
Selenka; pH; Survival; Growth; Antioxidant enzyme
* 泰山产业领军人才工程(LJNY201613)、山东省现代农业产业技术体系刺参产业创新团队建设工程(SDAIT-22-01; SDAIT-22-05)、山东省农业良种工程、山东省科技发展计划(2014GNC111022)和山东省星火科技示范项目(2015XH006)共同资助[This work was supported by Taishan Industry Leading Talents Project (LJNY201613), Sea Cucumber Innovation Team of Shandong Province Agriculture Research System (SDAIT-22-01, SDAIT-22-05), Agriculture Seed Project of Shandong Province, Science and Technology Development Project of Shandong Province (2014GNC111022), and Spark Program of Shandong Province (2015XH006)]. 韩 莎,E-mail: shahan_2012@163.com
李成林,研究员,E-mail: lcl_xh@hotmail.com
LI Chenglin, E-mail: lcl_xh@hotmail.com
2017-08-22,
2017-10-26
10.19663/j.issn2095-9869.20170822001
韩莎, 胡炜, 李成林, 朱夕波, 赵斌, 张少春, 孙永军. pH胁迫对刺参存活、生长及抗氧化酶活性的影响. 渔业科学进展, 2018, 39(5): 91–98 Han S, Hu W, Li CL, Zhu XB, Zhao B, Zhang SC, Sun YJ. Effects of pH stress on survival rate, growth and antioxidant enzyme activities of sea cucumber, Apostichopus japonicus Selenka. Progress in Fishery Sciences, 2018, 39(5): 91–98
S917.4
A
2095-9869(2018)05-0091-08
(编辑 冯小花)

