VTD方案治疗多发性骨髓瘤临床分析
221000徐州市中心医院血液科
多发性骨髓瘤(MM)是一种目前难以完全治愈的浆细胞恶性疾病,约占血液系统恶性疾病的20%,也是排名第2位的血液系统恶性疾病[1-2]。MM的发病高峰50~60岁,中位发病年龄约60岁,<40岁发病极少。肿瘤的靶向治疗是当今肿瘤治疗的研究热点。2003年5月,靶向治疗药物蛋白酶体抑制剂硼替佐米(Bortezomib)被FDA批准用于MM的治疗,取得了满意的效果,同时应用地塞米松可能增强抗骨髓瘤的效果[3]。对2010年1月-2017年11月初诊/复发性MM的40例患者应用硼替佐米、沙利度胺及地塞米松(VTD)方案进行了治疗,现报告如下。
资料与方法
2010年1月-2017年10月收治MM患者40例,诊断依据国际骨髓瘤工作组(IMWG)2003年提出的诊断标准,分期分别采用Durie-Salmon(D-S)分期和2005年IMWG提出的国际分期系统(ISS)。患者的详细资料,见表1。
治疗方案:所有患者采用VTD方案治疗,具体用法如下,硼替佐米1.3 mg/(m2·d),静脉注射或皮下注射第1、4、8、11天;沙利度胺100 mg,每晚顿服;地塞米松20~40 mg,第1、2、4、5、8、9、11和12天或d1~4,d9~12,每21 d为1个疗程。用药当天血小板<30×109/L时或有感染时,暂推迟,待血小板>30×109/L或感染控制后继续使用。若出现严重不能耐受的不良反应须停药。患者接受2~11个疗程治疗。
随访和疗效观察:所有接受VTD治疗的患者随访至2017年11月30日,中位随访时间29.5(3~166)个月。疗效判断参照国际多发性骨髓瘤(IMWG)标准,每个疗程结束后进行评估。疗效分为完全缓解(CR)、非常好的部分缓解(VGPR)、部分缓解(PR)、轻微反应(MR)、病情稳定(SD)、病情进展(PD)。化疗前后进行血常规、尿常规、肝肾功能、血清免疫电泳、尿蛋白电泳、血尿β2微球蛋白测定、骨髓细胞形态学检查。有效率为CR+VGPR+PR,不良反应参照通用不良反应术语标准3.0版本(CTCAE v3.0)进行判定。无进展生存期(PFS)为患者接受硼替佐米治疗之日至疾病发生进展之日的时间。生存期为自确诊之日起至患者死亡(任何原因)或末次生存随访日为止。
统计学处理:采用SPSS 17.0分析,计量资料采用(±s)表示,采用t检验;计数资料采用n(%)表示,采用2检验。P<0.05表示差异有统计学意义。
结 果
治疗效果:接受VTD方案治疗的初治MM患者34例,治疗总体反应率88.2%(30/34例),其中 CR+VGPR 61.8%(21/34例),PR 20.0%(8/34例)。获得CR/VGPR的21例患者中,18例接受2个疗程治疗后即获得CR/VGPR,3例在接受3个疗程治疗后获得CR/VGPR。6例MM患者之前应用VAD、DECP方案治疗后病情进展,之后再使用VTD方案治疗,其中4例患者获得治疗反应,2例患者经2~4个疗程治疗后病情无改善,因多脏器功能衰竭而死亡。初治及难治复发患者总反应率分别为88.2%和66.7%,差异无统计学意义(P>0.05),见表2。
不良反应:40例接受VTD方案治疗的患者表现的血液学不良反应主要为血小板减少和白细胞减少。血小板减少5例(12.5%),按CTCAE v3.0分级达3或>4级需要输注血小板支持2例(5.0%),发生白细胞减少6例(15.0%),其中1例>3级,加用粒细胞集落刺激因子支持治疗。非血液学不良反应主要表现为周围神经病变(PN),发生率达75.0%(30/40例),27例患者表现为四肢末端麻木不适、针刺样痛觉过敏,给予甲钴胺、卡马西平等治疗后症状可减轻。1例VTD方案化疗4个疗程的MM患者,出现达4级的PN,表现为手足麻木、疼痛并Ⅲ级肌力下降,影响睡眠和行走,后暂停硼替佐米的治疗,予甲钴胺营养支持止痛对症治疗,同时将沙利度胺减量,2个月后症状改善后继续予VTD方案化疗。1例患者在应用VTD方案治疗5个疗程后出现腹胀、腹痛、停止排便和排气,腹部平片示有气液平,提示不全性肠梗阻,经禁食、胃肠减压、抑酸、生长抑素、保留灌肠、营养支持等治疗后好转,后继续应用VTD方案治疗,未再出现肠梗阻表现。另1例患者应用第3周期VTD方案化疗期间出现麻痹性肠梗阻,予积极保守治疗,腹部症状改善,但患者在第4周期VTD方案化疗中再次出现肠梗阻,遂终止治疗。
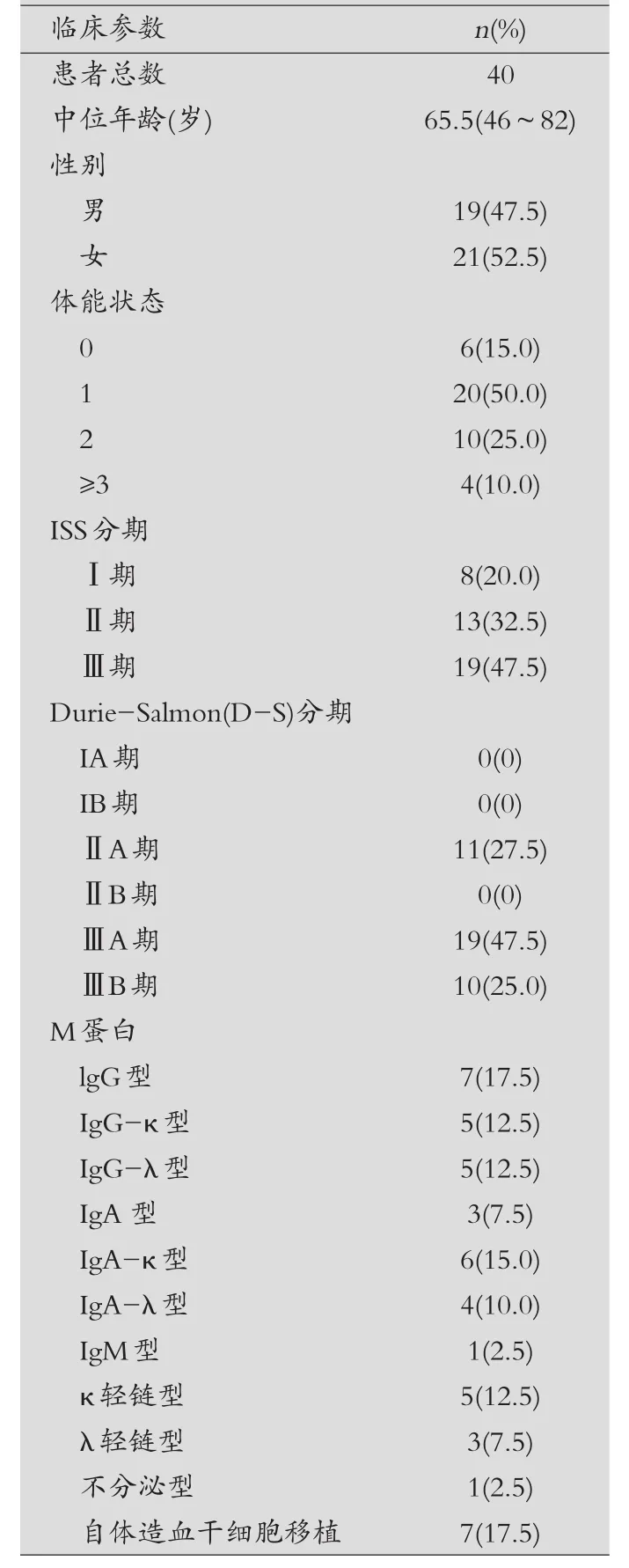
表1 MM患者临床资料

表2 MM患者应用VTD方案治疗的疗效[n(%)]
随访所有患者均从使用硼替佐米时纳入随访,随访至2017年12月31日,中位随访时间29.5(3~166)个月。可随访的有治疗反应(CR+VGPR+PR)的28例初治MM组患者中位无进展生存时间(PFS)38(6~109)个月,中位总生存时间(OS)75(15~127)个月。
讨 论
MM是仅次于非霍奇金淋巴瘤的第2位血液系统恶性肿瘤,其发病可能与染色体异常、骨髓微环境失调、CCND和FGFR3/MMSET表达异常有关,PI3K/Akt/mTOR、 Ras/Raf/MEK/MAPK、 JAK/STAT、 NF- κB、 Wnt/β-catenin、 and RANK/RANKL/OPG信号通路的异常活化参与了MM的发病[4-7]。
硼替佐米是首个获美国食品和药物监督管理局(FDA)批准用于MM治疗的蛋白酶体抑制剂,其主要通过竞争性抑制26S蛋白酶体糜蛋白样活性,干扰细胞内蛋白质代谢,诱导MM细胞凋亡从而发挥抗肿瘤效应[8-9]。硼替佐米的应用使得MM的治疗取得了突破性的进展,极大改善了MM患者的缓解率及长期生存情况。我们应用含硼替佐米的VTD方案治疗40例患者,其中初诊病例34例,复发难治MM 6例,总反应率分别为88.2%和66.7%,初治MM组患者的PFS 38(6~109)个月,OS 75(15~127)个月。
采用含VTD方案治疗MM过程中最值得重视的毒性反应是周围神经病变(PN),部分患者的PN有时很严重,显著影响患者的生活质量。本组病例中30例发生周围神经病变,可表现为四肢末端麻木不适、针刺样痛觉过敏、麻痹性肠梗阻,经予减低剂量、停药、延长用药间隔时间及应用营养神经药物等治疗后大部分患者的症状好转。VTD方案治疗过程中另一发生率较高的不良反应是血细胞减少,及时予提升白细胞计数、输注血小板等对症支持治疗后血细胞可恢复,需警惕由于MM患者体液免疫功能低下,加之化疗后骨髓造血受抑,极易合并感染,故治疗中需严密监测感染征象,及时加用抗生素、抗真菌药和(或)抗病毒药物治疗。
但随着硼替佐米在临床应用中的日益增多,多数患者在疾病后期不可避免地面临药物耐药以及疾病复发,研究发现,PSMB5基因突变、蛋白酶体蛋白的成熟与表达异常、未折叠蛋白反应(UPR)受抑、细胞自噬激活等可能参与了硼替佐米的耐药[10-13]。
综上所述,含硼替佐米的VTD方案治疗多发性骨髓瘤有效率较高,绝大多数患者对其不良反应可耐受,对初治患者疗效最显著,值得在临床推广应用,目前已作为中国MM指南的一线推荐方案,且硼替佐米已纳入地方医保目录。但值得注意的是,尽管新的治疗,如蛋白酶体抑制剂、免疫调节剂的出现改善了MM患者的疗效,大多数患者仍在初始治疗后出现病情进展,联合化疗后序贯自体造血干细胞移植可在一定程度上改善MM患者的生存,但很难治愈,故仍需开发新的药物,新一代蛋白酶体抑制剂、嵌合抗原受体T细胞免疫疗法(CAR-T疗法)、CD38单抗等的出现可能为此类患者带来福音[14-18],使患者的预后得到改善。

