人源S100A8重组质粒的构建及其对他莫昔芬治疗乳腺癌的影响
汪彦阳,陶志嵩,徐 佩
南京鼓楼医院 核医学科 (南京 210000)
S100家族是一类低分子量(9~14 kD)的酸性蛋白质,是一类具有高度结构同源性的钙结合蛋白。在目前发现的21个家族成员中,S100A8、S100A9是比较重要的两个, 该家族成员可高选择性和高亲和性地结合Ca2+Zn2+等离子,从而引起其结构改变,使其与靶蛋白结合,调节靶蛋白的活性[1]。其中,S100A8在目前的研究中被发现与多种肿瘤的化疗药物耐药性密切相关。S100A8可以通过促进自噬从而使白血病细胞发生化疗耐药[2]。而在乳腺癌的治疗中,S100A8被发现与雌激素受体的缺失密切相关,同时,S100A8可以与S100A9形成复合物,而这类复合物分泌的增多又会造成乳腺癌细胞对多柔比星联合环磷酰胺治疗的耐药性[3-4]。S100A8很可能是造成乳腺癌治疗耐药性的重要分子。因此,本研究通过构建人源S100A8的重组质粒,从而深入探究S100A8与乳腺癌他莫昔芬耐药的关系,为研究乳腺癌他莫昔芬耐药的机制奠定基础。
1 材料与方法
1.1 材料
含myc标签的载体pCMV5-myc,感受态细胞以及人乳腺癌细胞株MCF7均由南京医科大学苏东明教授馈赠;人源S100A8基因引物由上海捷瑞生物工程有限公司合成;Primer Star DNA聚合酶、内切酶NdeⅠ和BamHⅠ以及T4 DNA 连接酶均购自日本Takara公司;Lipofectamine 2000购自美国Invitrogen公司;小量胶回收试剂盒与质粒纯化试剂盒购自美国Axygen公司;S100A8、BCL2、GAPDH抗体购自美国Proteintech公司,MTT试剂盒购自美国Sigma公司。
1.2 方法
1.2.1 质粒的提取、酶切、连接、转化以及细菌感受态的制备 具体操作详见参考文献[5]。
1.2.2 人源S100A8基因cDNA片段的获得 以人源S100A8基因cds区为模板, 设计引物并合成,利用高保真酶Primer Star DNA 聚合酶进行PCR扩增。上游引物:5'-GGAATTCCATATGATGT TGACCGAGCTGGAG-3';下游引物:5'-CGGGA TCCCTACTCTTTGTGGCTTTCTT-3'(上下游引物5'端分别引入NdeⅠ和BamHⅠ的酶切位点)。扩增条件为:98 ℃预变性5 min,接着98 ℃ 10 s→55 ℃退火15 s→72 ℃延伸1 min(30个循环),接着72 ℃继续延伸10 min。扩增完成后,按小量胶回收试剂盒与质粒纯化试剂盒说明进行切胶回收获得纯化目的片段。
1.2.3 细胞培养 MCF7细胞株培养在含10% FBS、100 U/mL 青霉素、100 μg/mL 链霉素的RPMI-1640培养液内。MCF7细胞采用培养皿或培养板培养于5%CO2、37 ℃的恒湿培养箱中。
1.2.4 重组质粒的细胞转染以及蛋白表达鉴定 采用脂质体Lipofectamine 2000 分别转染对照质粒pCMV5-myc以及重组质粒pCMV5-myc-S100A8到MCF7细胞中,具体操作详见参考文献[6]。转染24 h后,用蛋白裂解液裂解细胞并收集总蛋白,之后通过Western Blot的方法进行检测[5]。本研究使用的抗体的稀释浓度为:anti-S100A8(1∶1 000),anti-GAPDH(1∶4 000),anti-BCL2(1∶1 000)。
1.2.5 MTT检测细胞活力 使用美国Sigma公司的MTT检测试剂盒进行检测,具体操作详见相关参考文献[7]。
1.3 统计学分析
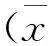
2 结果
2.1 质粒的构建及鉴定
2.1.1 S100A8基因cDNA片段的获得 通过PCR反应,获得长度为354 bp的人源S100A8基因cDNA片段。
2.1.2 重组质粒的酶切鉴定与测序 重组质粒pCMV5-myc-S100A8构建成功后用NdeⅠ和BamHⅠ进行酶切鉴定。双酶切后产生两个片段,其大小分别为4 321 bp以及354 bp左右,与设想的结果相一致。将构建好的质粒委托上海华大测序公司进行DNA测序分析,结果与目的片段完全一致,没有任何突变,证明重组质粒构建成功(图1)。

图1 重组质粒pCMV5-myc-S100A8的酶切鉴定
注:1:pCMV5-myc;2:pCMV5-myc-S100A8; M:Marker
2.1.3 重组质粒在人乳腺癌细胞株MCF7中的表达鉴定 将成功构建的重组质粒转染MCF7细胞,用蛋白裂解液裂解细胞提取细胞总蛋白,通过Western Blot方法验证pCMV5-myc-S100A8在人乳腺癌细胞株中成功表达S100A8蛋白(图2)。

图2S100A8重组质粒转染人乳腺癌细胞株MCF7的表达鉴定
注:1:转染pCMV5-myc对照组; 2:转染pCMV5-myc-S100A8组
2.2 过表达S100A8对人乳腺癌细胞株的影响
2.2.1 过表达S100A8可以部分逆转他莫昔芬造成的细胞活力下降 在MCF7细胞中,分别梯度转染S100A8重组质粒,转染24 h后用5 μM的他莫昔芬以及其溶剂DMSO对照处理细胞,处理24 h后,用MTT法检测细胞活力。结果显示:S100A8可以梯度逆转由他莫昔芬造成的MCF7细胞活力下降(图3)。

图3 过表达S100A8部分逆转他莫昔芬造成的MCF7细胞活力下降
注: ##表示他莫昔芬处理的对照组与DMSO处理的对照组相比;*表示他莫昔芬处理的过表达组与他莫昔芬处理的对照组相比;**表示他莫昔芬处理的过表达组与他莫昔芬处理的对照组相比
2.2.2 S100A8通过BCL2部分逆转他莫昔芬造成的效应 在MCF7细胞中分别梯度过表达S100A8,转染24 h后,再用5 μM他莫昔芬处理24 h,之后收取细胞总蛋白,用Western Blot的方法检测BCL2、S100A8的蛋白表达。本研究发现梯度过表达S100A8在他莫昔芬的处理下,可以梯度升高BCL2的蛋白表达水平(图4)。

图4过表达S100A8通过BCL2部分逆转他莫昔芬对MCF7细胞的效应
3 讨论
近年来,乳腺癌的发病率逐渐提高,成为女性最常见的罹患肿瘤。而其中,有大约50%的雌激素受体阳性的乳腺癌病人会在接受他莫昔芬以及其他芳香酶抑制剂类化疗药物之后发生复发或者耐药[8]。
S100A8这个S100的重要家族成员越来越被现今的研究者关注。作为一种钙结合蛋白,它可以高选择性和高亲和性地结合Ca2+Zn2+等离子,从而引起其结构改变,使其与靶蛋白结合,调节靶蛋白的活性[9-11]。而同时,已有研究[3,12]证明,S100A8与乳腺癌治疗过程中发生缺失相关。Bao等[3]曾报道,在MCF7细胞中,S100A8/A9的表达与雌激素受体的表达呈负相关,高表达的S100A8/A9能够抑制雌激素受体的mRNA水平从而降低雌激素受体的表达。同时,体外实验[3]表明,在MCF7细胞中长期高表达S100A8/A9会使雌激素受体的表达发生缺失,其具体的分子机制有待进一步探究。研究[2]表明,S100A8与各类肿瘤经过化疗后发生耐药以及复发有关,而其中机制又各不相同。例如,在白血病细胞中,S100A8是通过促进自噬从而使其发生耐药。但是,在乳腺癌细胞中,研究者[3-4, 13]发现,S100A8可以和S100A9结合形成复合物,而这种复合物又是乳腺癌细胞对多柔比星联合环磷酰胺治疗发生耐药的原因。在肿瘤细胞中,存在一个CXCL1/2-S100A8/S100A9的环形通路,该通路是肿瘤细胞的生存轴,将肿瘤细胞的耐药与侵袭密切联系在一起,尤其在乳腺癌细胞中,当使用化疗药物时,该通路会被高度激活。
临床上大部分雌激素受体阳性的乳腺癌患者会使用他莫昔芬这种药物进行治疗,而该药物发生耐药性的病例也非常普遍[14-16]。鉴于S100A8与雌激素受体的关联以及与肿瘤耐药性的发生息息相关,因此,本研究构建了S100A8的重组质粒并且在雌激素受体阳性的乳腺癌细胞株MCF7中进行了初步探究,以期能深入探索S100A8在他莫昔芬耐药的乳腺癌细胞中的分子机制。
综上所述,本研究成功构建好携带myc标签的S100A8重组质粒,并成功在MCF7细胞中表达。同时,本研究的结果显示,在梯度过表达S100A8之后,用5 μM他莫昔芬处理,可以梯度逆转他莫昔芬对乳腺癌细胞造成的细胞活力下降。而在分子水平,在MCF7细胞中梯度过表达S100A8,同时用5 μM他莫昔芬处理,其抗凋亡分子BCL2的表达水平也梯度升高。因此,S100A8与雌激素受体的乳腺癌他莫昔芬耐药有一定关联。S100A8的重组质粒为阐明其耐药机制以及寻找早治疗靶点奠定了基础。

