H2S调节miR-21表达抑制内质网应激介导肺成纤维化细胞凋亡①
赵 红 姚平波
(南华大学护理学院,衡阳421001)
成纤维细胞增生在肺纤维化形成过程中扮演着重要的角色。目前认为:基质金属蛋白酶(ADAMTS-1)、血管紧张素1-7(Ang1-7)、内质网应激反应等信号通路能够诱导肺成纤维细胞凋亡介导成纤维细胞增生[1-3]。如何有效减少内质网应激诱导肺纤维化细胞的凋亡、拮抗肺成纤维化细胞的增殖,目前仍然是肺纤维化靶向药物研究的热点。我们前期研究发现:H2S能介导PD-1/PD-L1信号通路对实验性大鼠肺纤维化具有潜在内源性的保护作用[4];同时,本课题组研究还发现:miR-21在小鼠肺成纤维化细胞模型中可介导ADAMTS-1/TGF-β1信号通路促肺纤维化[5]。近年来研究发现,TGF-β1诱导肺纤维化可介导内质网应激(Endoplasmic reticulum stress,ERS),过度ERS可诱导细胞凋亡介导肺纤维化的病理生理过程[6]。Beermann等[6,7]研究发现:通过调控lncRNA的表达,亦可减少ERS介导的小鼠肺成纤维化细胞凋亡及增殖,从而起到保护肺细胞的作用。因此,本研究通过细胞实验进一步观察H2S是否能够抑制内质网应激诱导肺纤维化的细胞凋亡?假如是,是否H2S调控miR-21表达抑制内质网的应激起到保护肺纤维化的作用?
1 材料与方法
1.1主要试剂与药品 DMEM培养液(Sigma-Aldrich);胎牛血清(20%FBS,Gibco);化学修饰的miR-21 agomir、miR-21 antagomir、蛋白提取试剂盒、CCK-8细胞增殖检测试剂盒(广州市锐博生物科技有限公司);NaHS(美国Sigma);TGF-β1、GRP78、caspase-12、CHOP及甘油醛-3-磷酸脱氢酶(GAPDH)等抗体(Santa Cruz,USA)。
1.2方法
1.2.1成纤维化细胞培养 NIH3T3(购自中国典型培养物保藏中心),其培养内容详细见本课题组前期的报道[1]。
1.2.2分组 对照组:不加入TGF-β1,普通细胞培养箱(37℃,5%CO2及95%空气)孵育24 h;TGF-β1组:NIH3T3加入TGF-β1(5 μg/L)培养24 h;NaHS干预组:NIH3T3加入TGF-β1(5 μg/L)培养24 h前1 h给予NaHS(40 μmol/L)预处理。为进一步观察miR-21是否参与H2S抑制ERS介导的小鼠成纤维化细胞凋亡,将其分为如下3组:阴性对照组: 转染miR-21阴性对照片段(50 μmol/L)24 h后,给予NaHS(40 μmol/L)预处理, 再行TGF-β1处理;miR-21 agomir组:转染miR-21模拟剂(50 μmol/L)24 h后,NaHS(40 μmol/L)预处理,再行TGF-β1处理;miR-21 antagomir组:转染 miR-21拮抗剂(50 μmol/L)24 h后, 给予NaHS(40 μmol/L)预处理,再行TGF-β1处理。miR-21阴性对照片段、miR-21 agomir及miR-21 antagomir转染方法详细见试剂盒说明书操作。
1.2.3凋亡及增殖的检测 流式细胞仪和CCK-8分别检测NIH3T3细胞凋亡率及其增殖。
1.2.4Western blot 募集细胞后PBS洗涤3次,加入裂解液裂解悬浮细胞,然后置于冰上半小时后,将其在4℃下离心(10 000 r/min,10 min),提取上清液,用BCA法测定蛋白质浓度,随后电泳(SDS-PAGE),采用硝酸纤维素(PVDF)电转膜;5%脱脂牛奶封闭1 h后,加入一抗(miR-21、GRP78、CHOP、caspase-12及β-actin),4℃12 h TBST洗膜20 min加入辣根过氧化物酶标记的二抗,室温孵育2 h TBST洗膜10 min,然后用化学发光法显色,采集图像(UVP 型凝胶图像分析系统),分析条带积分吸光度(Imag J 软件)。计算目的蛋白(miR-21、GRP78、CHOP及caspase-12)相对量。
1.2.5qRT-PCR 提取其RNA(TRIzol法),逆转录得到cDNA,然后行PCR循环取RT-PCR产物电泳(1.2%琼脂糖凝胶),miR-21、GRP78、caspase-12及CHOP等加样后溴化乙锭染色,电泳条带采用UVP型凝胶图像分析系统做积分吸光度测定和分析。取逆转录产物10 μl,在荧光实时定量PCR仪上进行PCR循环反应,经溶解曲线分析PCR反应产物为单独的双链DNA。采用ΔΔCt值法, 以GAPDH为内参定量miR-21、GRP78、caspase-12及CHOP mRNA表达。基因引物序列由上海生物工程有限公司合成。引物序列见表1。
1.3统计学方法 采用SPSS18.0软件包,计量资料两组比较采用t检验,多组数据比较采用F检验或单因素方差分析,计量资料采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1NaHS对细胞凋亡率、增殖率、miR-21蛋白和mRNA的影响 与对照组比较,TGF-β1组细胞凋亡率、增殖率、miR-21蛋白和mRNA均明显升高(P<0.01);与TGF-β1组比较,NaHS干预组细胞凋亡率、增殖率、miR-21蛋白和mRNA均明显降低(P<0.05)。见表2。
表1荧光实时定量PCR所用引物序列
Tab.1Primersequencesusedbyreal-timefluorescencequantitativePCR
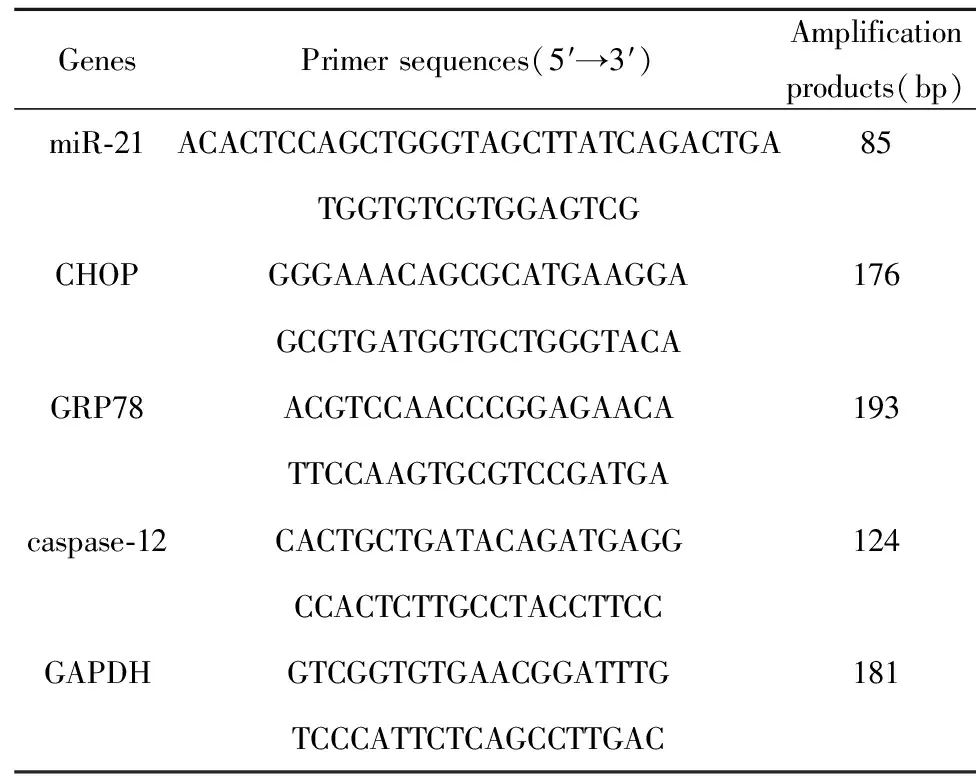
GenesPrimer sequences(5′→3′)Amplificationproducts(bp)miR-21ACACTCCAGCTGGGTAGCTTATCAGACTGA85TGGTGTCGTGGAGTCGCHOPGGGAAACAGCGCATGAAGGA176GCGTGATGGTGCTGGGTACAGRP78ACGTCCAACCCGGAGAACA193TTCCAAGTGCGTCCGATGAcaspase-12CACTGCTGATACAGATGAGG124CCACTCTTGCCTACCTTCCGAPDHGTCGGTGTGAACGGATTTG181TCCCATTCTCAGCCTTGAC
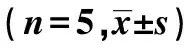
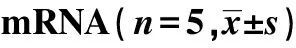

GroupsThe rate of cell apoptosisThe rate of cell proliferationmiR-21 ProteinsmRNAControl5.64±1.2212.48±1.231.14±0.071.00±0.05TGF-β124.31±2.791)27.89±1.661)4.12±0.231)3.15±0.131)NaHS6.72±1.902)13.28±1.412)1.36±0.112)1.17±0.092)
Note:1)P<0.01 vs control; 2)P<0.05,3)P<0.01 vs TGF-β1.
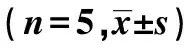
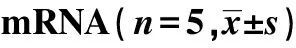
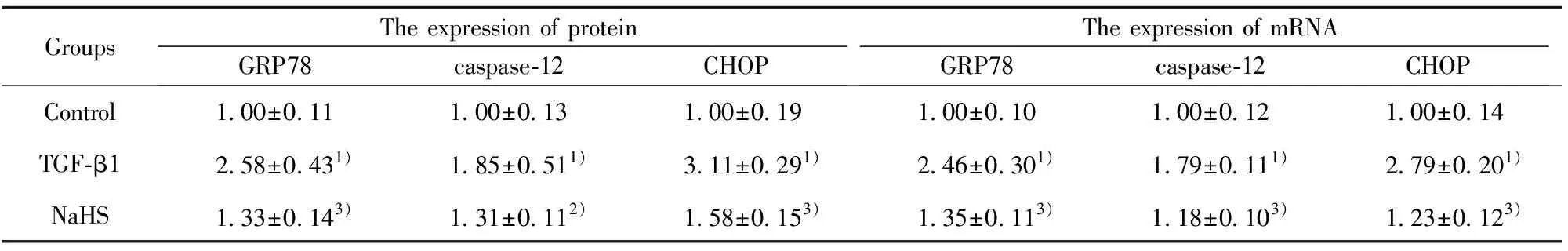
GroupsThe expression of proteinGRP78caspase-12CHOPThe expression of mRNAGRP78caspase-12CHOPControl1.00±0.111.00±0.131.00±0.191.00±0.101.00±0.121.00±0.14TGF-β12.58±0.431)1.85±0.511)3.11±0.291)2.46±0.301)1.79±0.111)2.79±0.201)NaHS1.33±0.143)1.31±0.112)1.58±0.153)1.35±0.113)1.18±0.103)1.23±0.123)
Note:1)P<0.01 vs control;2)P<0.05,3)P<0.01 vs TGF-β1 .
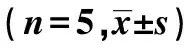
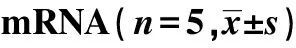
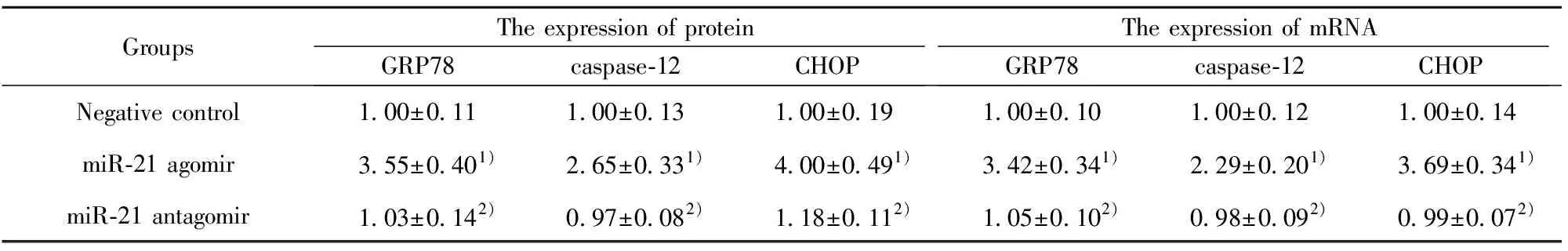
GroupsThe expression of proteinGRP78caspase-12CHOPThe expression of mRNAGRP78caspase-12CHOPNegative control1.00±0.111.00±0.131.00±0.191.00±0.101.00±0.121.00±0.14miR-21 agomir3.55±0.401)2.65±0.331)4.00±0.491)3.42±0.341)2.29±0.201)3.69±0.341)miR-21 antagomir1.03±0.142)0.97±0.082)1.18±0.112)1.05±0.102)0.98±0.092)0.99±0.072)
Note:1)P<0.01 vs control;2)P<0.01 vs TGF-β1 .
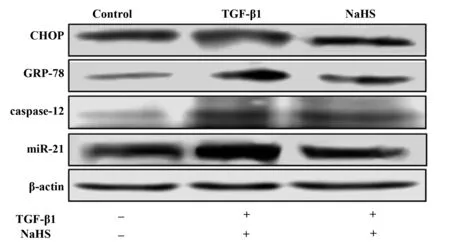
图1 Western blot检测不同组NIH3T3细胞的内质网应激蛋白表达Fig.1 Detection the expression of proteins of ERS in NIH3T3 cells of different groups by Western blot method

图2 Western blot检测miR-21对NIH3T3细胞的内质网应激蛋白表达的影响Fig.2 Detection the effect of miR-21 on expression of proteins of ERS in NIH3T3 cells by Western blot method
2.2内质网应激相关因子的蛋白和mRNA表达的比较 与对照组比较,TGF-β1组内质网应激相关因子GRP78、caspase-12及CHOP蛋白和mRNA均明显升高(P<0.01);与TGF-β1组比较,NaHS干预组内质网应激相关因子GRP78、caspase-12及CHOP蛋白和mRNA均明显降低(P<0.05)。见表3及图1。
2.3miR-21对NIH3T3细胞的内质网应激蛋白和mRNA表达的影响 与对照组比较,miR-21 agomir组内质网应激相关因子GRP78、caspase-12及CHOP蛋白和mRNA均明显升高(P<0.01);与miR-21 agomir组比较,miR-21 antagomir组内质网应激相关因子GRP78、caspase-12及CHOP蛋白和mRNA均明显降低(P<0.05)。见表4及图2。
3 讨论
本课题组前期研究还证实:外源性H2S介导TGF-β1/Smad信号通路下调α-SMA及抑制ColⅠ、ColⅢ合成从而起到抗肺纤维化作用[8]。近年来证据表明:H2S可诱导内质网应激-自噬信号通路介导凋亡相关酶的去泛素化修饰或磷酸化修饰来调控ERS的稳态,起到改善糖尿病大鼠心肌纤维化的作用[9]。因此,本研究进一步探讨H2S是否调控内质网应激稳态,减轻细胞凋亡抑制肺纤维化;是否与miR-21的调控密切相关将是本研究的新视角。
内质网是重要的细胞器之一,许多疾病的发生发展都与内质网的功能稳态息息相关。大量研究表明:内环境失衡,如缺血/再灌注损伤、炎症介质爆炸性释放、氧化应激、细胞自由基失衡、Ca2+稳态失衡等可引起内质网功能障碍,导致内质网应激[10]。内质网应激可启动细胞凋亡信号通路(标志物如caspase-12)、内质网未折叠蛋白反应(标志物如GRP78、CHOP)和炎性信号通路[11-13]。研究也证实:适度的ERS可通过磷酸化或去泛素化修饰未折叠/错误折叠蛋白,恢复机体内环境稳态,维持细胞的正常生命活动,一旦有害的ERS持续进行可导致细胞凋亡[11-14]。因此,内质网应激可能是参与肺纤维化发生发展过程中的关键的病理生理机制之一。本实验结果证实:GRP78、CHOP与caspase-12表达趋势反映了ERS凋亡信号通路的细胞活性。
本研究结果提示:NaHS预处理体外培养的小鼠成纤维化细胞,可显著减少TGF-β1诱导NIH3T3细胞肺纤维化过程中的细胞凋亡率及增殖率。证实了外源性H2S对TGF-β1损伤的小鼠成纤维化细胞具有内源性保护作用;同时还证实:外源性H2S可减少TGF-β1损伤的小鼠成纤维化细胞GRP78、CHOP与caspase-12的表达,表明外源性H2S可减少TGF-β1诱导的ERS性细胞凋亡。另外,外源性H2S可降低TGF-β1损伤的小鼠成纤维化细胞miR-21的表达水平,更进一步证实miR-21可诱导ERS激活细胞凋亡信号通路促肺纤维化。
本课题组前期研究发现:miR-21可在转录后水平特异性靶向甄别靶点基因如ADAMTS-1等因子,以不同的修饰方式抑制或加速降解靶点基因而发挥促纤维化的作用[5]。Sun等[2]研究表明:miR-21调控JNK/AP-1/STAT1/STAT3信号通路介导凋亡因子caspase-12的激活,也可调控内质网应激-自噬信号转导机制加重脏器的损伤,故调控miR-21的表达可减轻上述病理生理过程[15,16]。鉴于miR-21广泛参与生物学效应及调控肺脏的生理病理过程的事实。因此,我们推测miR-21可能参与了外源性H2S抑制ERS介导NIH3T3细胞凋亡的调控。
为此,我们对小鼠肺成纤维化细胞的miR-21基因的表达予以调控。研究表明:miR-21高表达的miR-21 agomir组GRP78、CHOP与caspase-12的表达均明显上调,提示上调miR-21增加ERS介导的内质网应激性细胞凋亡, 高表达miR-21降低H2S的保护性作用。而miR-21 antagomir组GRP78、CHOP与caspase-12的表达均明显下调,提示下调miR-21可减少ERS介导的细胞凋亡,低表达miR-21增加H2S的肺细胞保护作用。上述研究结果提示:miR-21参与了H2S保护损伤的肺成纤维化细胞。本研究从miR-21转录后调控这一新视角揭示H2S精准调控ERS凋亡相关基因的可能信号转导机制,这将为临床上的靶向药物研发提供新的证据。但H2S如何调控miR-21的表达,进而调节ERS凋亡的机制及信号通路尚须更进一步深入的研究。

