布鲁氏菌OMP31 T-B联合表位抗原的免疫应答分析①
江晓明 张峰波 朱玥洁 甫拉提·热西提 李智伟 庞 盼 丁剑冰
(新疆医科大学基础医学院免疫教研室,乌鲁木齐830011)
布鲁氏菌病(Brucellosis)是由布鲁氏菌感染引起的,《中华人民共和国传染病防治法》中规定报告的乙类传染病,是一种呈世界范围分布的人畜共患病[1],布病主要流行于我国的农牧区,新疆是主要的高发地区之一[2,3]。布病的早期症状多不典型,容易发生诊断不清,延误治疗,使病情拖延至慢性期引发多器官受累致残甚至致死[4-6],且目前缺乏有效的治疗方法[7]。为了减少疾病痛苦与社会损失,有必要开发安全有效的疫苗[8],尤其在布病流行趋式严峻的地区。
至今尚未有国际认可的人用布病疫苗,目前我国用于动物的疫苗是A19和S2两种减毒疫苗,但在广泛用于布病防控的同时也存在一些缺陷[9],主要是毒性较大,使一些接种对象出现不同程度的副反应或急性布病症状。生物信息学技术助力推进布病疫苗的研发,目前针对布病研发的基因工程疫苗如表位疫苗取得了一定进展,其中以外膜蛋白OMP31的研究较为突出。
本研究应用生物信息软件预测分析布鲁氏菌OMP31的T淋巴细胞和B淋巴细胞(T-B)的联合表位,利用优势表位人工合成OMP31肽段后免疫小鼠,分析OMP31 T-B联合表位诱导的免疫应答效果。
1 材料与方法
1.1材料 SPF级雌性BALB/c小鼠,6~8周龄,体重(20±2)g,由新疆医科大学第一附属医院临床研究院实验动物科学研究部提供,实验动物生产许可证编号A-20130216-155。
1.2方法
1.2.1表位预测与合成 采用SYFPEITHI (http://syfpeithi.de/) and ProPred Prediction Server (http://www.imtech.res.in/raghava/propred1/)预测T细胞表位,OMP31B细胞表位采用DNAstar(USA lynnon biosoft)and IEDB(http://tools.immuneepitope.org/bcell)预测。预测后T-B细胞表位肽段由上海生工生物工程公司合成。
1.2.2小鼠免疫 将24只小鼠随机分成两组,每组12只:A组(阴性对照PBS组),B组(实验组)。B组背部皮下多点注射10 μg/ml的肽段200 μl与等体积完全弗氏佐剂(F5881,Sigma,USA),2周后使用相同浓度肽段200 μl与等体积不完全弗氏佐剂(F5881,Sigma,USA)加强免疫,一共加强免疫3次,共8周。阴性对照组相同方法注射生理盐水200 μl/(只·次)。
1.2.3Th1免疫应答检测 末次免疫后2周,麻醉后颈椎脱臼法处死小鼠,无菌分离脾脏,调整脾细胞浓度至1×107ml-1,ELISPOT检测试剂盒(BD公司)计数小鼠脾细胞中分泌IFN-γ的淋巴细胞。具体方法如下:纯化的IFN-γ包被ELISPOT板,100 μl/孔,4℃静置过夜后弃掉包被液,用10%小牛血清的1640做封闭液清洗ELISPOT板一次,加入封闭液200 μl/孔,室温静置2 h,弃去封闭液,拍干后加入10 μg/ml的稀释肽50 μl/孔,终浓度为5 μg/L,同时加设50 μl/孔 刺激肽ConA的阳性对照。每孔加入脾细胞悬液50 μl,置于37℃含5%CO2孵育箱中24 h,弃去细胞液,无菌水冲洗2次,PBST冲洗3次。用稀释液稀释检测抗体250倍后,加入培养板,每孔100 μl,室温孵育2 h。弃去检测抗体溶液,PBST冲洗3次,将酶标结合物稀释100倍后100 μl/孔 加入培养板,室温孵育1 h,弃去液体,PBST冲洗4次,PBS冲洗2次。加入底物溶液100 μl/孔,室温显色5 min,流水终止显色反应,干燥后ELISPOT计数仪分析实验结果。
1.2.4体液免疫应答检测 末次免疫后2周,小鼠麻醉后内眦静脉取血,分离血清,采用ELISA法检测两组小鼠血清中的IgG1和IgG2a抗体水平。具体方法如下:取未偶联KLH多肽100 ng/孔包被ELISA检测板,4℃静置过夜,弃去包被多肽,PBST洗板5次后用10%小牛血清37℃封闭1 h后,弃去封闭液,PBST洗板5次。分别加入1∶100稀释的待检血清,37℃孵育1 h,弃去血清后PBST洗板5次,加入1∶5 000稀释的辣根过氧化物酶标记的山羊抗小鼠抗体,37℃孵育1 h,移去二抗,PBST洗板5次,加入显色液37℃5 min后,各孔加入2 mol/L H2SO4终止反应,以450 nm/630 nm双波长读取各孔OD值。实验组/对照组的OD值≥2∶1为阳性。
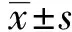
2 结果
2.1OMP31 T-B细胞联合优势抗原表位检测 通过IEDB软件在线分析OMP31蛋白抗原指数,筛选出了20个得分较高的区域,得分由高到低排列分别为:19~25、22~28、4~10、3~9、18~24、21~27、20~26、2~8、94~100、71~77、230~236、23~29、5~11、98~104、232~238、82~88、97~103、17~23、1~7、201~207(见图1)。
通过DNAStar综合分析筛选出了4个T-B细胞联合优势抗原表位,分别为:4~11、108~114、152~157、171~176区段(见表1)。这些区段有适当的抗原决定基特征,因此可能会有助于刺激细胞和体液免疫系统消除病原体,为构建多价布病疫苗的研究提供新的数据资料。
2.2重组OMP31 T-B表位可增强Th1免疫应答 ELISPOT计数脾细胞中分泌IFN-γ的淋巴细胞。如图2所示: PBS组SFU为(2.08±0.99)/106细胞,T-B联合表位组SFU为(90.08±19.05)/106细胞。ConA组SFU为(397.15±23.10)/106细胞。与PBS组相比,T-B联合表位组SFU明显增高,差异具有统计学意义(P<0.01,见图2、3)。
图1 OMP31蛋白抗原指数预测图Fig.1 OMP31 protein antigen index prediction chart
表1T-B联合表位
Tab.1CombinedT-Bepitope
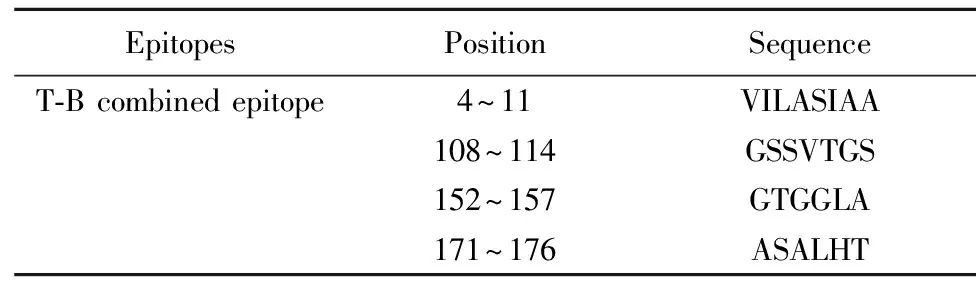
EpitopesPositionSequenceT-B combined epitope4~11VILASIAA108~114GSSVTGS152~157GTGGLA171~176ASALHT

图2 ELISPOT 检测结果Fig.2 Test results of ELISPOT
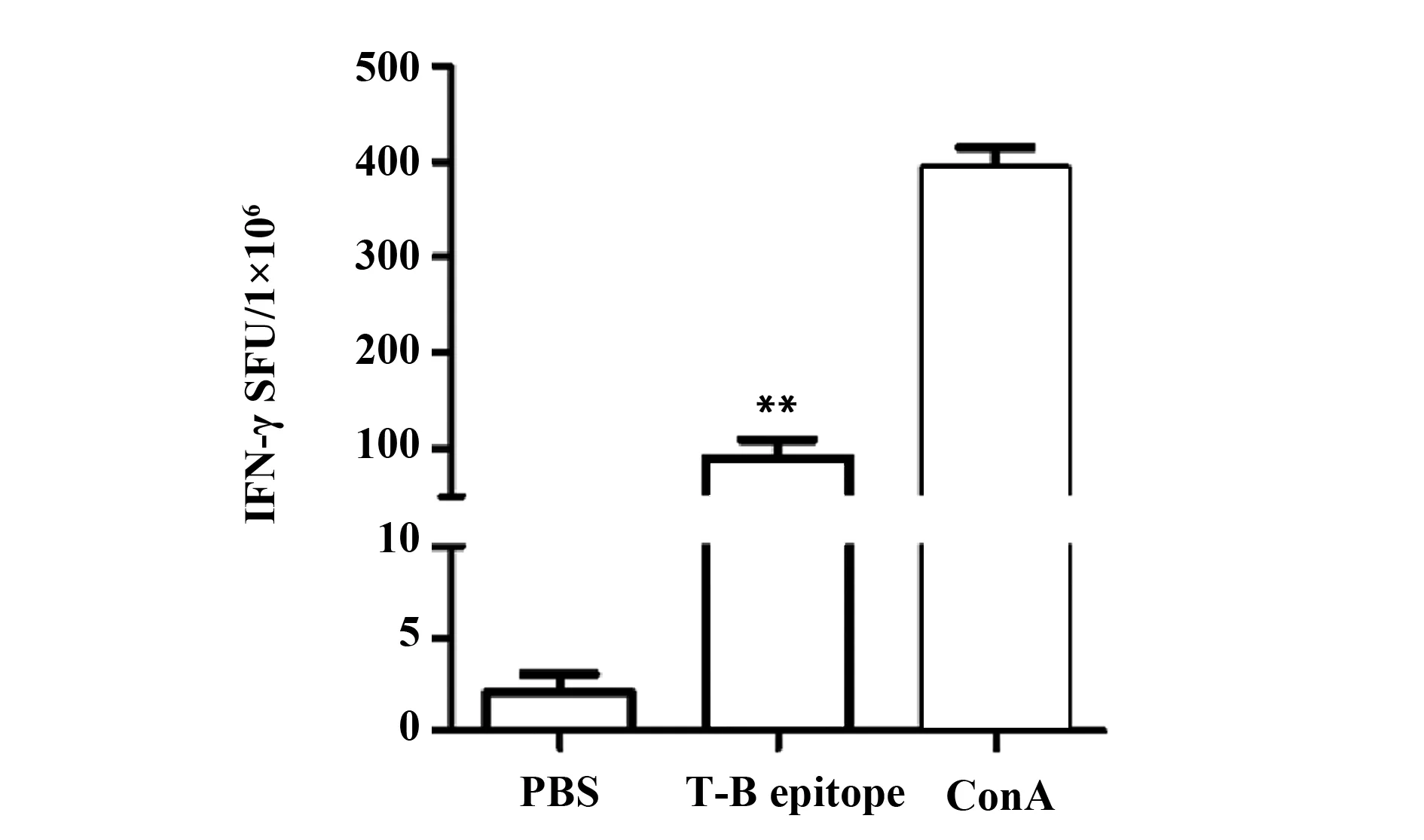
图3 不同分组IFN-γ阳性T淋巴细胞斑点数Fig.3 SFU of IFN-γ-positive T lymphocyte in each groupNote: **.P<0.01 vs PBS.SFU(Spot forming units).
2.3重组OMP31 T-B表位可刺激小鼠产生IgG抗体 小鼠免疫结束后2周,ELISA法在1∶100稀释血清中检测出一定水平的IgG1和IgG2a抗体。PBS组IgG1水平0.13±0.06,T-B联合表位组IgG1水平1.20±0.39,T-B联合表位组IgG1水平高于PBS组,差异具有统计学意义(P<0.01)。PBS组IgG2a水平0.10±0.07,T-B联合表位组IgG2a水平1.54±0.37,T-B联合表位组IgG2a水平高于PBS组,差异具有统计学意义(P<0.01,见图4)。
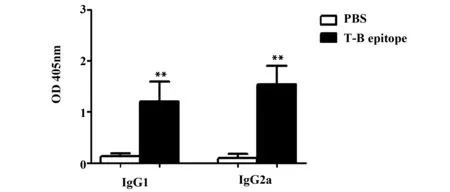
图4 不同分组小鼠血清IgG1和IgG2a抗体水平Fig.4 Level of IgG1 and IgG2a antibody in serum of mice in each groupNote: **.P<0.01 vs PBS.
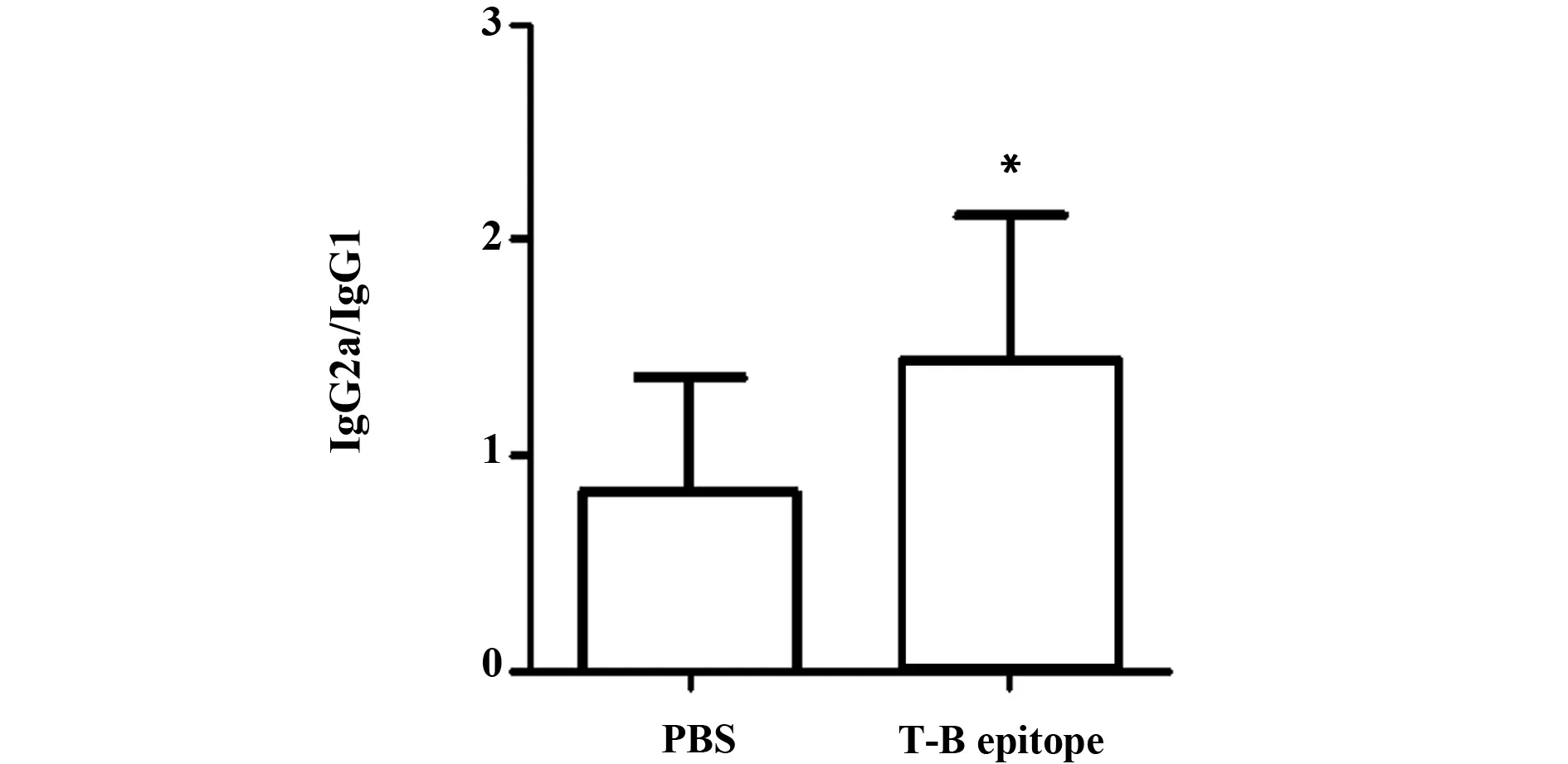
图5 不同分组小鼠血清IgG2a/IgG1水平比较Fig.5 Level of IgG2a/IgG1 in serum of mice in each groupNote: *.P<0.05,vs PBS.
为进一步了解Th1/Th2平衡的情况,本研究检测了IgG2a/IgG1水平,结果显示T-B联合表位组IgG2a/IgG1为1.45±0.67,PBS组IgG2a/IgG1为0.83±0.53。T-B联合表位组IgG2a/IgG1高于PBS组,差异具有统计学意义(P<0.05,见图5)。
3 讨论
布病在我国多个省市都有较高的患病率,特别是在畜牧业迅速发展的新疆[10]。鉴于布病发病范围广且病情较难控制,研制预防控制布病的高效疫苗显得尤为重要。目前针对布病研发的基因工程疫苗如表位疫苗、DNA疫苗、亚单位疫苗等均取得了一定进展,基因工程具有以下优势[11]:其一,免疫持久,能刺激机体产生保护性免疫;其二,借助分子生物学基因重组技术,对不同抗原进行操作,从而达到使该种疫苗理想化的目的;其三,成本低、易使用、易于运输和保存[12]。由于布鲁氏菌为胞内寄生菌,有效的T细胞免疫反应对布鲁氏菌的清除有最重要作用,因此DNA疫苗和亚单位疫苗的保护效果远不如活减毒疫苗[13],而表位疫苗则有望取代常规布病减毒疫苗用于布病的防控。研制表位疫苗面临的关键问题就是如何找到特异性抗原,抗原上免疫原性最强的区域即表位所在的位置[14]。
本研究显示:与PBS组相比,T-B联合表位组脾淋巴细胞中分泌IFN-γ的淋巴细胞、血清中IgG1、IgG2a抗体水平,均高于PBS组,差异具有统计学意义(P<0.01);且T-B联合表位组IgG2a/IgG1高于PBS组,差异具有统计学意义(P<0.05)。表明基于OMP31的4个T-B联合优势抗原表位设计合成的肽段可以诱导免疫小鼠产生较强的Th1免疫应答和一定水平的体液免疫应答。淋巴细胞增殖分化是机体免疫应答过程中的一个重要阶段,淋巴细胞增殖水平反映机体的细胞免疫状态,CD4+T细胞在机体控制细菌增长繁殖中起关键作用,庞盼等[15]研究发现布鲁氏菌病患者血清中IFN-γ表达降低,提示低水平的IFN-γ不利于布鲁氏菌的清除。且大量研究表明Th1免疫应答在机体控制布鲁氏菌感染的过程中在发挥重要作用[16,17]。体液免疫应答中抗原抗体相互作用同样在控制感染中发挥关键作用,抗体可通过调解机体特定的免疫应答来消除抗原。一个保护性强的表位疫苗应含有B细胞和T细胞联合优势抗原表位,T细胞和B细胞联合表位抗原可诱导宿主产生持久及高水平免疫应答,以便更有效地消除病原微生物[18]。
表位疫苗是控制预防布鲁氏菌感染的有效途径,表位的筛选与鉴定是表位疫苗的研究中最为关键的工作,而鉴定疫苗的标准之一就是表位的抗原性及刺激产生应答反应的强弱。本研究表明这4个T-B联合表位有良好的免疫原性,具有作为布鲁氏菌表位疫苗的潜质,为进一步研制布鲁氏菌疫苗提供了科学参考。

