肠道菌群影响肠道细胞免疫的研究进展①
栾英桥 杨佳幸 陶嫦立 邵红伟 张文峰
(广东药科大学生命科学与生物制药学院/广东省生物技术候选药物研究重点实验室,广州510006)
肠道微生物是肠道微环境的主要构成部分,是动物体内复杂且重要的微生态系统。正常宿主肠道内定植的微生物包含上千种,其中以拟杆菌门与厚壁菌门丰度最高,占肠道微生物总量的90%以上[1]。这些与宿主建立共生关系的微生物能影响多种生理功能,Chevalier等[2]研究发现,冷暴露能导致肠道微生物组成显著变化,将变化的菌群移植到无菌小鼠体内,可以增加宿主对胰岛素的敏感性。菌群通过促进宿主白色脂肪褐变使其具有耐寒能力,但也导致机体能量损失及脂肪损失增加。近年来的研究表明,肠道微生物的稳态对于调节宿主免疫的发育,维持机体正常免疫机能有不可或缺的作用。Lebalnc等[3]研究发现,灌胃母鼠含干酪乳杆菌的益生乳,可以改变母鼠及其后代的肠道菌组成,并且经益生乳灌胃的母鼠哺育的后代,其肠液中SIgA含量增加,肠道内巨噬细胞、树突状细胞与IgA+细胞比例增加。肠道微生物在宿主体内行使重要的功能,因此越发成为研究的热点。肠道是机体免疫防御的一道重要防线,肠道适应性免疫系统在病原体入侵后发挥重大作用。其主要组成部分是肠有关淋巴样组织,包括派伊尔结、肠系膜淋巴结等次级淋巴组织,及肠固有层和肠黏膜上皮内的淋巴细胞[4]。派伊尔结内的B细胞在T细胞刺激后分化成分泌SIgA的浆细胞,SIgA对保护肠道屏障完整性具有重要作用[5]。初始T淋巴细胞在抗原刺激后分化成不同的亚群,这些细胞在特异性细胞因子的调控下,行使不同的免疫功能。如TH细胞在IL-23、IL-1β、TGF-β的诱导下分化成TH17细胞,后者与肠道内某些炎症反应密切相关。肠道淋巴细胞的稳态对平衡炎症反应与免疫耐受至关重要。本文将从肠道微生物对肠道B淋巴细胞、T淋巴细胞免疫应答的影响展开讨论。
1 肠道菌群对肠道B淋巴细胞应答及IgA分泌的影响
黏膜免疫球蛋白A(Immunoglobulin A,IgA)作为一种B细胞在肠内分泌的功能蛋白,可跨越肠道上皮屏障,与肠道微生物、肠内抗原相结合,使其不能与宿主肠道直接接触。该过程避免了肠腔内容物对黏膜免疫系统潜在的有害刺激。Peterson等[6]研究发现,在IgA缺乏的模型中,肠内共生的多形拟杆菌异常表达的产物能参与炎症反应,并在宿主体内诱发促炎信号。IgA可以通过体细胞超变过程进一步亲和性成熟,高亲和性的IgA选择性地与肠道微生物的组成成分结合[7],该过程改变肠内菌群的组成并更好地促进宿主与肠道菌群的互惠共生关系。
1.1肠道菌群对T细胞依赖型B细胞的影响 在哺乳动物肠道内,根据抗体分泌过程的不同,B细胞可分为两种类型,一种是依赖T细胞模式分泌抗体的B2细胞,另一种是非依赖T细胞模式分泌抗体的B1细胞[8]。肠道免疫细胞通过能识别PAMPs的模式识别受体(PRRs)与入侵性肠道菌发生作用。细菌侵入到肠道内部黏液层并在上皮细胞附近定植,定植菌群可被上皮M细胞捕获,诱导高亲和性T细胞依赖模式的IgA应答。
以往研究发现,MyD88参与包括TLRs在内的多种细胞因子受体的功能发育过程。如图1所示,TLRs一般在巨噬细胞及树突细胞表面表达,Gribar等[9]发现肠道上皮细胞高丰度表达TLRs,TLRs参与上皮细胞与细菌表面TLRs配体的互作过程。Kubinak等[10]研究发现,内源性受体MyD88参与肠道内TFH细胞及IgA+B细胞发育的过程。Myd88分子通过影响TLRs功能,间接参与TFH细胞的分化。

图1 肠道B1细胞IgA分泌过程Fig.1 IgA secretion progress of B1 cell
TFH细胞释放CD40配体和白介素-21诱导B细胞活化,活化后的B细胞上调表达CCR6,并在CCL20的趋化作用下向肠内上皮穹顶转移[11]。同时,B细胞表达更高水平的AID+,后者参与促进IgA类别转换重组[12]。DCs作为肠内重要的抗原呈递细胞,受到上皮M细胞呈递的抗原刺激,并在ICL3s释放的LT-α及LT-β的诱导下,分化为CD11b+DCs并与受趋化的B细胞相互作用。CD11b+DCs在与B细胞的作用过程中,进一步促进TGF-β的产生。在TGF-β的作用下,B细胞迁移并进一步进入生发中心反应[11],分泌高亲和性的IgA以适应肠道微生物改变。Lindner等[13]研究发现,当菌群复杂性增加时,IgA谱也相应增加。这种适应性过程主要依赖于B细胞进入生发中心后的进一步成熟及肠道浆细胞池内B细胞的体细胞超变过程。肠道菌作为肠道内重要的抗原之一,维护肠道正常免疫耐受,刺激肠内B细胞成熟,参与肠道免疫蛋白免疫防御构建,对维持肠道稳态有重要作用。
1.2肠道菌群对非T细胞依赖型B细胞的影响 Bunker等[14]研究发现,在T细胞功能缺陷的小鼠模型中,同样存在针对肠道菌群的特异性IgA应答。这说明非T细胞依赖的IgA应答也与肠道菌群有密不可分的关系。在野生型或T细胞缺陷型鼠中都发现特异针对肠道菌的IgA应答。
非T细胞依赖的IgA重组转换主要发生在肠道固有层。如图2所示,固有层DCs受到抗原信号及来自ICL3s的协同刺激,释放B细胞活化因子(BAFF)及其同源物APRIL,促进B细胞AID+诱导[15]。然而,包括针对肠道菌IgA抗体应答在内的大部分IgA应答,都是通过体细胞突变过程获得高亲和性[16]。
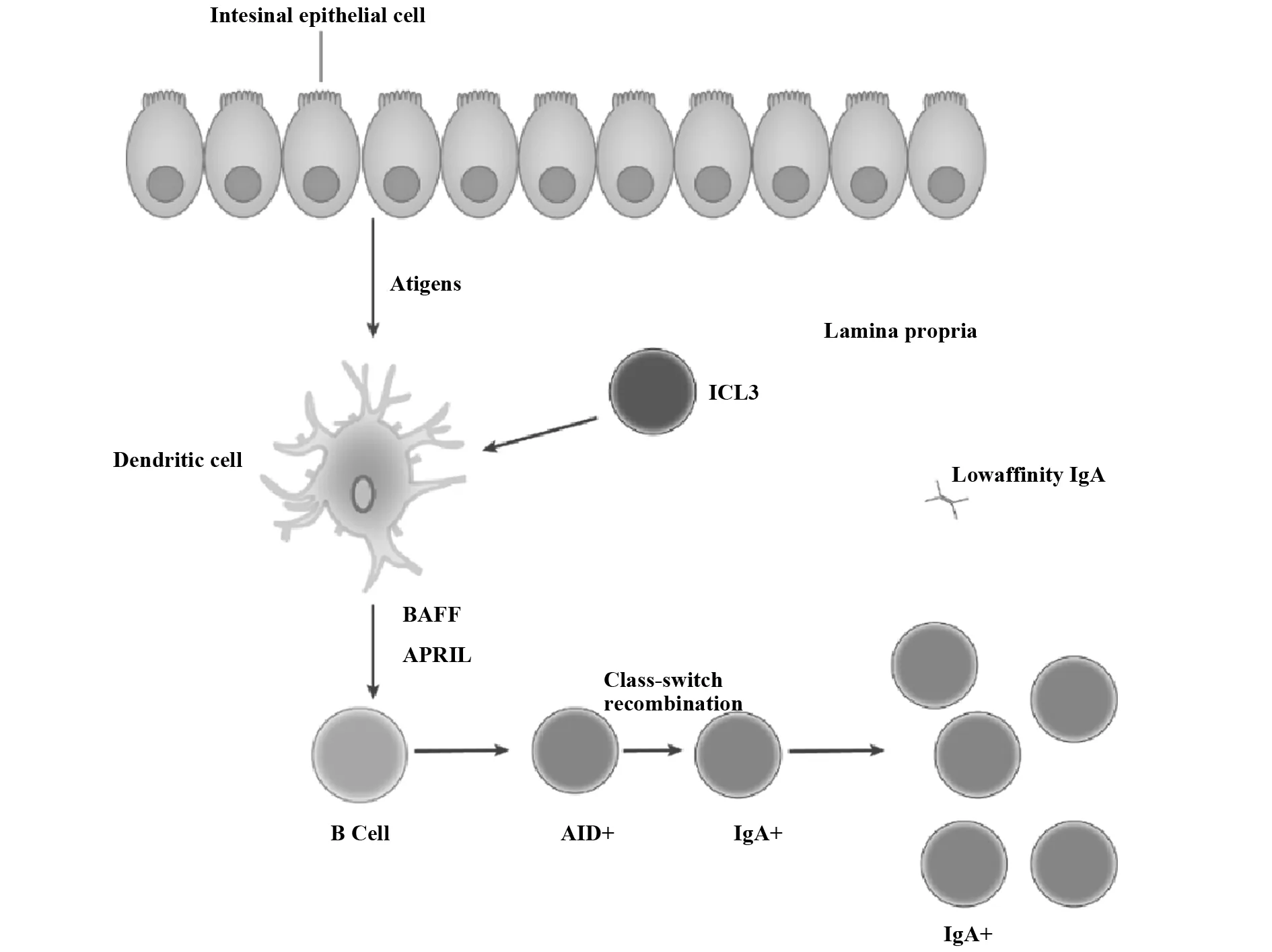
图2 肠道B2细胞IgA分泌过程Fig.2 IgA secretion progress of B2 cell
Wei等[17]研究发现,携带AID的突变形式AIDG23S的小鼠具有正常量的IgA,但V区突变大大减少,导致生发中心在小肠中增生及细菌异常扩张。非T细胞依赖的IgA应答能够产生低亲和性的IgA,但AID依赖性及TFH依赖性应答对共生特异性IgA的数量及亲和成熟做出重要贡献。
2 肠道菌对维持肠道TH17细胞与Treg细胞稳态的影响
T细胞表面受体受到先天免疫细胞释放的特定信号因子刺激后,T细胞产生分化并被趋化到不同部位行使各异的功能。树突状细胞衍生的维生素D及视黄酸能诱导CCR10和CCR9,其趋化因子参与引导T细胞募集到皮肤及小肠[18,19]。肠道T细胞存于回肠末端的淋巴组织中,与回肠末端丰富的肠道微生物形成相对稳定的微生态。肠道T细胞在不同的肠道菌及其他环境因子影响下,具有不同的促炎或抗炎的细胞表型。调节性T细胞作为一类具有抑制炎症细胞作用的功能细胞,与TH17细胞等促炎细胞大量共存于肠道固有层,两者的平衡对维持肠道稳态十分重要。
2.1肠道菌群对肠道TH17细胞的影响 RORγt+TH17细胞富集于肠道固有层中,占已分化CD4+T细胞数量的30%~40%[20]。TH17细胞的标志性细胞因子,如IL-17A、IL-17F、IL-22等,可以促进肠上皮细胞分泌抗菌肽并对肠上皮细胞的紧密连接有促进作用[21]。然而,TH17细胞受到IL-23及IL-1β刺激后,转变成一类具有致病作用的TH17细胞。致病性TH17细胞释放如IFN-γ、CSF-2等促炎因子,对自身免疫病及部分炎症均有恶化作用[22]。
肠道菌是影响TH17细胞分化的主要因素。以往研究发现,抗生素处理或无菌状态会减少小鼠肠道内TH17细胞数量[23]。近年的研究发现,分节丝状菌是肠道菌中诱导TH17细胞增殖分化的重要一环[24]。分节丝状菌紧密连接于回肠末端的上皮细胞,分节丝状菌与上皮细胞的接触作用对TH17细胞分化是必不可少的。分节丝状菌的定植诱导回肠末端上皮细胞内两种同工型的血清淀粉蛋白A的基因表达上调[25]。血清淀粉蛋白A在上皮细胞的表达依赖于ICL3分泌的IL-22的刺激,前者表达水平上调对IL-17A的诱导有促进作用。在前反馈过程中,CX3CR1阳性髓样细胞响应血清淀粉蛋白A,释放细胞因子激活ICL3,促进TH17细胞分化[24]。血清淀粉蛋白A也可以直接刺激T细胞,促进RORγt阳性细胞表达并上调IL-17A水平[25]。Derebe等[26]发现,血清淀粉蛋白A是一种呈递视黄醇和高密度脂蛋白的载体,可以通过呈递免疫调节分子的途径影响T细胞。
除肠道菌与肠道的接触作用影响TH17细胞外,Deng等[27]研究发现,一种致病性的细菌相关微粒能刺激上皮细胞释放高水平的CCL20及前列腺素E2,该类细胞因子对TH17细胞的募集和增殖有重要作用。Hall等[28]研究发现,肠道微生物DNA通过与Toll-like受体作用,参与TH17细胞增殖过程。TLR9缺陷型小鼠肠道内TH17细胞数量相比正常小鼠显著减少,在用肠道菌DNA处理后,肠道内TH17细胞数量增加。此外,肠道菌趋化下产生的胞外ATP也是肠内TH17细胞增殖的重要诱导因素。与SPF级小鼠相比,GF小鼠肠腔内ATP含量降低且固有层TH17细胞数量减少[29,30]。Smith等[31]研究发现,肠道菌释放的脂肪酸能调节RORγt活性,从而控制稳态TH17细胞与致病TH17细胞间的平衡。肠道菌作为影响肠道TH17细胞的重要调节枢纽,以多种途径参与对肠道TH17细胞及相关细胞因子的有效调节,维护肠道免疫稳态。
2.2肠道菌群对肠道Treg细胞的影响 肠道Treg细胞在维持肠道免疫耐受方面具有十分重要的作用。肠道固有层中的Treg细胞按来源可分为胸腺分化的Treg(tTreg)细胞和外周分化的Treg(pTreg)细胞[32],pTreg细胞富集于结肠,Ohnmacht等[33]发现IL-10是RORγt+pTreg细胞的主要标志物之一,Treg细胞释放的IL-10对抑制骨髓细胞、γδT细胞及TH17细胞的异常激活有不可或缺的作用[34,35]。Sefik等[32]发现,小鼠肠道Foxp3+T细胞的RORγt表达失活致使肠道TH17细胞异常增殖。研究发现,在无菌小鼠肠道内不存在pTreg细胞,因此肠道pTreg细胞的发育可能与肠内肠道菌有关。Mitsuoka等[36]将从普通小鼠粪便中分离得到的梭菌混合物灌胃给无菌小鼠,致使无菌小鼠结肠内Treg细胞显著增加。梭菌在肠内定植后,促进肠道Treg细胞释放IL-10和CTLA-4。同时,梭菌混合物的植入给Treg细胞提供了富集TGF-β的微环境,有利于诱导T细胞向Treg细胞分化。
研究发现,肠道菌可能通过产生短链脂肪酸的过程,参与诱导肠道Treg细胞。Furusawa等[37]研究发现,幼稚CD4+T细胞向pTreg分化的过程中HADCs处于抑制状态,组蛋白H3 非编码保守区的Foxp3位点脱乙酰化。Narushima等[38]分析诱导Treg增殖的梭菌基因组,预测到多个参与短链脂肪酸生物合成的基因。短链脂肪酸通过抑制组蛋白脱乙酰酶(HDACs)表达,抑制树突细胞中的促炎细胞因子的释放[39]。此外,体外实验发现,利用短链脂肪酸刺激Treg细胞后,可表达高水平的GPR15,并促使Treg细胞向结肠募集[40]。因此,以上研究表明肠道菌是诱导肠道内Treg细胞形成的重要因素,在不同环境因素下对免疫系统有不同的刺激,协调TH17细胞与Treg细胞数量,最大程度地避免肠道内免疫失衡。
近年来,肠道菌群越发成为肠道免疫方向的重要关注点。从肠道菌及其代谢产物的角度,人们利用不同的动物模型,开发改进的疫苗及涉及免疫系统疾病治疗的药物。但是,肠道菌与宿主的相互作用受宿主遗传因素、致病微生物与肠道菌的竞争关系及环境因素等多方面的影响。因此,人们需要开发除组学分析外的系统分析,提供进一步靶向有治疗目的微生物群及宿主细胞成分的方法。

