瓜氨酸化在多发性硬化中的机制探究①
张新燕 孙梦娇 原铂尧 孙静洁 王满侠
(兰州大学第二医院,兰州730000)
多发性硬化(Multiple sclerosis,MS)是一种世界性分布的中枢神经系统(Central nervous system,CNS)白质脱髓鞘疾病[1],是遗传易感性与环境因素(包括感染、吸烟、维生素D缺乏、肥胖等[2,3])共同作用导致的自身免疫性疾病,神经退行性变与炎性脱髓鞘是其主要的病理特征[4],在全球约累及250万人[5],异常的免疫攻击是MS研究和治疗的切入点,多种免疫细胞(淋巴细胞、巨噬细胞等)及细胞因子(抗体、补体等)参与针对轴突髓鞘发生的病理过程。新一代基因测序技术、生物信息学等发现的200余个易感基因中有近1/3位于主要组织相容性复合体(Major histocompatibility complex,MHC)编码的人白细胞抗原(Human leukocyte antigen,HLA)上,但遗传危险因子仅约占整个疾病危险因素的30%[6,7],流行病学调查发现几乎100%MS患者均有EB病毒(Epstein-Barr virus,EBV)感染史[8]。在EBV作用机制的研究中发现,EBV感染的B细胞对抗原分子有保护作用,这种保护作用可能是通过瓜氨酸化实现。
1 瓜氨酸化机制
1.1瓜氨酸化 瓜氨酸化(Citrullination)是一种可在正常代谢中观察到的转录后修饰(Post-translational modification,PTM),可见于细胞凋亡、终末期分化、细胞增殖等过程[9],但是异常的瓜氨酸化可以转变自身抗原表位而激发自身免疫异常导致自身免疫性疾病[10]。简单地讲,瓜氨酸化就是将蛋白质残基末端的精氨酸在肽酰基精氨酸脱亚胺酶(Peptidyl arginine deininase,PAD )作用下转化为瓜氨酸[9]。目前人体内共发现5种PAD(即PAD1、2、3、4、6),PAD的活性与高于正常水平的Ca2+浓度相关,细胞内Ca2+水平达10-5mol/L时[11,12],PAD中的半胱氨酸残基结合到精氨酸的胍基上,脱去一分子氨,形成四面内旋的过渡状态,后利用水分子的亲核性恢复半胱氨酸残基并形成一个酮基,从而使精氨酸转化为瓜氨酸[9],见图1。在这个过程中,氨基酸的电荷和氢基含量,甚至是蛋白质的一/二/三级结构都发生了改变,所以蛋白质的抗原性也发生了改变,使得自身免疫性T/B细胞对蛋白质的识别敏感度改变,免疫耐受遭到破坏,激发适应性免疫应答[10]。
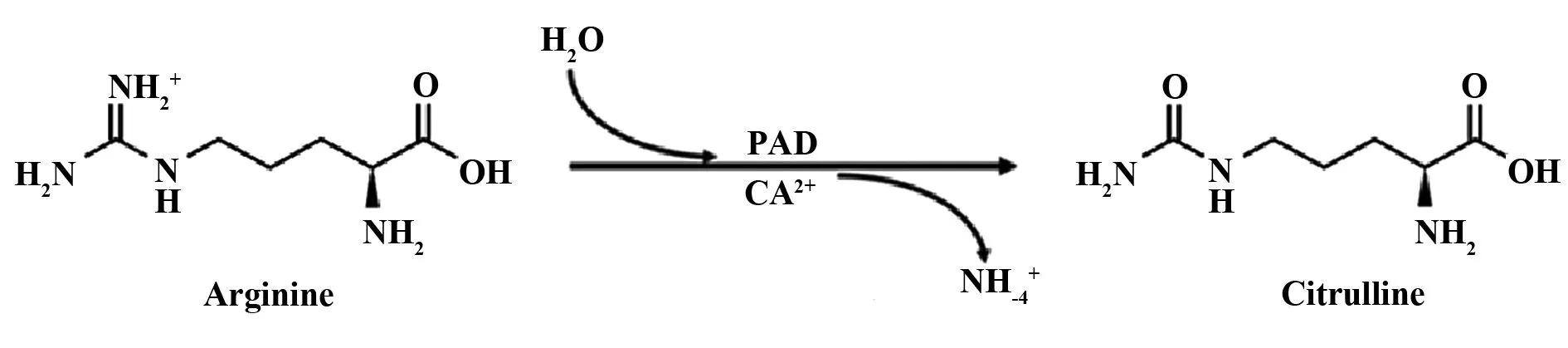
图1 瓜氨酸化作用Fig.1 Citrullination
关于瓜氨酸化抗原表位的研究多是关于风湿性关节炎(Rheumatoid arthritis,RA),但对这种改变后的抗原识别在其他自身免疫性疾病中导致免疫耐受破坏也有相关性,这其中就包括MS。
1.2瓜氨酸化与自噬 自噬(Autophagy)是一种进化上高度保守的细胞溶酶体降解途径,是细胞降解和回收利用细胞内生物大分子与细胞器的“自清”过程,普遍存在于真核细胞中[12]。自噬曾经被认为主要参与细胞凋亡,但新的发现提示自噬也有将细胞内多余或受损的细胞器、折叠蛋白和侵入的病原体运送至溶酶体进行消化降解的作用,参与细胞增殖/分化过程所需的细胞质重排,同时,自噬因为不同程度参与细胞抗原呈递过程及其相关细胞,如APC、T细胞增殖分化,也影响着机体的免疫应答[13]。自噬的类型主要包括微自噬(Mitophagy)、巨自噬(Macrophagy)和伴侣介导的自噬(Chaperone-mediated autophagy)[14],本文中的自噬主要指巨自噬。
自噬在细胞内通过自噬相关基因(Aytophagy-relative gene,Atg)协助诱导形成一种双凹的双层膜结构的自噬体(Autophagysome)[12],细胞质内的微管结合蛋白1A/1B-轻链3(Microtubule-associated protein 1A/1B light chain 3,Atg8/LC3)可通过与磷脂酰乙醇胺(Phosphatidylethanolamine,PE)结合而插入这些膜结构。在与溶酶体结合前,自噬体也会与一些内体融合,内体中含有待降解的蛋白、内吞作用后形成的受体-配体复合物等,形成的融合物被称作自噬内涵体(Amphisome)。钙离子是自噬体形成、成熟过程中重要的因素之一[15],可沉积在自噬体、自噬内涵体中,形成高Ca2+环境[16]。而正是这种高钙浓度可以在自噬体、自噬内涵体中活化PADs而促进其中的蛋白分子高瓜氨酸化[9]。自噬内涵体可以与溶酶体结合,借助溶酶体中的蛋白水解酶降解内容物。
2 瓜氨酸化作用参与MS发病机制
2.1瓜氨酸化与MS抗原代谢 MS的病理过程是建立在免疫细胞(淋巴细胞、巨噬细胞)、分子(抗体、补体因子)对髓鞘损伤的基础上[17],以小鼠/猿类制作的动物模型显示这些损伤主要由各类专职T细胞引起,而疾病的进展主要是免疫系统对一种髓鞘成分——髓鞘少突胶质细胞糖蛋白(Myelin/oligodendrocyte glycoprotein,MOG)的排斥作用引起的[18]。可用MOG作为抗原制作实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalo-myelitis ,EAE)动物模型,MOG24-36多肽片段通过激活CD4+Th1细胞引发CNS炎性改变。
B细胞可以在抗原滴度很低的情况下通过其受体捕获抗原,外源性蛋白质自身抗原的加工需要核内体和部分内溶酶体的蛋白酶参与,含有被捕获抗原的内体与含有蛋白水解酶的溶酶体融合,如组织蛋白酶G(Cathepsin,CatG)[19],将抗原降解成适宜长度的多肽,后被装配到MHC-Ⅱ类分子上,表达于CD4+T细胞表面并被提呈。这与自噬途径有许多交叉点。研究指出,EBV感染可以上调B细胞表面的APC相关标识物的表达并激发抗原交叉提呈[20]。‘Bert等在研究EBV感染后放大B细胞的抗原提呈功能时发现,EBV感染后的B细胞可以保护MOG抗原免于被代谢, 而后通过交叉抗原提呈至自身免疫性MHC-E限制性CD8+CD56+T细胞,实现这个过程的关键环节就是自噬。
抗原分子被EBV感染后的B细胞捕获后被内吞形成内体,MOG35-51中含有一个可以与自噬体表面锚定位受体LC3-II结合的序列——LC3-interacting region (LIR) motif ([W/F/Y]xx[L/I/V][21])相互重叠的片段F44xxV47(F-LIR),其酸性残基(E,D,S)与侧链芳香基F共同形成了与LC3上疏水口袋(Hydrophobis pocket,HP1)的结合力[22], 介导上述自噬参与进MOG代谢。MOG40-48多肽中的Arg41/Arg46为CatG降解的切割位点,自噬体中的高Ca2+环境活化PADs诱导其中的精氨酸(Arg41/Arg46)瓜氨酸化而不能被CatG有效降解[20],见图2,使得B细胞可以将这些自身抗原交叉递呈给 CD8+CD56+T 细胞,触发免疫异常。研究表明通过以绒猿为模型的实验得到了更进一步的结果:周围免疫系统中的B细胞也许可以通过破坏MOG40-48抗原表位而阻止自身免疫性T细胞被激活,而EBV感染可以使这种免疫耐受被打破,通过自噬体存活的抗原被呈递给HLA-E并激活自身免疫活性的CTLs[20],促进自身免疫发生。

图2 MOG35-55结构及CatG作用位点Fig.2 Structure of MOG35-55 and action sites of CatG
他们的研究进一步明确了是Arg46残基参与进F-LIR序列与自噬体所含的LC3-Ⅱ产生联系,当这种联系减弱时,瓜氨酸化的表位也会被降解,所以Arg46也许是瓜氨酸化最重要的作用位点。实验也证明,当用雷帕霉素增加自噬体形成时,MOG35-55的保护也增加,用3-MA抑制自噬,其降解增强[22]。由此可以形成一种新的假设:EB病毒感染可以通过自噬调节疾病相关的髓鞘自身抗原加工,即在自噬的背景基础上,MOG瓜氨酸化是MS病理过程中关键的抗原表位改变。这一特点与病毒感染是触发自身免疫异常的危险因素的推断也相符合。
2.2瓜氨酸化抗原识别与MS 异常的瓜氨酸化不仅可以改变抗原代谢,同时还能影响抗原提呈[9]。实验发现,易感HLA-DR与精氨酸和瓜氨酸残基结合时表现出了不同的锚定效力[23]。RA相关的危险易感HLA-DRB1* 0401/* 0404 蛋白上关键抗原结合槽(Gly-lys/arg-ala-ala,QQRAA/QKRAA/KKRA-A),称为 RA 共同表位(SE)对瓜氨酸表现出更高的亲和力[24],而非易感者没有或不明显,但是这种不同在HLA-DR蛋白有限的情况下不能复制,这提示了瓜氨酸化的作用也是有限的。故瓜氨酸化可以改变HLA-DR结合端结合位点与配体的亲和力,可以使瓜氨酸化抗原表位被优先提呈给CD4+T细胞,这很大程度是由于在与HLA-DR结合槽结合时瓜氨酸残基比精氨酸在相对大小和电荷方面更具灵活度和兼容性[25]。
从病因学角度出发,MS也是一种HLA相关的自身免疫性疾病,其与蛋白质瓜氨酸化也有关系。在炎性神经组织中,当髓鞘基础蛋白(Myelin basic protein,MBP)过度瓜氨酸化时,髓鞘变的缺乏抵抗力,增加了髓鞘的不稳定性,这种过度瓜氨酸化被认为是由于PDA2/4在PAD2启动子低甲基化后所致的酶过度表达所致的[26]。过去的研究显示瓜氨酸化蛋白在MS中有一定免疫作用;近期新的试验发现用瓜氨酸化MBP刺激MS患者可以大量产生一种新的T细胞系,这种T细胞系对瓜氨酸化MBP的敏感性高于未修饰的蛋白,类似的实验发现MS患者脑脊液和血清中存在识别瓜氨酸化MBP的抗体[27]。最有说服力的证据就是MS最易感的因子HLA-DRB1*15∶01和HLA-DRB5*01∶01在关键的HLA结合残基对瓜氨酸化抗原表位提呈也表现出优先性[9]。
3 总结与展望
MS的病理过程一直是疾病研究的重点和难点,多种假说、多个位点也反映出病理的复杂性。抗原瓜氨酸化是抗原瓜氨酸化机制在MS疾病过程中的参与尚未得到全面深入的研究,有很多细节还亟待补充,但是在其他自身免疫性疾病,如RA、SLE等疾病中已有成果。也许对此方向的深入研究可以为疾病治愈提供了新的思路和可能。

