灰枣优系抗寒性综合评价
郭佳欢,冯会丽,史彦江,俞元春*
(1.南京林业大学南方现代林业协同创新中心, 南京林业大学生物与环境学院, 江苏 南京 210037;2.新疆林业科学院经济林研究所, 新疆 乌鲁木齐 830000)
【研究意义】灰枣(Zizyphusjujubacv. ‘Huizao’)果实质地密合、含水量低、糖分高、风味佳,含有多种微量元素和较多的药用成分,具有很高的食疗价值和保健效果[1-3],是优质的鲜食兼制干枣品种。新疆灰枣自20世纪70年代初从河南新郑引种以来,当地得天独厚的光热资源使其各项经济性状均优于原产区,尤其在南疆各地得到大面积推广,栽植面积达47.37×104hm2以上[4],已成疆内枣树主栽品种[5]。然而,由于新疆特殊的地理位置及气候条件,夏季昼夜温差大,冬季长且寒冷,低温冻害在灰枣的实际生产中时有发生,现已成为制约当地枣产业发展的主要因素之一。植物抗寒性是衡量植物本身对低温冷害的承受能力的指标,是决定植物分布与区划的重要依据。【前人研究进展】目前,果树抗寒性研究主要从细胞形态结构、生理代谢、种质资源及基因工程等多方面进行研究[6-7]。其中,通过人工低温处理测定植物体的相对电导率、可溶性糖、可溶性蛋白、丙二醛含量及脯氨酸含量[8],并以此衡量植物的抗寒能力大小已成为目前常用的抗寒性评定方法[9]。【本研究切入点】目前,关于果树抗寒性的研究已有大量报道,国内外学者对于苹果(Maluspumila)[10]、梨(Pyrusspp.)[11]、樱桃(Cerasuspseudocerasus)[12]、葡萄(Vitisvinifera)[13]、核桃(Juglansregia)[14]等果树抗寒性都作过研究,但关于新选育的3个灰枣优系抗寒性研究还未见报道。本试验以普通灰枣和新疆林业科学院新选育的灰枣3个优系为试验材料,通过人工低温处理,对相对电导率、可溶性糖、可溶性蛋白、丙二醛含量及游离脯氨酸共5个抗寒性生理指标进行测定分析。【拟解决的关键问题】旨在探索灰枣优系在低温胁迫下的生理响应机制,试图探索灰枣及其优系的抗寒机理,为灰枣耐寒品种的选育推广提供参考依据。
1 材料与方法
1.1 供试材料
试验材料为灰枣和新疆林业科学院选育的3个灰枣优系,目前暂命名为‘灰实2’、‘灰实7’和‘灰实8’。于2017年1月20日在阿克苏实验林场二队红枣优树汇集圃选取长势一致的1年生休眠二次枝为试验材料,灰枣和3个优系各选取3株样树为重复,在东西南北4个方位各取5条枝,将同一品种/优系样品混合,带回实验室。蒸馏水清洗3次,用吸水纸吸干多余水分并在枝条两端封蜡后装袋,贴标签,分组放入可控低温冰箱内冷冻待测。
1.2 试验方法
将灰枣及3个优系的待测枝条剪成20 cm长的枝段,灰枣及每个优系的枝段分成6组,取其中1组用于试验对照。将剪好的枝段用去离子水漂洗3次,用吸水纸吸干水分并在末端封蜡后分别置于可控低温冰箱中进行冷冻处理,每次处理时随机选取灰枣和各优系枝条5段,设3次重复,其余装入自封袋中后放入0 ℃恒温冰箱中保存待用。处理时,温度梯度分别设为-15、-20、-25、-30、-35、-40 ℃,设-15 ℃为试验对照(CK)温度。低温处理时,在达到设定的冷冻温度时需维持12 h,处理后将温度上升至0 ℃,放置12 h后在室内进行各项抗寒指标的测定。其中,温度下降及上升的速度均为5 ℃/h。将灰枣和各优系不同温度处理的枝段切成2 mm厚的薄片,避开芽眼,同一品种/优系薄片混合后待测。
1.3 测定项目及方法
1.3.1 相对电导率 相对电导率(Relative electric conductivity, REC)采用电导率法[15]测定。称取2 g切片试样置于25 mL具塞试管中,加入去离子水至25 mL刻度线后盖紧,放于摇床震荡24 h,每个处理设5个重复。采用上海京科雷磁公司生产的DDSL-308型电导率测定仪测定浸出液的初始电导率(C1),将试管置于沸水中煮沸30 min,静置冷却后加去离子水定容至25 mL后测定其最终电导率(C2),计算相对电导率。相对电导率按公式(1)计算:
REC=(C1/C2)×100 %
(1)
以处理温度为横坐标,以相对电导率为纵坐标作图,结合Logistic方程(2)计算抗寒性[16]。
(2)
式中:Y为REC(%),t为处理温度( ℃),由于本试验的植物细胞伤害率抵消了基础干扰,因此设k=100,a,b为方程参数。通过对方程(2)线性化处理后得到方程式ln[(k-Y)/Y]=ln(a-bt),Y=ln[(k-Y)/Y]。以处理温度t为自变量,以相对电导率y为因变量,通过线性回归后得到REC(Y)和处理温度(t)的直线方程Y=at+b,并求得a,b值及相关系数R,运用SPSS 18.0结合公式(2)可求得拐点处的值,即植物组织半致死温度值LT50=-ln(a/b)。
通过对方程(2)求二阶、三阶导,并令其为0,则可得到枣树细胞在低温处理下开始受损时的起始温度T1=(lna/3.732)/b和枣树组织在低温处理下完全致死的温度T2=(lna/0.268)/b。
1.3.2 可溶性糖和可溶性蛋白 可溶性糖(Water soluble sugars, WSS)采用蒽酮比色法[17]测定。称取0.3g切片试样放入具塞试管,加入15 mL蒸馏水后放入水浴锅内煮沸20 min,取出冷却后过滤至100 mL的容量瓶中,往试管中继续加蒸馏水冲洗残渣数次过滤至容量瓶后定容至刻度线处。取1 mL提取液置于另一试管中,加入5 mL蒽酮试剂,摇匀,沸水浴10 min,冷却后测定吸光度,比色波长为620 nm,重复3次,取平均值。测定时以蒸馏水为空白对照。WSS的计算公式(3)为:
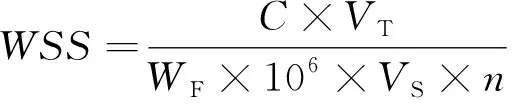
(3)
式中:C为根据标准曲线求得标准液可溶性糖含量(μg),VT为提取液的总体积(mL),WF为样品鲜重(g),VS为测定时的提取液取液量(mL),n为稀释倍数。
可溶性蛋白(Soluble protein, SP)采用考马斯亮蓝G-250染色法[17]测定。称取0.1 g切片试样放入研钵,加入5 mL蒸馏水后研磨30 min。洗液转移至离心管后置于4000 r/min的离心机中离心10 min。提取上清液,加蒸馏水定容至10 mL。取1 mL提取液加入小试管中,加入5 mL考马斯亮蓝G-250溶液,摇匀,静置5 min。待反应充分后测定吸光度,比色波长为595 nm,重复3次,取平均值。测定时以蒸馏水为空白对照。SP的计算公式(4)为:
(4)
式中:C为根据标准曲线求得标准液可溶性蛋白含量(μg),VT为提取液的总体积(mL),VS测定时的提取液取液量(mL),WF为样品鲜重(g)。
1.3.3 丙二醛和游离脯氨酸 丙二醛(Malondialdehyde, MDA)采用硫代巴比妥酸(TBA)显色法[18]测定。取0.1 g切片试样放入研钵,加入2 mL三氯乙酸(TCA)和少量石英砂研磨至匀浆,再加入3 mL TCA进一步研磨,将所得匀浆转移至离心管后置于4000 r/min的离心机中离心10 min,所得上清液即为提取液。取提取液测定吸光度,比色波长为532、600和450 nm,重复3次,取平均值。MDA含量的计算公式(5)为:
(5)
式中:MC为MDA含量(μmol/g),MN为MDA浓度(μmol/L),VT为提取液的总体积(mL),WF为样品鲜重(g)。其中,MN的计算方法为:MN=6.45×(OD532-OD600)-0.56×OD450,OD532、OD600和OD450为在波长532、600和450 nm下的吸光度。
游离脯氨酸(Free proline, FP)采用茚三酮显色法[19]测定。取0.3 g切片试样放入具塞试管中,往试管中加入3 %的磺基水杨酸溶液5 mL,水浴加热煮沸15 min,冷却后提取上清液2 mL,加入2 mL冰乙酸和2 mL茚三酮试剂,水浴煮沸30 min。冷却后加入4 mL甲苯,充分震荡后静置。取上层溶液测定吸光度,比色波长为520 nm,重复3次,取平均值。测定时以甲苯为空白对照。FP含量的计算公式(6)为:
(6)
式中:C为根据标准曲线求得标准液脯氨酸质量(μg),VT为提取液的总体积(mL),VS测定时的提取液取液量(mL),WF为样品鲜重(g)。
1.4 数据处理与作图
将所测数据按照公式(7)以相对指标为单位进行标准转换,求得各理化指标性状的抗寒系数(Cold resistance coefficient, CRC),并进行相关性分析。式中,VD为处理测定值,VC为对照测定值。
CRC=(VD/VC)×100 %
(7)
隶属函数法[20]综合各项指标进行抗寒性评价,以公式(8)计算与抗寒性呈正相关的指标(可溶性糖、可溶性蛋白、游离脯氨酸)的隶属度值;以公式(9)计算与抗寒性呈负相关的指标(丙二醛和相对电导率)的隶属度值。
Uin=(Xin-Ximin)/(Ximax-Ximin)
(8)
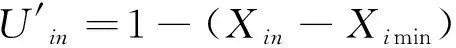
(9)
按照平均隶属度抗寒性分级法[21]将抗寒性分为5个级别,0.70~1.00为Ⅰ级,高抗(High resistance, HR);0.60~0.69为Ⅱ级,抗(Resistance, R);0.40~0.59为Ⅲ级,中抗(Middle resistance, MR);0.30~0.39为Ⅳ级,低抗(Lower resistance, LR);0~0.29为Ⅴ级,不抗。
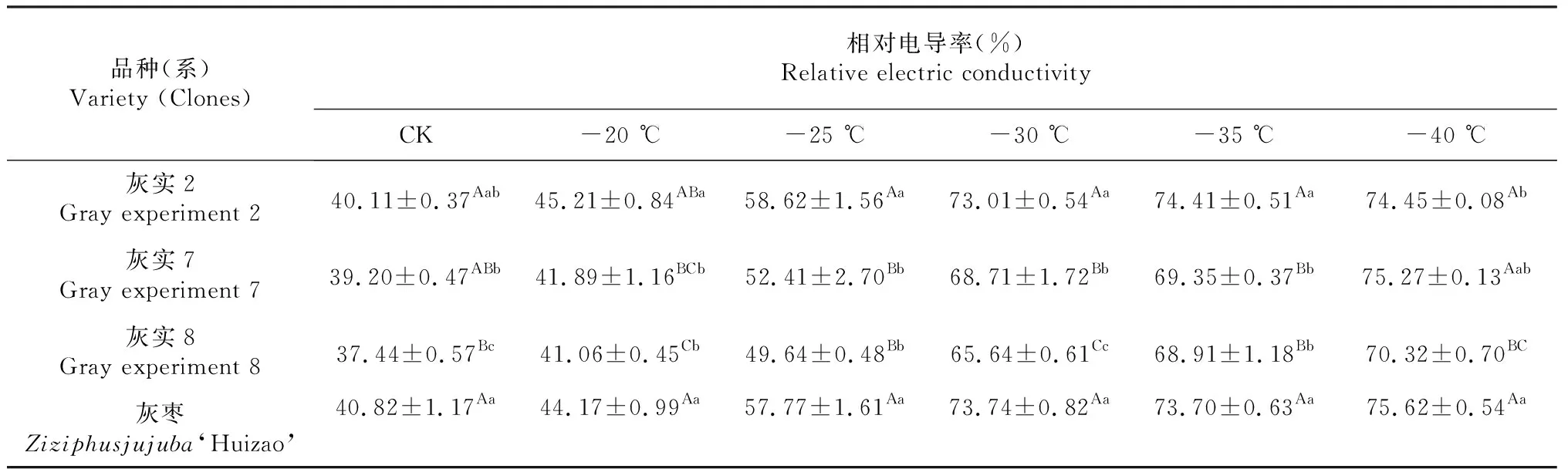
表1 灰枣不同优系在低温处理后REC多重比较
注:表中数值为平均值±标准差,同列不同大小写字母表示在0.01和0.05水平上差异显著,下同。
Note:Values are means±SD. Different capital and small letters in a column indicate significant difference at 0.01 or 0.05 levels. The same as below.
采用EXCEL2007、ORIGIN PRO9.0进行数据的统计,采用SPSS18.0进行方差分析。
2 结果与分析
2.1 不同低温处理对枣树枝条REC的影响
电导率法是指植物受到低温伤害时,细胞的膜透性增大,细胞内部电解质不同程度的渗出,导致电导率发生变化[22]。植物受冻越严重,外渗电解质物质越多,电导值越大,细胞膜受伤害程度越重,则植物抗寒性越差,反之,抗寒性越强[23]。由表1可以看出,灰实2、灰实7、灰实8以及灰枣的相对电导率均随着处理温度的降低而升高,在相同温度下的相对电导率差异明显。当处理温度为初始值CK时,灰实8的相对电导率最低,为37.44 %,极显著(P<0.01)低于灰实2和灰枣,显著(P<0.05)低于灰实7。当处理温度为-20 ℃时,与对照温度相比,灰实2、灰实7、灰实8以及灰枣的相对电导率上升幅度较小,分别为12.72 %、6.86 %、9.67 %和8.21 %,说明此时温度下降对灰枣及其优系的影响相对较小。当处理温度降至-25 ℃时,灰实2、灰实7、灰实8以及灰枣的相对电导率大幅上升,其上升幅度分别为46.15 %、33.01 %、32.59 %、41.52 %,除灰实8外,其余品种/优系的相对电导率均超过了50 %,说明在此温度下,细胞内部电解质大量外渗,灰枣及其优系受冻明显。当处理温度降至-30 ℃及以下时,不同品种(系)枣树相对电导率均已超过65 %,且变化幅度较小,说明-30 ℃及以下时灰枣及其优系会遭到严重冻害。
从表2可以看出,灰枣不同优系在低温处理后的抗寒性有所差异。灰实2、灰实7、灰实8和灰枣的组织细胞初始冻伤温度分别为-3.08、-2.36、-2.49和-2.89 ℃,低温半致死温度分别为-11.48、-8.82、-9.30和-10.80 ℃,以及组织细胞接近全透时的低温完全致死温度分别为-42.85、-32.89、-34.69和-40.31 ℃。以半致死温度的高低作为衡量枣树抗寒性能大小的标准,其排序为灰实2>灰枣>灰实8>灰实7。
2.2 不同低温处理对枣树枝条WSS和SP含量的影响
可溶性糖对于植物抗寒的生理机制主要表现在调节细胞渗透液浓度,降低水势,提升细胞保水效果,从而降低冰点,同时可溶性糖对植物细胞原生质体,线粒体等细胞器及膜上敏感偶联因子起到保护作用。由表3可知,不同低温处理后,不同枣树枝条可溶性糖含量均呈现出先升后降的趋势,且可溶性糖含量达到峰值时的处理温度值基本相同,灰枣各优系及灰枣均在-30 ℃时的可溶性糖测定含量达到最大值。其中,灰实2与灰枣对照组差异不明显,灰实7与灰枣对照组呈显著差异(P<0.05),灰实8与对灰枣照组成极显著差异(P<0.01,表3)。
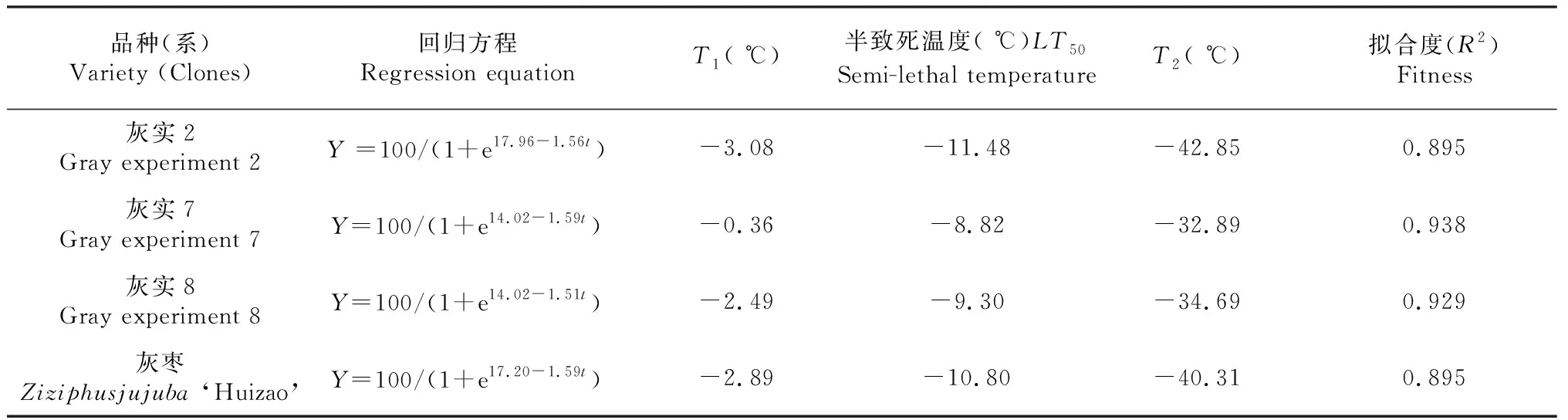
表2 灰枣不同优系在低温处理后的半致死温度
表3灰枣不同优系在低温处理后WSS多重比较
Table 3 Multiple comparison of water soluble sugars from different excellent strains ofZiziphusjujuba‘Huizao’ under low temperature ( %)
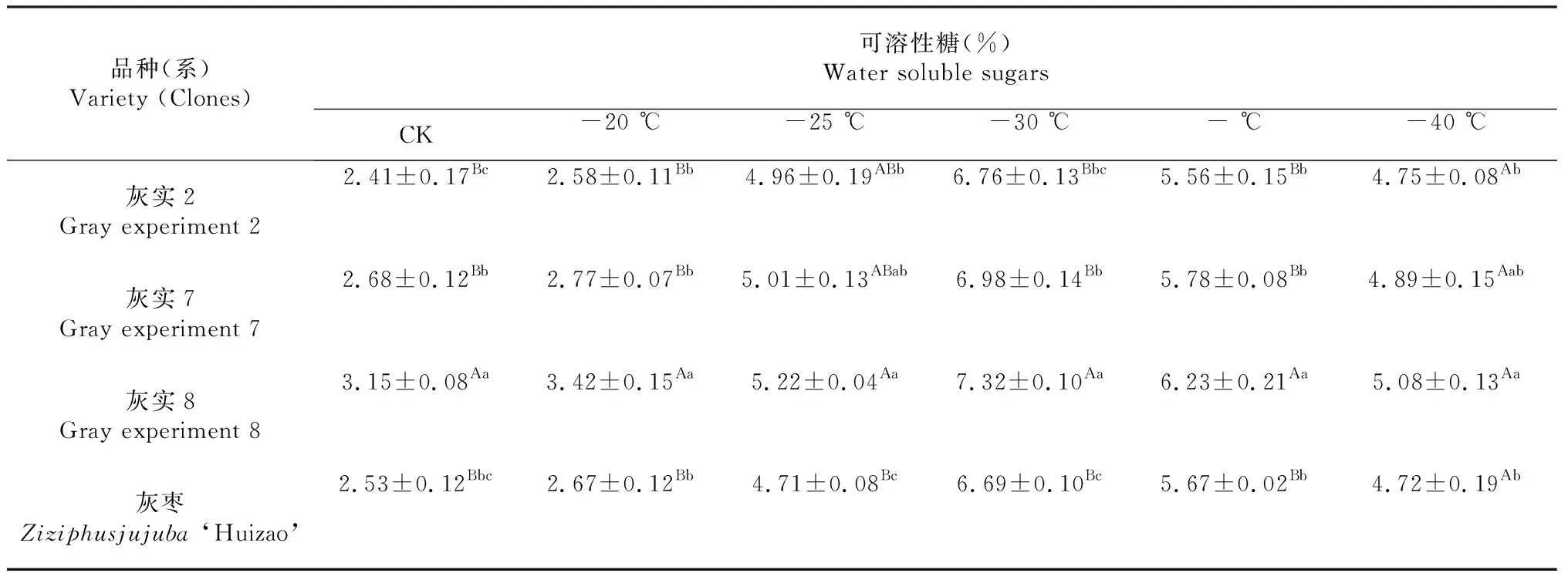
品种(系)Variety (Clones)可溶性糖(%) Water soluble sugars CK-20 ℃-25 ℃-30 ℃- ℃-40 ℃灰实2Gray experiment 22.41±0.17Bc2.58±0.11Bb4.96±0.19ABb6.76±0.13Bbc5.56±0.15Bb4.75±0.08Ab灰实7Gray experiment 72.68±0.12Bb2.77±0.07Bb5.01±0.13ABab6.98±0.14Bb5.78±0.08Bb4.89±0.15Aab灰实8Gray experiment 83.15±0.08Aa3.42±0.15Aa5.22±0.04Aa7.32±0.10Aa6.23±0.21Aa5.08±0.13Aa灰枣Ziziphusjujuba ‘Huizao’2.53±0.12Bbc2.67±0.12Bb4.71±0.08Bc6.69±0.10Bc5.67±0.02Bb4.72±0.19Ab
由表4可知,低温条件下,可溶性蛋白含量在灰实2、灰实7、灰实8及灰枣上呈现“低-高-低”的变化趋势,且均在-25 ℃附近时测定含量达到最大值。当处理温度为初始值CK时,灰实8的可溶性蛋白含量极显著高于灰实2、灰实7和灰枣(P<0.01),灰实2、灰实7和灰枣间并无明显差异;当处理温度达到-25 ℃时,灰实7和灰实8的可溶性蛋白测定含量与灰实2和灰枣呈极显著差异,灰实2的可溶性蛋白含量与对灰枣对照组基本一致。
2.3 不同低温处理对枣树枝条MDA和FP含量的影响
从表5可以看出,随着处理温度的降低,不同品种/优系枣树枝条测得的丙二醛含量呈现“低-高-低-高”波浪式变化趋势。灰实2和灰枣在-35 ℃时达到最高值,达11 μmol/g以上,且与灰实7、灰实8存在极显著差异(P<0.01);灰实7和灰实8在-40 ℃时达到最高值,为10.42~10.71 μmol/g左右,灰实8与灰实2呈显著差异(P<0.05)。
正常条件下,植物细胞内游离脯氨酸含量很低,但遇到逆境胁迫时,游离脯氨酸变化积累,并且积累值指数与植物的抗逆性有关。由表6可以看出,低温处理过程中,灰实7和灰实8的游离脯氨酸含量变化幅度较大,波动范围达到3.89~3.93 mg/g;灰实2和灰枣的变化较小,波动范围为3.22~3.31 mg/g。当处理温度为初始对照温度CK时,灰实2和灰实8的与灰枣呈显著差异(P<0.05),灰实7与灰枣呈极显著差异(P<0.01)。当处理温度降至-25 ℃时,灰枣及其优系的游离脯氨酸含量均达到最大值,其中灰实7与灰枣呈显著差异(P<0.05),灰实8与灰枣呈极显著差异(P<0.01),灰实2与灰枣的差异不显著。当处理温度为-30 ℃时开始明显下降,至-35 ℃时有所上升,之后开始下降,整体来看,低温处理下灰枣及其优系的游离脯氨酸含量变化表现为先上升后下降的变化趋势。
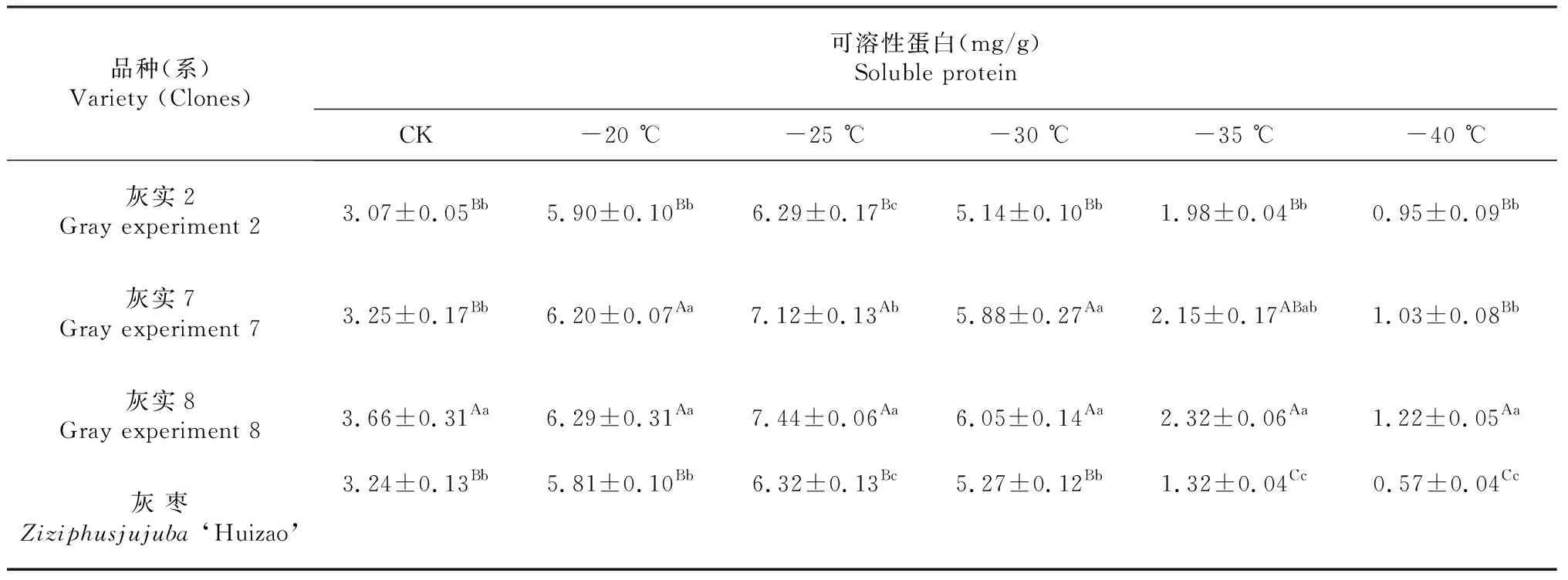
表4 灰枣不同优系在低温处理后SP多重比较
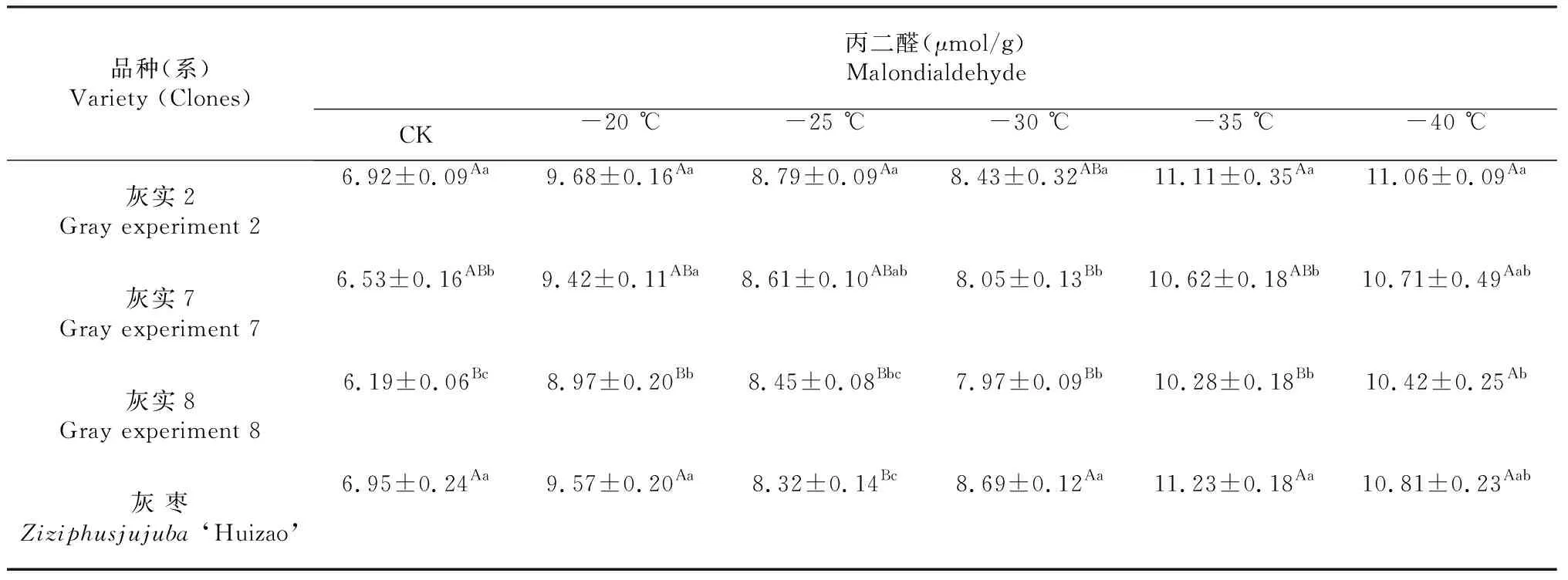
表5 灰枣不同优系在低温处理后MDA多重比较
2.4 抗寒指标间的相关性分析
从表7可以看出,不同抗寒性指标间具有一定的相关性。其中,可溶性糖与相对电导率(r=0.625)呈极显著正相关;可溶性蛋白与丙二醛(r=-0.524)、相对电导率(r=-0.540)呈极显著负相关。丙二醛与游离脯氨酸(r=0.522)、相对电导率(r=0.699)呈极显著正相关;游离脯氨酸与相对电导率(r=0.280)呈显著正相关;其余各抗寒性指标间虽有相关关系,但相关系数较低,相关性不显著。
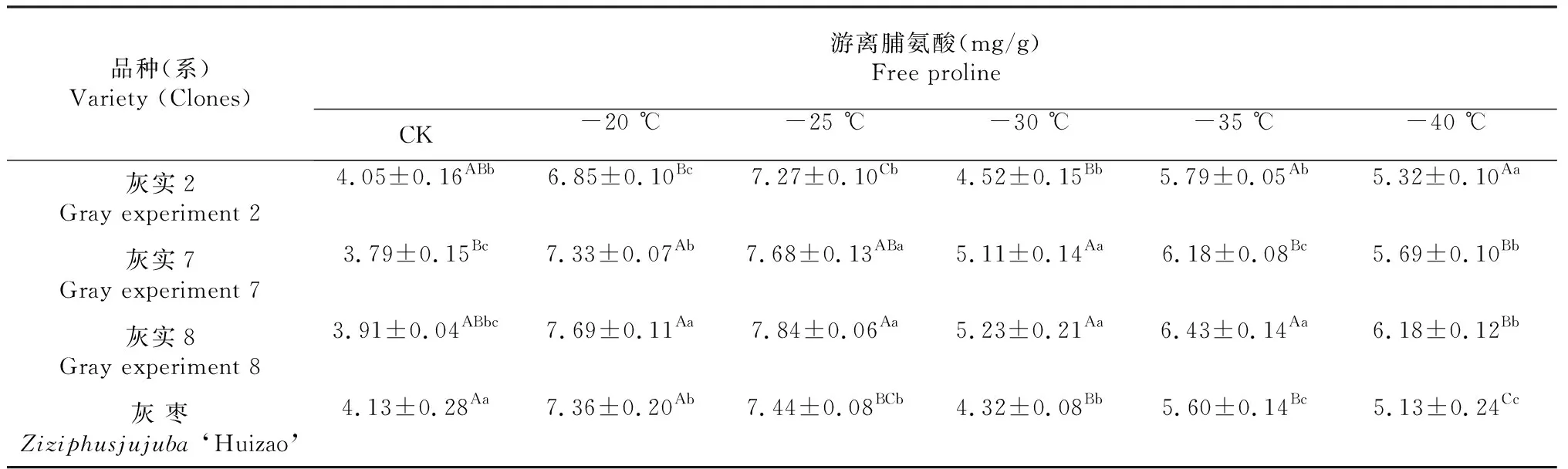
表6 灰枣不同优系在低温处理后FP多重比较
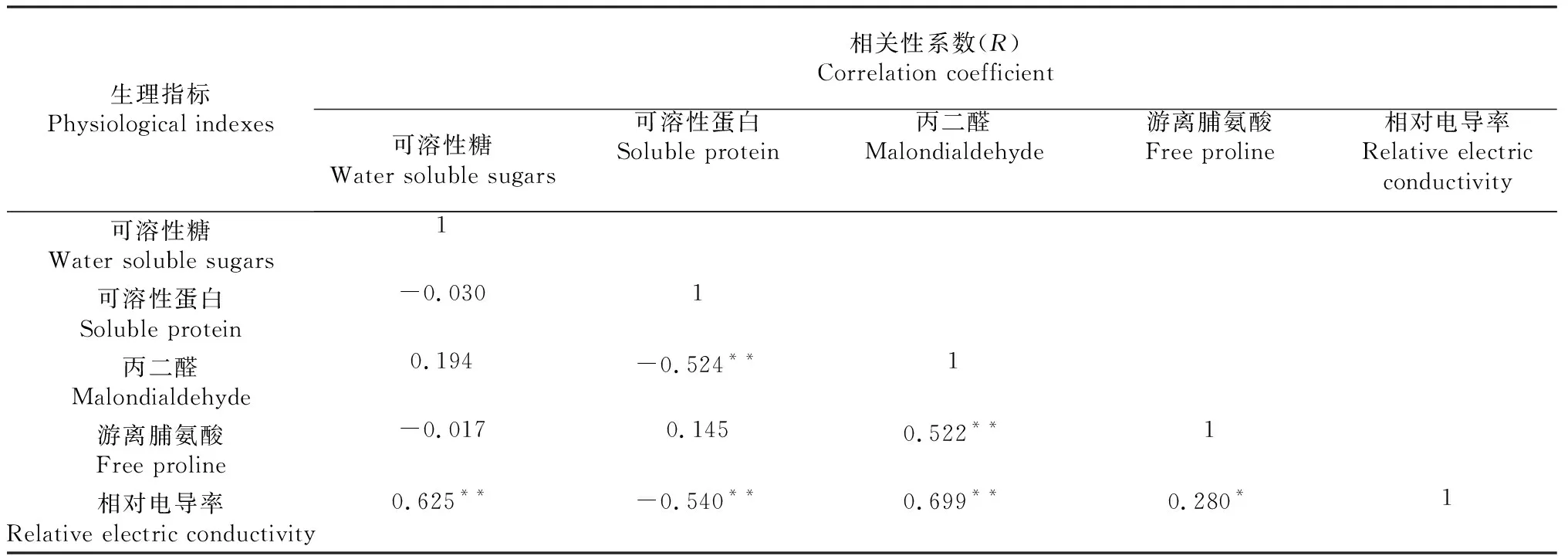
表7 各抗寒性指标间的相关性分析
注:*表示5 %显著水平;**表示1 %极显著水平,下同。
Note: * Correlation is significant at the 5 % level; **Correlation is significant at the 1 % level. The same as below.
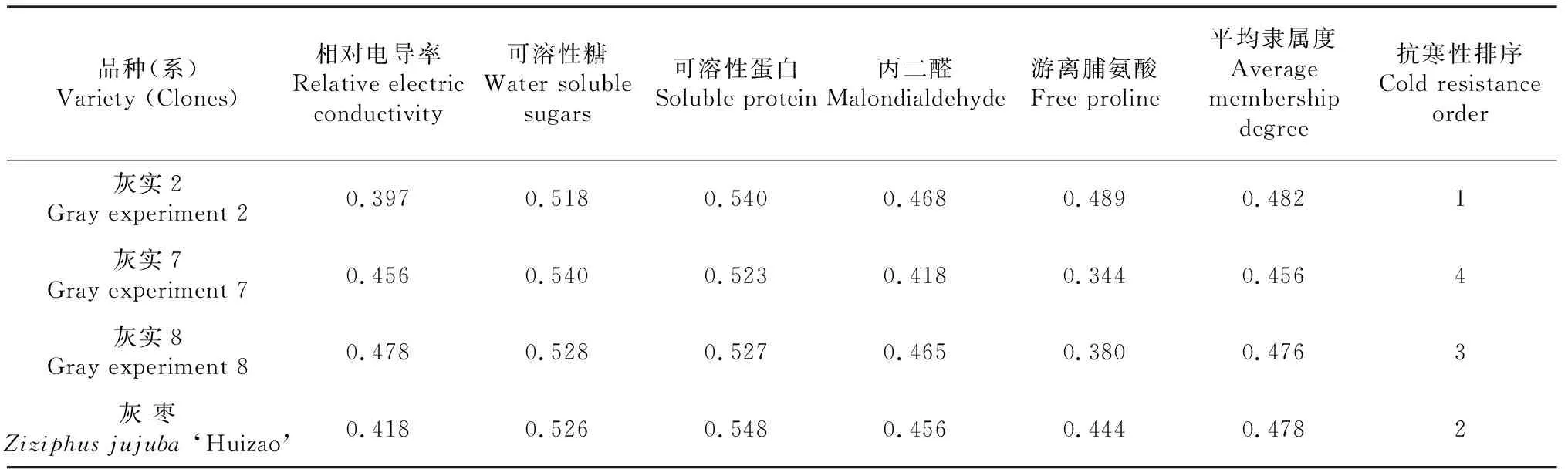
表8 灰枣不同优系的抗寒性综合评判
2.5 抗寒性综合评价
植物的抗寒生理机制是由多种因素综合作用的结果,只有结合多个抗寒指标才能真正反映植物的抗寒能力。为了更准确的评价灰枣优系的抗寒性,本研究采用隶属函数法,综合REC、WSS、SP、MDA、FP等多种抗寒因子,用平均隶属度对灰实2、灰实7、灰实8及灰枣的抗寒能力进行综合评价。平均隶属度值越高,说明其抗寒能力越强,反之抗寒能力越弱。研究结果显示,灰枣及其优系的抗寒因子综合隶属度在0.456~0.482之间,灰实2的平均隶属度最高(0.482),灰实7最低(0.456)。综合结果表明,灰枣及其优系的抗寒性综合排序为:灰实2>灰枣>灰实8>灰实7(表8)。
3 讨 论
3.1 相对电导率与抗寒性的关系分析
低温处理过程中,温度越低,灰枣及其优系的枝条组织的电解质外渗量越大,相对电导率增幅越明显。研究显示,人为低温处理后,灰枣及其优系枝条组织的电解质外渗率随温度下降而表现出急剧上升的变化趋势。Jan[24]认为,低温伤害使植物细胞的膜脂流动性及细胞的膜透性增加,细胞液外渗导致待测溶液电解质增加,最终导致电导率增大。本试验结果与Jan对于低温胁迫伤害对植物生理机制的影响研究相同。单以灰枣及其优系组织细胞接近全透时的低温完全致死温度作为衡量枣树抗寒性能大小的标准,灰实2的抗寒性能明显优于灰枣、灰实8、灰实7。
3.2 各抗寒性生理指标间的关系分析
可溶性糖是调节细胞质体内部渗透势、降低水势的主要因子之一,通常条件下,植物体内可溶性糖的含量增加表明植物抗寒性的增强。研究结果显示,低温处理过程中,灰枣及其优系的可溶性糖含量呈现出先升后降的“n”型单峰曲线,且达到峰值时的处理温度均在-30 ℃之间。其中,灰实8在-30 ℃时的可溶性糖含量极显著高于灰实2、灰实7和灰枣。Sakai[25]认为植物组织细胞内可溶性糖的含量较高则代表该植物抗寒性较好,本研究对灰枣及其优系的抗寒性能综合评价结果显示这与Sakai的研究结论一致。
低温胁迫对植物细胞蛋白质的影响变化主要表现在可溶性蛋白和酶类的变化以及产生抗寒性蛋白。可溶性蛋白具有较强的亲水性,它能明显增强细胞的持水力,而植物细胞内可溶性蛋白含量的增加可以束缚更多的自由水,减少胞内自由水因低温结冰膨胀而对原生质体造成的伤害,从而提高植物的抗寒性。本研究结果显示,低温处理过程中,灰枣及其优系的可溶性蛋白含量变化规律明显,表现出一致的变化趋势,均在-25 ℃附近时测定含量达到最大值。这与玉苏甫等[26]对梨砧木抗寒性的研究结果相似。
在低温逆境下植物遭受伤害与活性氧积累诱发的膜脂过氧化作用密切相关。丙二醛是膜脂过氧化过程中活性氧簇(ROS, Reactive oxygen species与生物膜上的磷脂、酶和膜受体相关的多不饱和脂肪酸的侧链及核酸等大分子物质发生脂质过氧化反应形成过氧化最终产物。丙二醛对质膜有毒害作用,膜透性直接反映细胞的损伤程度[27]。因此,低温处理时,丙二醛含量变化通常作为衡量植物抗寒能力的一个重要生理指标。本研究结果显示,不同枣树优系枝条测得的丙二醛含量呈“低-高-低-高”波浪式变化,抗寒性强的灰枣优系丙二醛含量上升较早,下降也较早。其中,灰实2和灰枣在-35 ℃时最高值达到11 μmol/g以上,灰实7和灰实8在-40 ℃时最高值为10.42~10.71μmol/g。这说明,抗寒性较强的优系以通过减少丙二醛的滞留时间来减少因低温胁迫引起的丙二醛积累对植物细胞造成的伤害。
游离脯氨酸由于其极强的亲水性,能够调节渗透势,稳定原生质体及组织的代谢过程,因而能提高渗透压,降低冰点,增强植物抗寒性。本研究结果显示,灰实7和灰实8的游离脯氨酸含量波动范围较大,为3.89~3.93 mg/g;灰实2和灰枣的波动范围较小,为3.22~3.31 mg/g。当温度降至-25 ℃时,灰枣及其优系的游离脯氨酸含量均达到最大值,当处理温度为-30 ℃时开始明显下降,至-35 ℃时有所上升,之后开始下降。以游离脯氨酸的含量变化作为衡量植物抗寒性能力的标准,灰实2和灰枣的抗寒性较好,灰实7和灰实8的抗寒性较差。
低温胁迫可对植物细胞内相对电导率、可溶性糖、可溶性蛋白、丙二醛含量及脯氨酸含量等多项生理指标产生影响,而这些生理指标正好也反映了植物的抗寒性能。综合研究说明,不同抗寒性指标间具有一定的相关性。可溶性糖与丙二醛、相对电导率呈正相关,可溶性糖与相对电导率呈极显著(P<0.01)正相关(r=0.625),与可溶性蛋白、游离脯氨酸呈负相关。可溶性蛋白与游离脯氨酸呈正相关,与丙二醛(r=-0.524)、相对电导率(r=-0.540)呈极显著(P<0.01)负相关。丙二醛与游离脯氨酸(r=0.522)、相对电导率(r=0.699)呈极显著(P<0.01)正相关。游离脯氨酸与相对电导率呈显著(P<0.05)正相关。其余各抗寒性指标间虽有相关关系,但相关系数较低,相关性不显著。灰实2、灰实7、灰实8和灰枣的综合隶属度在0.40~0.59之间,分别为0.482、0.478、0.456和0.476。
4 结 论
按照平均隶属度抗寒性分级法对灰枣及其优系抗寒性分级:灰实2、灰实7、灰实8和灰枣的抗寒性均为Ⅲ级,抗寒能力为中抗,其抗寒性能力大小综合排序为:灰实2>灰枣>灰实8>灰实7,其中推荐灰实2作为抗寒性优良品种。

