来源于Alicyclobacillus sp.A4葡萄糖异构酶的克隆表达及转化应用研究
戴晨霞 曹慧方 罗会颖 姚斌 柏映国 徐波
(1. 江西农业大学生物科学与工程学院,南昌 330045;2. 中国农业科学院饲料研究所,北京 100081)
高果糖浆(High fructose corn syrup,HFCS)又称果葡糖浆,是一种主要成分为葡萄糖和果糖的液体甜味剂[1],由玉米淀粉通过α-淀粉酶、糖化酶和葡萄糖异构酶的作用而生成的。高果糖浆相对于蔗糖具有甜度高、风味佳、溶解度高、价格低等优势[2],因此成为目前主要的甜味剂,广泛应用于食品、医药等行业。近年来,国内外高果糖浆的需求量不断增加,日本年消耗食糖总量为250万t左右,而淀粉糖占其中的50% 以上;美国人均食糖消费69 kg/a,淀粉糖占38 kg/a 以上。我国由于大量外资食品企业的进入、食品工业的快速发展以及医药市场的大量开发,也极大地扩大了对高果糖浆产品的需求。
根据果糖含量,目前市场上常见的高果糖浆分为三种类型:HFCS-42(含 42% 的果糖)、HFCS-55(含55% 果糖)和 HFCS-90(含 90% 果糖)[3]。这三种浓度的高果糖浆被应用于不同的食品当中,HFCS-42主要用于烘培食品、灌装水果、调味品、奶制品等行业,而HFCS-55多适用于一般的甜味饮料、碳酸饮料、雪糕、冰淇淋、冷冻甜点等,HFCS-90最主要还是用于制得HFCS-55[4]。
葡萄糖异构酶在体外可以将D-葡萄糖异构化D-果糖,是商业制备高果糖浆的关键酶制剂。由于商业葡萄糖异构酶效率低、不耐高温等原因,目前工业生产的高果糖浆主要是HFCS-42[4-5]。HFCS-42果糖含量低,医疗和保健价值并不能得到充分发挥,且在低温贮运时易结晶析出,所以HFCS-42也逐渐满足不了市场的需求。相比较,HFCS-55果糖含量高,甜度和功能更好,且在低温时不易结晶,更具有商业应用前景。但HFCS-55必须经过HFCS-42的色谱分离浓缩成HFCS-90,再将这两者混合制得,生产技术成本高[6]。正因此,国内外还没有直接生产HFCS-55的厂家。
提高转化率以及转化过程中的底物浓度(葡萄糖)是降低生产成本的有效途径。已有研究表明,葡萄糖异构酶对D-葡萄糖的转化率与温度有相关性[7],因此挖掘到一个耐热的葡萄糖异构酶,是获得高葡萄糖浓度下高果糖转化率的关键,对工业生产55% 高果糖浆具有重大意义。
为挖掘一个在工业上制备高果糖浆具有应用价值的酶。本研究从高温菌株Alicyclobacillussp.A4中克隆获得一个新的葡萄糖异构酶基因A4GI,在大肠杆菌中进行表达,对已纯化的蛋白酶学性质进行表征,最后对其转化率进行研究,发现其在一个高的葡萄糖浓度下能达到较高的果糖转化率,因此具有巨大的工业应用潜力。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 脂环酸芽孢杆菌Alicyclobacillussp.A4[8]分离自云南保山地区温泉水中,菌株及基因组保存于中国农业科学院饲料研究所,并已进行全基因组测序。E.coliTrans1 克隆宿主、E.coliBL21表达宿主及克隆载体pEASY-T3都来自北京全式金生物技术有限公司。pET30a表达载体保存于中国农业科学院饲料研究所。
1.1.2 试剂FastPfuDNA聚合酶(北京全式金生物)、LA Taq酶(TaKaRa公司)、质粒小提试剂盒(北京天根生物公司)、DNA琼脂糖凝胶回收试剂盒、细菌DNA提取试剂盒(都来自OMEGA公司)、His-tag蛋白纯化磁珠(苏州海狸生物公司)、蛋白定量试剂盒(北京全式金生物公司)、核酸Marker、蛋白 Marker(均来自 Genstar)、D-葡萄糖(sigma公司)、果糖、半胱氨酸盐酸盐、咔唑(均来自国药集团有限公司)、其他化学试剂为进口或国产分析纯。
1.1.3 培养基 LB培养基:1% 蛋白胨,0.5% 酵母粉,1% NaCl,121℃灭菌20 min。加入1.5% 的琼脂粉即为固体LB培养基。
1.2 方法
1.2.1 A4GI的基因克隆与序列分析 以Alicyclobacillussp.A4基因组为模板,以A4GI-pET30a-F/R为前后引物(表 1),PCR扩增获得A4GI基因,将其连接到pEASY-T3克隆载体,热激转化至E.coliTrans1克隆宿主中,菌落PCR对转化子进行筛选,并测序。序列经NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)数据库Blastn、Blastx和Blastp进行比对与分析。再通过overlap的方法构建表达载体,将目的基因连接到含有6个组氨酸标签的pET30a载体上。主要经过3轮PCR:第一轮PCR,以A4GI-pEASY-T3质粒为模板,以A4GI-pET30a-F/R为引物,获得带有pET30a载体重叠区的A4GI目的基因片段;第二轮PCR,以pET30a质粒为模板,以pET30a-A4GI-F/R为引物(表 1),扩增获得带有A4GI重叠区的pET30a载体片段;第三轮PCR,前两轮PCR产物摩尔比为1∶1,互为模板互为引物,进行两片段的PCR扩增连接。第三轮PCR产物即为重组表达载体A4GI-pET30a,并转化至表达宿主E.coliBL21。

表1 基因克隆与载体构建所需的引物序列
1.2.2 表达与纯化 将重组阳性转化子培养至OD600值为0.6左右(约2-3 h);加入终浓度为0.6mmol/L的异丙基 -β-D-硫代半乳糖苷(IPTG),30℃,200 r/min诱导培养5-6 h;菌液12 000 r/min离心10 min去除上清,根据菌体湿重将其重悬于适量的咪唑溶液NTA0(20 mmol/L 的磷酸盐缓冲液,500 mmol/L 氯化钠,0 mmol/L咪唑,pH 7.4);利用冰浴超声波破碎菌体,12 000 r/min离心10 min,上清即为粗酶液。利用镍离子磁珠纯化蛋白:将A4GI粗酶液混入装有经蒸馏水洗净的磁珠的离心管中,将离心管于旋转仪上旋转2 h,使目的蛋白结合到磁珠上后;用3 mL 的浓度分别为40 mmol/L、60 mmol/L、80 mmol/L、100 mmol/L、200 mmol/L 和300 mmol/L的的咪唑溶液依次洗脱杂蛋白和目的蛋白(40-100 mmol/L 咪唑一般洗脱杂蛋白,200-300 mmol/L咪唑溶液一般洗脱目的蛋白);洗脱结果经SDS-PAGE电泳检测。分别将含有单一的目的蛋白洗脱液合并,并利用3 kD透析袋透析以除去咪唑。利用Bradford法测定蛋白浓度。
1.2.3 酶活测定 标准反应体系:1 mol/L D-葡萄糖 50 μL,适当稀释的酶液 50 μL,10 mmol/L Co2+50 μL,缓冲液(磷酸盐缓冲液 pH 7.5)850 μL,65℃反应1 h,冰水浴终止反应,上述反应液稀释20倍,吸取其中500 μL测定果糖的生成量。使用灭活的酶液作为对照。
果糖的测定:向反应稀释液(500 μL)依次加入H2SO4溶液(450 mL H2SO4徐徐加入190 mL水中)3 mL,1.5%半胱氨酸盐酸盐溶液100 μL,0.12% 咔唑酒精溶液100 μL,混匀,60℃显色10 min,冰水浴终止反应,于560 nm处测定吸光值。根据果糖标准曲线求得果糖的含量。
酶活定义:在酶活测定标准条件下,每分钟产生1 μmol D-果糖所需要的葡萄糖异构酶的酶量被定义为一个酶活单位,用U表示。
1.2.4 重组A4GI的酶学性质
1.2.4.1 最适温度、最适pH与稳定性 最适温度测定:在磷酸缓冲液中(pH 7.5),测定A4GI在不同温度下的酶活。在标准反应体系下,A4GI分别在50-80℃下反应1 h,冰水浴冷却,测定果糖生成量,计算酶活,确定最适反应温度。
最适pH测定:在之前测定的最适温度下,测定A4GI在不同的pH缓冲液中的酶活。在标准反应体系下,A4GI在pH 5.0-9.0的缓冲液中反应1 h,冰水浴终止反应,测定果糖生成量,计算酶活,确定最适反应pH。
温度稳定性测定:A4GI(含Co2+)分别在55、60和65℃下都孵育15、30 和60 min后,标准反应体系在最适温度和最适pH 下测定剩余酶活,以初始酶活力为100%,计算出相对酶活,以确定温度对酶稳定性的影响。
pH稳定性测定:经pH 5.0-13.0的缓冲液(含Co2+)稀释的A4GI,37℃孵育1 h后,标准反应体系在最适温度和最适pH 的下测定剩余酶活,以初始酶活力为100%,计算相对酶活。
1.2.4.2 金属离子对酶活的影响 在酶活测定的标准条件下,在反应体系中加入终浓度为0.5 mmol/L Co2+的基础上,再分别加入10 mmol/L不同的金属离子及化学试剂(K+、Na+、Mg2+、Mn2+、Cr3+、Ca2+、Ni2+、Ag+、Zn2+、Fe2+、SDS、EDTA 和 β- 巯基乙醇),在最适温度与最适pH下反应1 h,测定酶活。以在只有Co2+时的酶活作为对照。
1.2.4.3 动力学常数 在标准体系条件下,分别加入不同浓度的底物D-葡萄糖(10-60 mmol/L),在最适温度和最适pH下反应1 h,冰水浴终止反应,测定果糖浓度,计算酶活。利用米氏方程进行双倒数作图,计算出动力学参数。
1.2.5 转化率测定 3 mL的反应体系中,50 mmol/L磷酸缓冲液(pH 7.5),0.5 mmol/L Co2+,分别在底物葡萄糖浓度为0.1、0.5、1、2和3 mol/L 下测定转化率,在每个底物浓度下加入相对应的足够量的A4GI酶活单位(在葡萄糖浓度为0.1 mol/L 时,加入酶量6 U;其他浓度按比例加入相应酶量),65℃反应,每1 h取一次样(100 µL),测定生成的果糖浓度,计算转化率。转化率即为生成的果糖的量与反应最初的底物葡萄糖的量之比。实验重复3次,每次每个组分3个平行。
2 结果
2.1 基因克隆表达与序列分析
克隆获得的重组葡萄糖异构酶的核酸序列长度为1 320 bp,编码439个氨基酸。蛋白经镍离子磁珠纯化后,SDS-PAGE的鉴定结果(图 1)显示单一组分的重组蛋白,分子量大小在45 kD左右,与理论分子量一致,表明A4GI已成功克隆、表达并纯化。已纯化的异构酶经蛋白浓度和酶活测定,其比活计算得到为1.29 U/mg。A4GI氨基酸序列经NCBI数 据 库 Blastn(https://blast.ncbi.nlm.nih.gov/Blast.cgi)分析,其氨基酸序列与来源于Alicyclobacillus hesperidum(登录号为EJY54601)的GI的氨基酸序列相似性为100%。与PDB数据库中来源于Bacilus Stearothermophilus的 GI(PDB ID:1A0D_A)相似性最高为73%,与ThermoanaerobacteriumThermosulfurigenesGI(PDB ID:1A0C_A)相似性次之,为68%。

图1 A4GI重组蛋白SDS-PAGE 分析
2.2 酶学性质
2.2.1 最适反应条件及稳定性 重组A4GI经最适温度、最适pH测定显示,其最适温度与最适pH分别为65℃与pH 7.5,在较高温度70℃下还具有54%以上的酶活,但在75℃下几乎失活。在pH 6.5-8.0具有69%以上的酶活,可应用于偏酸性条件(图 2-A,2-B)。
以未处理时酶活为100%。热稳定性测定结果(图2-C)显示,A4GI在55℃处理1 h,剩余酶活78% 以上;60℃处理1 h,剩余酶活50%;65℃处理1 h,几乎完全失活,剩余酶活6%;说明A4GI在55℃及其以下,可以保持稳定的状态。pH稳定性测定结果(图2-D)显示,A4GI展现出宽泛的pH稳定性,在pH 6.0-11.0的缓冲液中37℃处理1 h,保持99% 以上的酶活,相当的稳定。
2.2.2 金属离子对酶活的影响 当在酶促反应体系中不加入任何离子时,A4GI葡萄糖异构酶的活性很低。但当加入微量的Co2+时,酶活得到了极大的提高。酶促反应体系中在含有Co2+离子的情况下,测定其他金属离子对酶活的影响结果(表 2)显示,K+也有略微激活作用(10% 以上)。Na+、Mg2+对酶活性没有明显的影响,酶活在10% 以内波动。而大多数金属离子与化学试剂,像Fe2+、Ag+、Ni2+、Ca2+、Cr3+、Mn2+、EDTA 和 SDS 对酶 A4GI有严重的抑制作用,酶活在30% 以下。
2.2.3 动力学常数 在D-葡萄糖浓度为10-60mmol/L下测定了A4GI的动力学。动力学参数通过米氏方程双倒数曲线(方程式:y=26.638x+0.2669,拟合度:R2=0.997 8)计算得到,A4GI的Km、Vmax和Kcat/Km值分别为 99.8 mmol/L、3.75 μmol·min-1·mg-1和 1.87 min-1·mmol·L-1。Km值越低,表示酶对底物的亲和力越高。Kcat/Km值越大,表示酶对底物的催化效率越高。
2.3 A4GI的转化率研究
在测定不同底物浓度下A4GI的转化率的结果如图3所示,A4GI具有优良的底物耐受性,在一定底物浓度范围内(0.1-3 mol/L D-葡萄糖),A4GI的最大转化率随着底物浓度的增具有升高的趋势;底物浓度越高,反应的平衡点右移,生成的果糖越多;在D-葡萄糖浓度为3 mol/L时,A4GI在第3小时达到最大转化率为52.7%。

图2 A4GI最适反应条件及稳定性
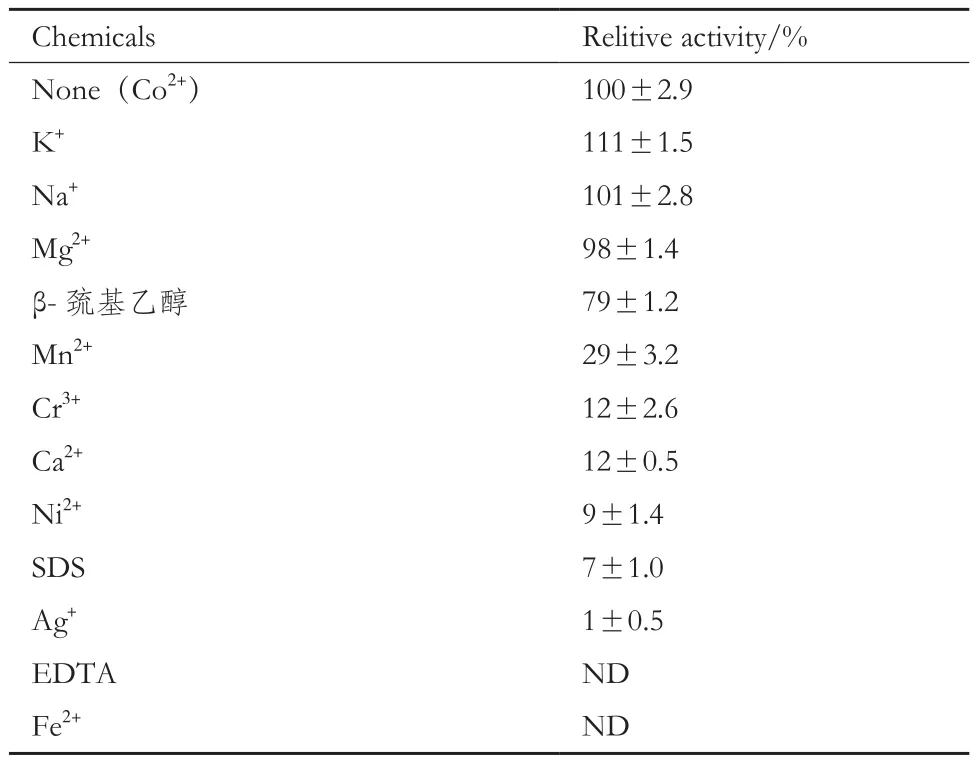
表2 不同金属离子及化学试剂对A4GI酶活的影响

图3 A4GI在不同葡萄糖浓度下的转化率
3 讨论
为了能筛选到一株具有高转化率的葡萄糖异构酶,本研究从Alicyclobacillussp.A4高温菌株中分离出葡萄糖异构酶基因,并在大肠杆菌Escherichia coliBL21(DE3)中进行表达。Alicyclobacillussp.A4菌株是从云南省的一个热温泉中分离出来的一株高温菌。大部分来源于这株菌的酶,最适温度基本都在55-70℃左右,像木聚糖酶[8]、β-1-4-葡聚糖酶[9]、α-半乳糖苷酶[10]等。这是首次克隆表达来自于这株菌株中的葡萄糖异构酶,A4GI的最适温度为65℃。大部分葡萄糖异构酶的最适温度都在60-80℃之间。例如,来自于Thermobifida fuscaWSH03-11的葡萄糖异构酶被在大肠杆菌中表达,其最适温度为80℃[11]。来自于Thermoanaerobacter thermosulfurigenes的 GI最适温度为 65℃[12]。来自于Streptomyees olivaceoviridisE-86的葡萄糖异构酶的最适温度为60℃[13]。但是近几年由于对高温葡萄糖异构酶的迫切需求,已有很多超高温酶被发现,像通过基因挖掘的Thermoanaerobacter ethanolicusCCSD1(TEGI)葡萄糖异构酶最适温度为 90℃[14]。Thermotoga neapolitana5068葡萄糖异构酶最适温度在95-100℃之间[15]。同样通过基因挖掘,来自于Thermus oshimai的葡萄糖异构酶的最适温度高达95℃[16]。虽然很多葡萄糖异构酶的最适温度高达90℃以上,但过高的温度用于生产会消耗能源,增加生产成本[10]。另外,超高温也容易使底物与产物热变质,以及在异构化过程中产生更多的副产物[17]。本研究中经最适pH测定后,显示A4GI是中性酶,最适pH为7.5。这和大多数研究者的结果是相似的,来 自 于Thermoanaerobacterium saccharolyticum[18]、Actinoplanes missouriensisCICIM B0118(A)[19]、Thermoanaerobacterstrain B6A[20]、Streptomyces griseus[21]等的葡萄糖异构酶的最适pH都是7.0-7.5之间。但在葡萄糖到果糖的异构化反应中,不仅温度对果糖的产量有影响,反应体系的pH也很重要。工业化应用需要在一个微酸性的pH环境下,以减少碱性条件下产生的褐变反应及副产物[22]。但是大多数商业的葡萄糖异构酶的最适pH在7.5-9.0之间,并且在酸性条件下,酶活大大的下降。A4GI在pH 7.0时具有95% 的酶活,在pH 6.5时具有69% 的酶活,利用这一点也许可以解决上述问题。本研究中A4GI在 55℃以下较稳定,在其最适温度65℃时稳定性较低,这是因为最适温度测定是在具有底物的环境中测定的,底物的存在有助于稳定酶的三维构象,因此有很多酶表现为最适温度高于稳定性温度[23-24]。A4GI热稳定性较低也可能是其转化率没有达到55% 以上的原因[7],因此在后期实验中利用蛋白分子改造技术提高其热稳定性是有必要的。但A4GI有宽泛pH稳定性。A4GI在pH 6.0-11.0处理1 h,仍剩余99%以上的酶活。相比较于已报道过的葡萄糖异构酶,A4GI展现出很好的pH稳定性。葡萄糖异构酶的最适底物是D-木糖,对葡萄糖的Km值一般要比对木糖的大很多。A4GI对底物葡萄糖的Km值分别是99.8 mmol/L,低于大部分已报道的GIs, 像Thermobifida fusca[11]、Thermoanaerobacter ethanolicus[14]、Thermoanaerobacterium saccharolyticum[18]、Thermoanaerobacterstrain B6A[20]的Km值分别为 197、421、199和120 mmol/L。这表明A4GI对底物亲和力高,具有工业应用潜力。
葡萄糖异构酶一般都需要二价金属离子Mg2+、Co2+和Mn2+或这3种离子的组合,来获得最大酶活。Mg2+主要起激活剂的作用,Co2+主要是稳定酶的构象[25]。像来源于Streptomycessp.的葡萄糖异构酶在加入Mg2+情况下,酶活显著提高[26]。来源于Thermoanaerobacterstrain B6A菌株中的葡萄糖异构酶需要Mg2+和Co2+[19]。本研究中,A4GI 活性需要Co2+来激活,并且被Ca2+、Ni2+抑制。这与前人研究报道是相似的,是由于Mg2+、Co2+、Mn2+和Fe2+的金属离子半价≤0.8Å,而碱土金属离子Ca2+、Ba2+和 Sr2+和过渡金属离子 Hg2+、Pb2+、Ni2+、Cu2+和Cd2+的离子半价较大[27-28]。
葡萄糖异构酶作为重要的工业酶之一,被广泛应用于高果糖浆的生产。现在商业的葡萄糖异构酶因效率较低,主要用于生产HFCS-42,很难达到一步法生产HFCS-55[22]。所以到目前为止,55% 的高果糖浆的生产只能通过HFCS-42进一步的纯化浓缩获得[29],使生产成本居高不下。根据高温使底物到产物的平衡点右移的原理,筛选一株嗜热的葡萄糖异构酶是一步法获得55% 的高果糖浆的一种可行的办法[7,30]。本研究立足于这一点,从Alicyclobacillussp.A4高温菌株中挖掘并从它们的基因组中分离出葡萄糖异构酶基因。在转化率研究中,A4GI在葡萄糖底物浓度为3 mol/L 时,转化率先升高后下降,下降的原因是因为葡萄糖到果糖的反应是一个可逆反应造成的,最高转化率达到52.7%。相比于前人的报道,这是首次在高浓度底物下达到52.7% 的转化率。贾东旭等[16]在2017年报道了来源于Thermus oshimai菌株的葡萄糖异构酶在底物浓度为400 g/L时,85℃反应转化率为52.16%,并且该研究作者分析可能是异构化温度太高而产生过多的副产物,影响了果糖的产量。Jørgensen等[31]也提出高温反应过程中一小部分葡萄糖会降解,一些副产物甘露糖、阿洛酮糖、酸性化合物将生成,从而使反应体系颜色变化。来源于Thermobifida fuscaWSH03-11的葡萄糖异构酶在45%(质量体积比)葡萄糖底物浓度下,最大转化率为53%[11]。来源于Streptomycessp.的葡萄糖异构酶在较低的葡萄糖浓度下(质量体积之比为30%),转化率为55%[24];该酶的最适pH是11.0,在pH 8.0时只有60% 的酶活。来源于Thermoanaerobacter ethanolicus的野生型和突变体葡萄糖异构酶在10% 葡萄糖浓度下,转化率分别为53.8% 和 55.4%[14]。廖承军等[32]在 2015 年报道的Thermotoga petrophilaGI也在10% 的葡萄糖浓度下,转化率为53.8%。这些报道中有部分葡萄糖异构酶达到55%的转化率,但其都是在较低的葡萄糖浓度下(低于3 mol/L 葡萄糖)测定的,且没有关于转化率与底物浓度之间的关系的描述。本研究结果显示,A4GI异构酶的最大转化率随着底物浓度的增加呈升高趋势,这结果和前人报道有些不同,像来自于Thermus oshimai的GI在50-500 g/L的底物浓度下,果糖转化率呈现先升高后下降的趋势[4],这说明A4GI具有较强的底物耐受性。并且A4GI在3mol/L 的葡萄糖浓度下达到52.7%的 高转化率,不管是在高果糖浆的生产还是在其产品(干物质为70%)形成中都能有效地减少成本。
4 结论
从Alicyclobacillussp.A4菌株中克隆一葡萄糖异构酶基因A4GI,并成功进行原核异源表达。对纯化的重组A4GI进行基本酶学性质与应用转化率测定。A4GI最适温度为65℃,最适pH为7.5,需要Co2+辅助异构化反应,在55℃ 以下及pH 6.0-11.0之间相当稳定,对底物葡萄糖的Km、Vmax值分别为99.8 mmol/L 和3.75 U/mg。在一定底物浓度下,A4GI转化率呈现升高的趋势,在3 mol/L 葡萄糖浓度下达到最高为52.7%。

