盐生植物盐角草同化枝不定芽的诱导与增殖
冯肖莉,李学文,王艳
(新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
0 引 言
【研究意义】盐胁迫是影响植物生长分布、产量和质量的主要因素之一,选育适宜于盐碱地生长并且具有较高经济和生态价值的植物品系,是利用和改良盐碱地经济有效的措施之一[1-2]。盐角草(SalicorniaeuropaeaL.)是迄今报道的最为耐盐陆生高等真盐生植物之一,为藜科盐角草属(SaliconiaL),一年生草本植物,具有较高的营养价值和药用价值,在蔬菜、食用油、饲料和制药等方面具有很广阔的应用前景[3]。【前人研究进展】植物细胞的全能性使其在离体条件下具备再生形成完整植株的潜能[4-5],然而有些植物的离体再生很容易,有些植物则很困难。有关藜科盐角草属植物的组织离体培养鲜有报道,前期史秀玲等[6]以盐角草完整的成熟种子为起始培养材料,进行愈伤组织的诱导及分化,建立了盐角草的体外再生体系。【本研究切入点】研究发现,愈伤细胞的过度分裂会导致体细胞的无性系变异[7-8],经愈伤组织阶段的离体再生往往会引起遗传的不稳定性,因而器官发生途径获得的再生植株往往具有较高的稳定性[9-11]。一个高效的器官发生途径既可以快速扩繁优良品种,同时也可用于高效遗传转化体系的建立。研究盐生植物盐角草同化枝不定芽的诱导与增殖。【拟解决的关键问题】通过对不同植物激素的筛选以确定直接诱导盐角草不定芽与增殖的最适培养基,为盐碱地的生态改良及筛选与鉴定盐生植物中重要的抗盐基因奠定基础,为从细胞水平研究耐盐植物的适应性机制提供基础。
1 材料与方法
1.1 材 料
1.1.1 材料
外植体:野生盐角草(SalicorniaeuropaeaL.)植株采自五家渠103团10连水库(N44.53,E87.57,海拔374 m),整株植株带土挖回。
1.1.2 试剂
噻苯隆苯基脲(TDZ)、生长素α-萘乙酸(NAA)、细胞分裂素6-苄基腺嘌呤(6-BA)均购于BBI Life Sciences公司;蔗糖、琼脂、氯化钠等均为天津市盛奥化学试剂有限公司购买的分析纯化学药品。
1.1.3 诱导培养基
以MS培养基为基本培养基,分别添加不同浓度的TDZ、6-BA和NAA,设计5种不同激素配比诱导培养基MS1、MS2、MS3、MS4和MS5。由于盐角草的自然生境为盐碱地,为保证细胞渗透压的稳定,以上5种培养基中分别加入4种不同浓度的NaCl(0 、100、150 和200 mM)以筛选盐角草同化枝不定芽诱导的最佳需盐浓度。表1
表1 盐角草直接不定芽诱导培养基
Table 1 Media used for direct adventitious bud induction of S. europaea
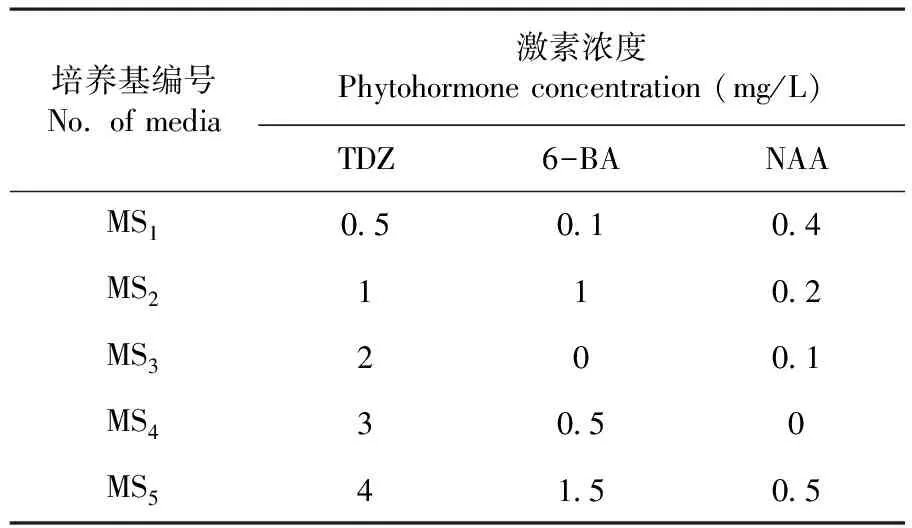
培养基编号No. of media激素浓度Phytohormone concentration (mg/L)TDZ6-BANAAMS10.50.10.4MS2110.2MS3200.1MS430.50MS541.50.5
1.2 方 法
1.2.1 盐角草外植体消毒处理
选择健壮、幼嫩且无病虫害的盐角草同化枝组织,用自来水反复冲洗3 h,滤纸吸干,用75%酒精润洗30 s,10%次氯酸钠处理15 min,无菌水冲洗4遍进行表面消毒灭菌。
1.2.2 不定芽的诱导培养
将消毒处理后的盐角草同化枝切成长1.0 cm的小段,将切好的同化枝组织接种于上述诱芽分化培养基中进行培养,每个处理接种10瓶,每瓶接种5~6个外植体。培养40 d后统计不定芽诱导率,并记录不定芽的颜色、质地及生长状况。按下列公式计算:不定芽诱导率=(诱导出不定芽的外植体数/接种的总外植体数) ×100%。
1.2.3 不定芽继代及增殖培养
将诱导分化的不定芽从基部切下,接种至不同激素浓度配比的增殖培养基中,基本培养基为含200 mM NaCl的MS培养基,附加不同浓度的TDZ和NAA,共设置5种培养基B1、B2、B3、B4和B5,每种培养基接种6瓶,每瓶接种5~6个幼芽,30 d后统计不定芽的增殖率。计算:增殖率=(分化出的不定芽数/接种不定芽块数)×100%。表2
表2 不定芽增殖培养基
Table 2 The medium for adventitious bud proliferation
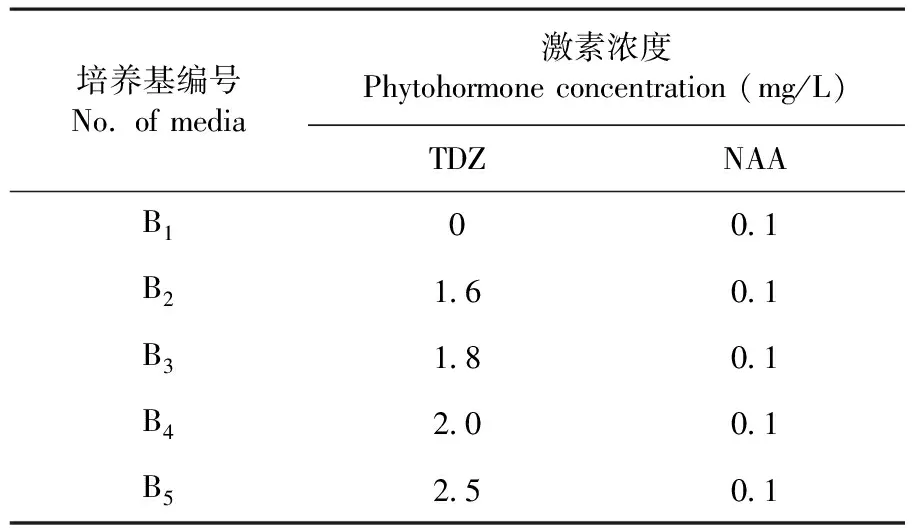
培养基编号No. of media激素浓度Phytohormone concentration (mg/L)TDZNAAB100.1B21.60.1B31.80.1B42.00.1B52.50.1
1.2.4 培养条件
培养基中均附加琼脂7.0 g/L,蔗糖30 g/L。以上实验的培养条件温度均为(25±1)℃,光照时数16 h/d,光强30~40 μmol/(m2·S)。
1.3 数据处理
采用Excel 2010对数据进行整理;采用SPSS 20.0方差分析和Duncan检验对各处理均值进行多重比较,两组间比较以P<0.05为差异有统计学意义(*表示)。
2 结果与分析
2.1 不同植物激素组合与不同NaCl浓度组合对盐角草不定芽诱导的影响
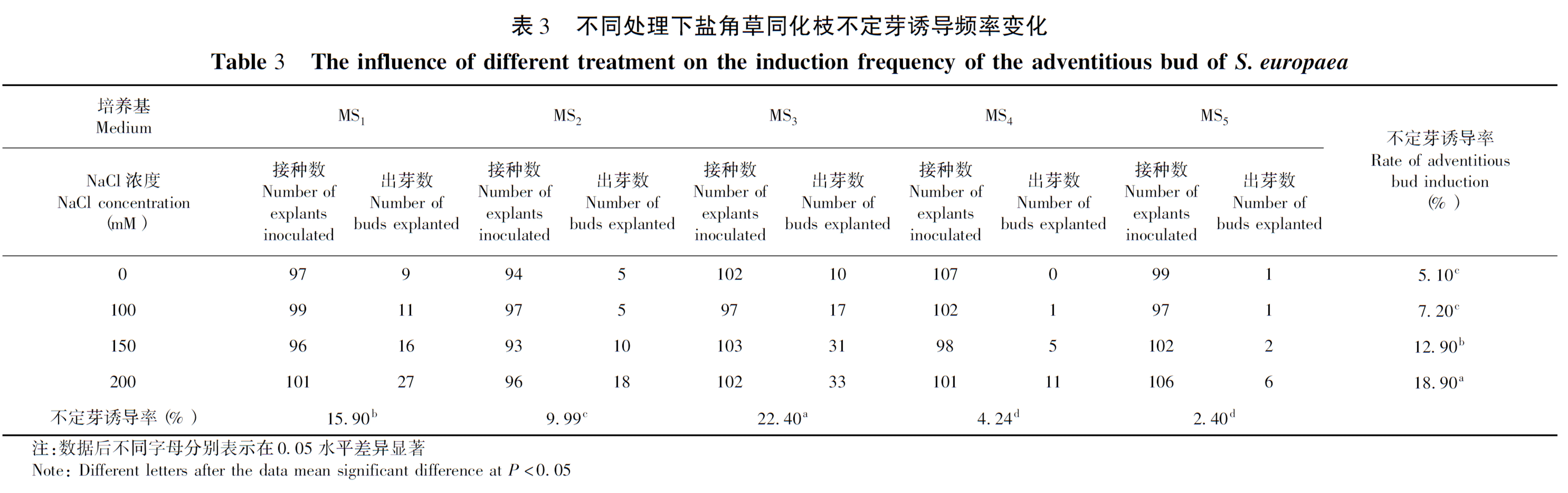
盐角草同化枝培养20 d后可见外植体周围诱导出现致密浅绿色的细胞团块(图1A),其生长迅速,约20 d后形成不定芽(图1B)。不同种类激素及浓度和不同盐浓度组合的20种培养基诱芽结果显示,20种培养基中,MS3(MS+2.0 mg/L TDZ+0.1 mg/L NAA)培养基的有效平均诱芽率达22.40%,显著高于(P<0.05)其余组。NaCl浓度对盐角草不定芽的诱导率也具有显著影响,随着NaCl浓度的增加,不同激素配比的5种培养基中不定芽的诱导率也逐渐增加。当NaCl浓度达到200 mM 时有效诱芽率显著高于(P<0.05)其余浓度,平均诱导率为18.9%。在最适200 mM NaCl和最适MS3培养基中,盐角草同化枝的不定芽诱导率可达32.4%,为最适诱芽培养基。表3,图1
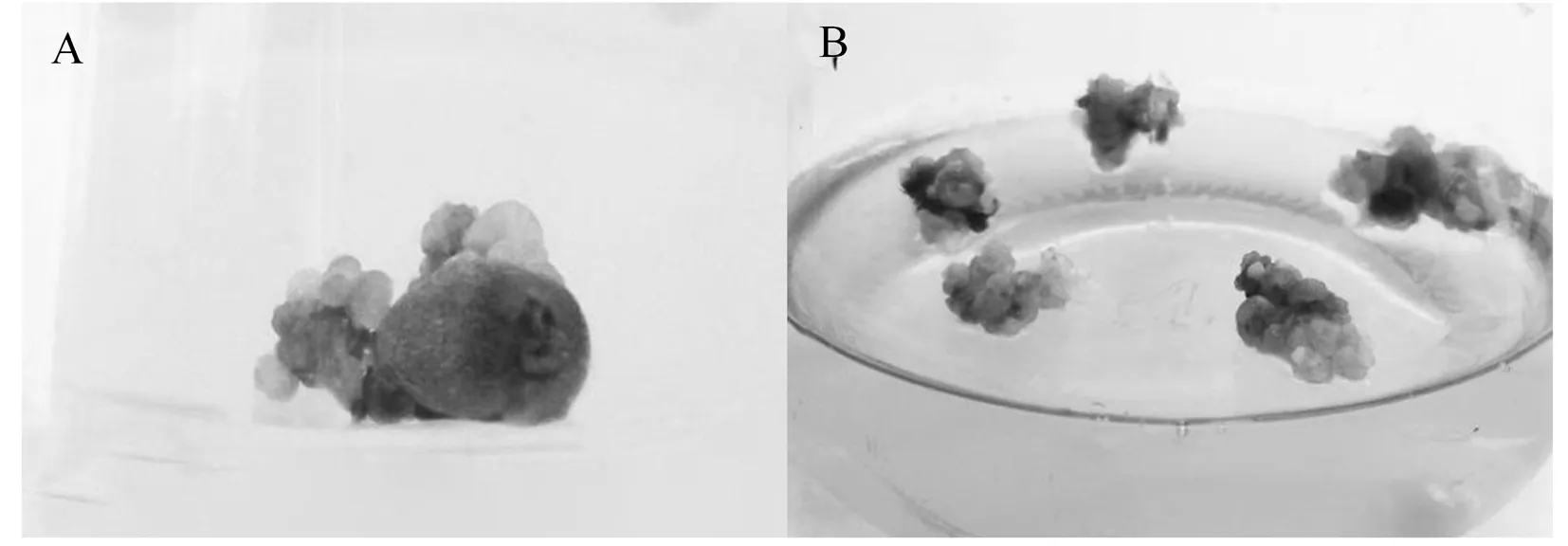
A 盐角草同化枝20 d后诱导的细胞团块; B 盐角草同化枝40 d后分化的不定芽
A Adventitious buds induced by the branches ofS.europaea;B Proliferation of adventitious buds
图1 盐角草同化枝不定芽分化
Fig.1 Differentiation of adventitious bud of S. europaea
2.2 不同TDZ浓度对不定芽继代和增殖的影响
为了比较TDZ对不定芽增殖的影响,将盐角草不定芽继代培养在含有0.1 mg/L NAA和不同TDZ浓度的培养基中,且培养基中均添加200 mM NaCl。研究表明,在调整TDZ浓度后各组之间不定芽增殖率在498.6%~619.5%,各组无显著差异(P>0.05),且不定芽均呈现出形态饱满,颜色翠绿,但明显可以看出,随着TDZ浓度的降低,不定芽出现了一定程度变红的趋势(图2A-E)。由于前期进行再生芽诱导时选用的是2 mg/L TDZ,增殖频率也是2 mg/L TDZ的B4培养基略高,因此,进行不定芽增殖时统一选择2 mg/L TDZ(图2D)。不定芽在B4培养基中培养约40 d后,增殖迅速,且不定芽长势较壮(图2F)。表4,图2
表4 TDZ下盐角草不定芽增殖频率变化
Table 4 The influence of TDZ on the induction frequency of the adventitious bud of S. europaea
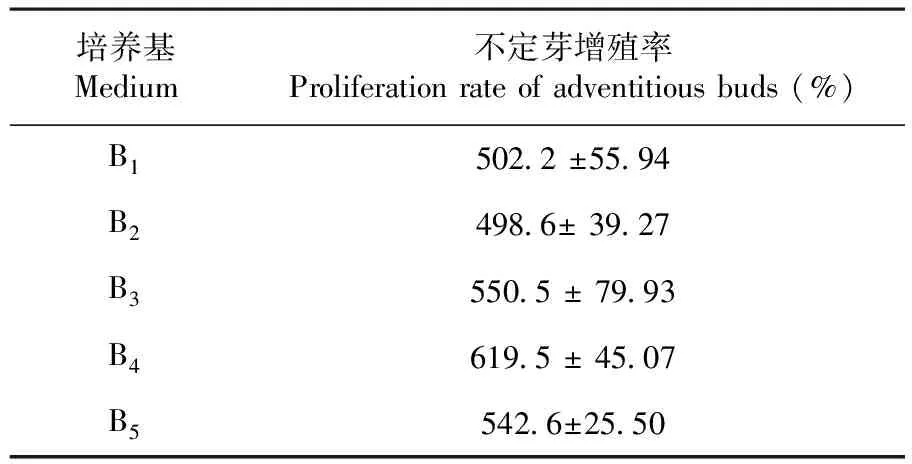
培养基Medium不定芽增殖率Proliferation rate of adventitious buds (%)B1502.2 ±55.94B2498.6± 39.27B3550.5 ± 79.93B4619.5 ± 45.07B5542.6±25.50
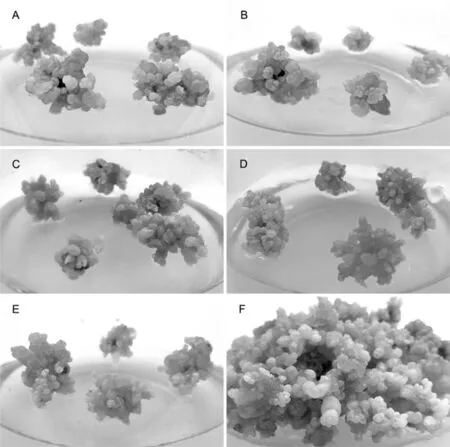
A 0 mg/L TDZ;B 1.6 mg/L TDZ;C 1.8 mg/L TDZ;D 2.0 mg/L TDZ;E 2.5 mg/L TDZ;F 不定芽增殖
A 0 mg/L TDZ;B 1.6 mg/L TDZ;C 1.8 mg/L TDZ;D 2.0 mg/L TDZ;E 2.5 mg/L TDZ;F Proliferation of adventitious buds
图2 盐角草不定芽的继代和增殖培养
Fig.2 Differentiation of Salicornia adventitious buds induction
3 讨 论
植物离体器官在合适的培养条件下,不经过愈伤组织阶段从外植体上直接分化形成不定芽的途径称为直接器官发生[12-14],而外源激素的组合及浓度配比是影响外植体分化方向的重要因素。不同种类和浓度的植物激素对同一植物不同类型的外植体而言,敏感度差异也不尽相同。史秀玲[6]以盐角草2~3周龄无菌苗下胚轴和子叶作为外植体接种于含有不同浓度的BA与NAA组合、TDZ与IAA组合和TDZ、BA与NAA组合的培养基中,均未诱导出不定芽;而以成熟种子为起始培养材料,在添加TDZ 0.1 mg/L与NAA 1 mg/L的培养基上,通过愈伤组织途径获得了不定芽。研究选取野外生长的盐角草肉质化同化枝为外植体,使用TDZ 2.0 mg/L和NAA 0.1 mg/L的激素组合,成功诱导了不定芽的发生。TDZ是一种合成的杂环芳香脲,具有生长素和细胞分裂素双重作用[15],在许多植物离体培养实验中被证明是一种对不定芽诱导极为有效的植物激素[16],且离体再生往往受到较高浓度TDZ的促进[17-21]。研究也发现,在添加NAA和不同浓度TDZ的MS培养基中均诱导出了不定芽,其中高浓度的TDZ(2.0 mg/L)可高频率的直接诱导不定芽的产生,可能正如史秀玲[6]的研究,较高浓度的TDZ抑制了盐角草愈伤组织的形成,但当TDZ浓度达到3~4 mg/L时,不定芽的诱导也出现了显著的抑制。
盐角草属真盐生植物,适宜的盐浓度会促进盐生植物的生长[22-23],也有研究显示[24-26]适当浓度的NaCl能有效促盐生植物愈伤组织的形成。史秀玲等[6]和余桂红等[27]分别在培养基中添加170 mM和137 mM的NaCl均提高了藜科盐生植物盐角草和海篷子愈伤组织分化为不定芽的频率。研究中,盐角草在添加不同浓度NaCl的培养基中不定芽诱导频率不同,随着NaCl浓度增加而升高,其中200 mM NaCl组诱导率最高,平均诱导率达18.9%。研究中,不添加NaCl的最适激素配比培养基中的诱芽率仅为9.8%,而添加200 mM NaCl后增加至32.4%,NaCl浓度是不定芽诱导分化的关键因素,200 mM NaCl为盐角草不定芽诱导及增殖最适盐浓度。
4 结 论
研究以盐生植物盐角草同化枝为外植体,通过直接器官发生途径筛选出了盐角草不定芽诱导的最适培养基,以MS为基本培养基附加2.0 mg/L TDZ及0.1 mg/L NAA,平均诱芽率达22.40%。不定芽诱导的最适盐(NaCl)浓度为200 mM,平均诱导率为18.9%。盐角草同化枝在200 mM NaCl的MS3培养基中不定芽诱导率和增殖率可达32.4%,经过30~40 d的培养,不定芽增殖率可达619.5%,盐角草不定芽诱导及增殖最适培养基均为:MS+2.0 mg/L TDZ+0.1 mg/L NAA+200 mM NaCl。一定浓度的TDZ、NAA及NaCl组合可通过直接器官发生途径有效诱导盐角草同化枝不定芽的产生和增殖。

