化学核心素养下化学平衡状态的判断研究
杨晋芳 杨 蓓
(1.山西师范大学实验中学 山西临汾 041000;2.山西师范大学教师教育学院 山西临汾 041004)
一、问题的提出
化学平衡内容历来是高中化学的核心内容之一,具有抽象性、符号性和复杂性的特点,是公认的化学学习难点之一。化学平衡相关内容也是中学化学中所涉及的溶解平衡、电离平衡和水解平衡等知识的核心,对学生深入学习、应用平衡思想发挥了关键性作用。化学平衡状态的判断是是化学平衡知识体系的重要组成部分之一,同时是高考命题点之一。学生对此内容的学习往往存在心理障碍,已有研究确认了高中生在化学平衡内容学习上存在显著困难[1]。笔者在一线教学实践中,发现在化学平衡这部分内容的学习时,常常会出“化学平衡状态的判断”这类题目,解此题型时,大部分学生对于“气体密度”和“混合气体平均相对分子质量”这两个衍生出的判断方法感到无从下手,导致失分率较高。因此,笔者针对这两个方面总结归纳了解题思路及方法,并建立了分析此类平衡问题的解题模型,旨在发展学生的化学思维能力,提高化学学科核心素养。
二、学生学习障碍分析
1.基于内容特点分析学习障碍
《普通高中化学课程标准(2017版)》[2]针对化学平衡状态的有关内容提出了具体内容标准和学业要求,在必修课程中主要分布在主题2“物质结构基础及化学反应规律”中;在选择性必修课程中主要分布在模块3“化学反应原理”中,具体内容如表1所示。从表1可以看出,化学平衡状态内容与之前所学知识相比横向、纵向联系和综合程度显著提高,深度、广度的发展呈螺旋上升状态。化学平衡是近年高考的热点,化学平衡状态的判断是高考化学的命题点之一,而化学平衡移动对气体密度和混合气体相对分子质量影响的分析更是一大难点,对学生图表数据解读能力、逻辑推理能力、综合解决问题的能力要求较高。因此,笔者针对化学平衡状态的判断内容中“气体密度”和“混合气体平均相对分子质量”这两个衍生出的判断方法,提出解题思路及方法,并建立分析此类平衡问题的解题模型,以加深学生对化学平衡知识的理解,提高学生解决化学实际问题的能力。

表1 新课标中有关“化学平衡状态”的内容标准
2.基于学生认识发展分析学习障碍
学生在化学平衡问题解决中形成的学习障碍不同,形成原因也不同。刘瑞东[3]通过调查发现学生在学习化学平衡之后,仍然对化学平衡中的中心概念问题,如动态平衡的判断;浓度、温度、压强(体积)等对化学平衡的影响;浓度、温度、压强(体积)等对化学平衡反应速率的影响等存在大量的迷思概念。支瑶,王磊[4]等人通过长期的课堂观察、课后跟踪观察和访谈发现,学生在平衡移动规律学习中认识发展障碍点在于缺少对相关问题进行理性分析的“支架”。笔者在教学中发现,在学习化学平衡状态的判断之后,大部分学生仍然不清楚气“气体密度”和“混合气体平均相对分子质量”在什么情况下可以成为判断化学平衡的标志。笔者根据常年教学经验,总结了具体解题思路及方法,并建立了分析此类平衡问题的解题模型,旨在发展学生的化学思维能力,提高化学学科核心素养。
三、建立化学平衡状态判断的解题模型
一般在化学平衡中常见的反应只有两种类型:一种全为气体型,一种不全为气体型。每种类型根据化学计量数关系又可划分为两类,即反应前后气体系数和为零,简称△V=0型;反应前后气体系数和不为零,简称△V≠0型。本文以下面四个反应为例寻找解题思路:
例:
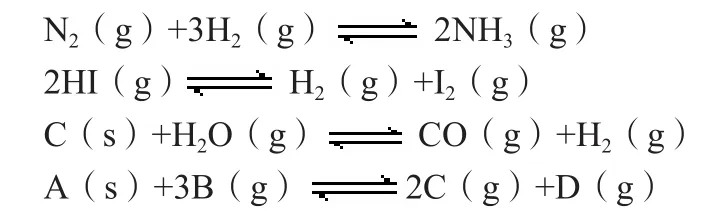
分别分析恒温恒压和恒温恒容状态时其“气体密度”和“混合气体平均相对分子质量”保持不变能否作为判断化学平衡状态的标志。根据密度等于总质量除以总体积(ρ=m/V),平均相对分子质量等于总质量除以总物质的量(M—=m/n),因此只需判断m总、n总和V总是否变化即可。
1.全为气体型
(1)恒温恒容状态
恒温恒容状态时,对于全为气体的反应,根据质量守恒定律,气体的总质量始终不变,又因为条件维持恒容,总体积也始终不变,所以,无论△V=0型还是△V≠0型,密度均不可作为判断标志。而气体总物质的量与反应前后气体系数有关,△V=0时,总物质的量不变,平均相对分子质量不能作为判断依据;△V≠0时,总物质的量发生变化,平均相对分子质量能作为判断依据。所以,从全为气体型总结出,只有△V≠0时,平均相对分子质量可以判断平衡。其余三种情况均不可以。
(2)恒温恒压状态
恒温恒压状态时,由于全为气体,气体的总质量始终不变。对于△V=0的反应,气体总物质的量也始终不变,根据PV=nRT,可知气体总体积也始终不变。因此,对于全为气体型,当△V=0时,平均相对分子质量和密度均不可作为判断依据。而△V≠0时,随反应进行,气体总物质的量会发生变化,恒压下,气体的体积也会发生变化,所以当△V≠0时,密度和平均相对分子质量均可以作为判断化学平衡的标志。
综上两点归纳整理,对△V=0的全为气体型,密度和平均相对分子质量不论什么条件均不能作为判断平衡状态的依据;而对于△V≠0的全为气体型,只有恒温恒容时,密度不可以判断,其余三种情况均可作为平衡判断依据,建立化学平衡状态判断的解题模型,如表2所示。
2.不全为气体型
对于此类反应,反应一旦开始,总质量就会发生变化,所以判断化学平衡状态主要抓住总体积和总物质的量。对于△V=0的反应,无论恒温恒容还是恒温恒压,总体积和总物质的量始终不变,所以密度和平均相对分子质量均可以作为平衡判断依据。对于△V≠0的反应,恒温恒容时,由于容器体积不变,所以密度也可以作为平衡判断依据。总物质的量随反应前后气体系数和发生改变,在平均相对分子质量中,总质量和总物质的量都发生变化,最终要看比值变不变,比值变则可以作为依据,比值不变则不能作为判断依据,这是学生最难理解的一点。恒温恒压时,由于此类反应总质量、总物质的量、总体积均发生变化,密度和平均相对分子质量的判断也要具体情况具体分析。解题模型如表2所示。
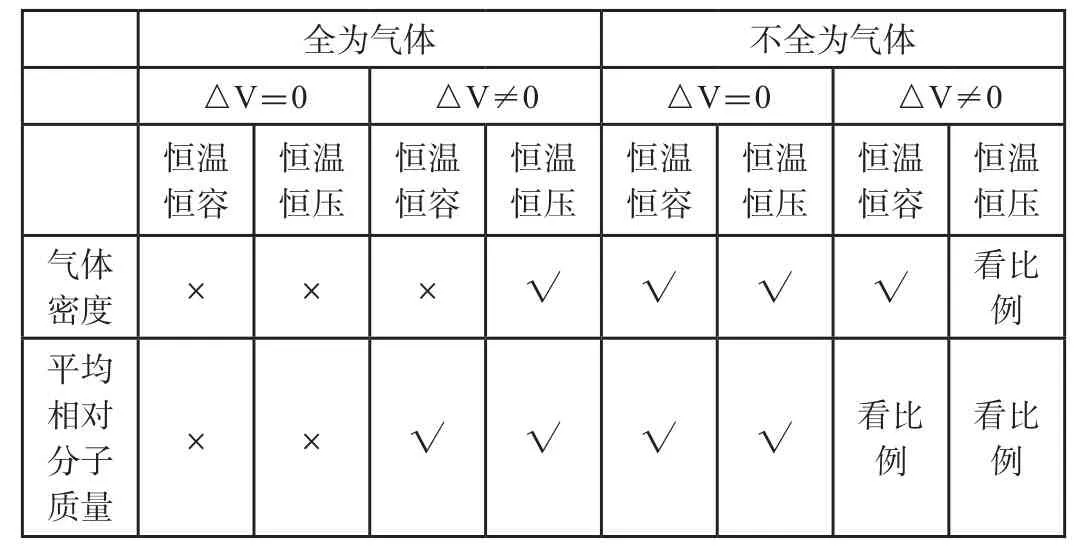
表2 化学平衡状态判断的解题模型
综上所述,笔者尝试归纳总结出化学口诀“两变看比例,一变一定平,不变不适用”,简化了学生的学习难度,更有利于学生理解和掌握。可具体解释为:比例中如果只有一个变量,则一定可以判断平衡;若两个均不为变量,则一定不能判断平衡;若两个变量均发生变化,比值变则可以作为判断平衡依据。具体总结如表3所示。
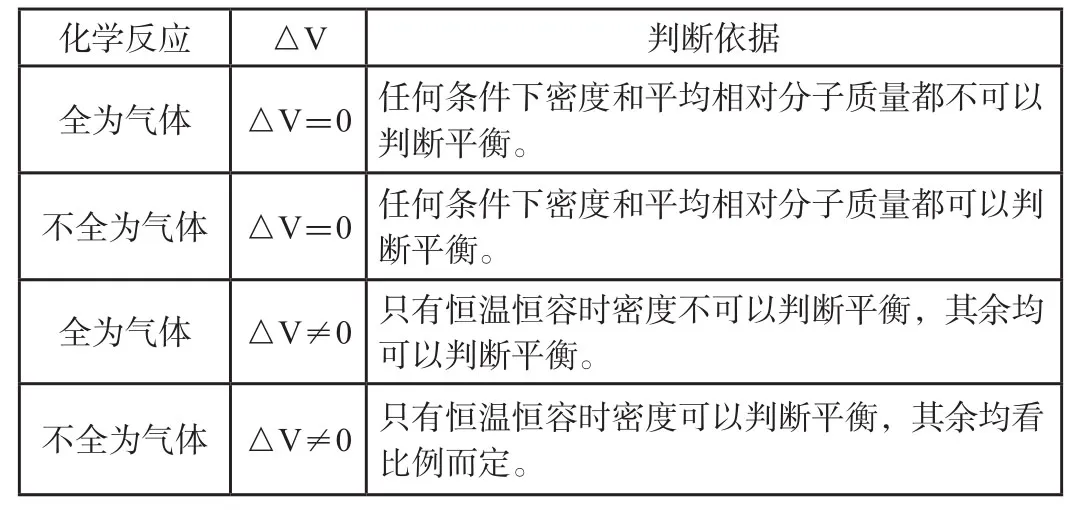
表3 化学平衡状态的判断依据
四、“化学平衡状态的判断”解题模型的应用
基于化学平衡状态判断的解题模型,分别以全为气体、△V=0型;全为气体、△V≠0型及不全为气体型试题为例介绍其应用过程,多角度、全方位突破化学平衡状态标志的判定。
1.全为气体、△V=0型
[例 1] 汽车尾气中,产生NO的反应为:N2(g)+O2(g)2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
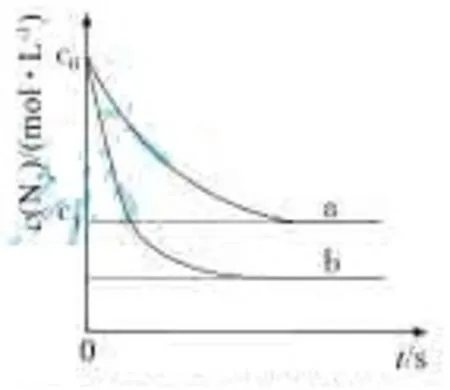
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的△H<0
[解析]根据题意,反应在恒温恒容的密闭容器中发生反应状态,所以气体总体积保持不变,且质量守恒,所以混合气体的密度保持不变。因此B选项错误。
若将此题的条件“恒温恒容”改为“恒温恒压”,由于反应前后气体的总物质的量保持不变,由PV=nRT,可知混合气体的总体积也是保持不变,且质量守恒,所以混合气体的密度始终保持不变。所以对于全为气体、△V=0型的可逆反应,任何条件下密度和平均相对分子质量都不可以判断平衡。
2.全为气体、△V≠0型
[例 2] 一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和,发生反应:2SO2(g)+O2(g)2SO3(g)ΔH=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的。判断该反应达到平衡状态的标志________(填字母序号)。
A.SO2、O2、SO3三者的浓度之比为2∶1∶2
B.容器内气体的压强保持不变
C.容器内混合气体的密度保持不变
D.SO3的物质的量不再变化
[解析]由题可知,反应在为恒温恒容状态下进行,△V≠0。根据化学平衡状态判断的解题模型,B选项中混合气体的总质量不变,容器的容积不变,则混合气体的密度始终不变,不是变量,不能根据混合气体的密度不再改变证明到达平衡,故B选项错误;C项中随反应进行,容器内混合气体的总的物质的量减小,而气体的总质量不变,则混合气体的平均相对分子质量增大,是变量,可以根据平均相对分子质量不再改变说明到达平衡,故C选项正确。
若将此题的“恒温恒容”改为“恒温恒压”,随反应进行,混合气体的总物质的量发生变化,导致气体总体积发生变化,而总质量不变,所以相对分子质量和密度不再改变可以判断达到平衡状态。
3.不全为气体型
[例 3] 将C (s) 和H2O(g)以物质的量之比1:2置于恒容容器中,一定条件下发生反应:C(s) +H2O(g)H2(g)+CO(g)△H>0。下列能说明反应达到平衡状态的是( )
A、v(H2O)= v(CO)
B、H2、CO的体积比保持不变
C、形成2mol H-O键,同时生成1mol C
D、混合气体密度和平均相对分子质量都保持不变
[解析]由题可知,该反应中不全是气体,随着反应进行,混合气体的总质量增大,反应前后混合气体的总物质的量、容器体积保持不变,则混合气体的密度和平均相对分子质量都是增大的,是变量。可根据混合气体的密度和平均相对分子质量保持不变证明达到平衡状态。
[例 4] 在一定温度下的恒容密闭容器中,不能说明NH2COONH4(s)2NH3(g)+CO2(g)达到平衡状态的是 ( )
A.混合气体的平均相对分子质量不再发生变化
B.混合气体的密度不再发生变化
C.混合气体的总物质的量不再发生变化
D.混合气体的压强不再发生变化
[解析]A项由题意知,混合气体中氨气和二氧化碳的体积比始终是2:1,质量也是成比例增加的,因此混合气体的平均相对分子质量始终不变,所以不能据此说明反应达到平衡状态;B.密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但混合气体的质量是变化的,所以混合气体的密度不再发生变化说明反应达到平衡状态,B错误。
该题较特殊,若将此题的“恒温恒容”改为“恒温恒压”,混合气体的体积和质量都成比例增加,混合气体的密度始终不变,不是变量,不能据此说明反应达到平衡状态。
五、建立“ 化学平衡状态的判断”解题模型的意义
通过上述例题分析发现,化学平衡状态判断的解题方法有一定的内在规律,其解题模型如表2所示。首先根据化学反应方程判断反应是全为气体型或不全为气体型,并根据题意分析反应是在恒温恒容还是在恒温恒压状态下进行;其次根据化学反应方程式判断反应前后气体分子数是否等于0,即△V=0或△V≠0;最后,根据“ 化学平衡状态的判断”的解题思路及模型,具体题型具体分析,对实际问题进行解答。该解题模型基于化学科学观念──质量守恒定律和化学方程式判断,对复杂的化学平衡问题抽象概括出一般解题模型,有广泛的适应性和严密的逻辑性,有利于学生快速抓住问题的核心形成有效的思路,有利于学生建构清晰的思维结构从而高效地解答[5]。本文旨在帮助学生建立一个基于化学平衡状态分析及改变的解题方法及模型,特别是“气体密度”和混合气体平均相对分子质量”在什么情况下可以作为判断平衡的依据进行分析,使学生体验一种证据推理的思考过程,逐渐形成模型认知,培养学生的化学学科核心素养。

