匍枝根霉诱变株β-葡萄糖苷酶结构功能研究及发酵优化
郑贤金,汤斌
(安徽工程大学 生物与化学工程学院,安徽 芜湖,241000)
β-葡萄糖苷酶(β-glycosidase,BG),又称纤维二糖酶,在食物增香、减少大豆熟糖浆造成的苦味、糖尿病治疗等方面具有重要作用[1-2]。尤为重要的是,在纤维素酶协同降解纤维素的过程中,BG可将纤维二糖分解成葡萄糖,因而可以有效解除降解过程中纤维二糖过度积累对外切酶和内切酶的限制[3],提高纤维素酶的利用效率。然而,除黑曲霉外,目前常用于生产的木霉、青霉等菌株中内切酶和外切酶所占比例较高,而BG则相对不足[4]。苏龙等[5]对罗尔夫青霉HXL发酵条件进行优化,发酵7 d后BG酶活达到21.68 U/mL(等同于21.68 IU/mL);陈娜等[4]通过对黑曲霉TJ02进行诱变选育及发酵条件优化,BG酶活达到39 IU/mL。BG酶活的提高可有效促进纤维素向葡萄糖的转化[6],因此提高BG产量对纤维素的降解具有重要意义。
本文所使用出发菌株匍枝根霉TZ-03为本实验室对原菌TP-02诱变选育所得,其BG酶活较原菌提高1.52倍。且匍枝根霉具有发酵时间短的优势,因此若能进一步提高BG产量则会有重要的工业应用价值。
本文初步分析了诱变后TZ-03菌株BG酶活提高的原因,并通过摇瓶优化培养基组分及10 L发酵罐放大培养TZ-03,显著提高了BG酶活,为今后BG的工业化生产提供理论参考。
1 材料与方法
1.1 材料与试剂
匍枝根霉TZ-03,对本实验室保藏菌株匍枝根霉TP-02进行紫外-甲基磺酸乙酯复合诱变所得。具体条件:浓度107~108个/mL的TP-02孢子悬浮液8 mL加入2 mL甲基磺酸乙酯,将其置于90 W紫外灯下照射5 min后用10% NaS2O3溶液终止反应。
匍枝根霉TP-02,E.coliJM109由安徽工程大学3R实验室保藏;pUCM-T载体,上海生工生物有限公司;质粒提取试剂盒、DNA纯化试剂盒、DNA胶回收试剂盒、T4DNA ligation、EcoR I、蛋白Marker等,宝生物(大连)有限公司。其他常用药品购于国药集团。
1.2 培养基
种子培养基:100 g/L麸皮浸出汁(100 g新鲜麸皮加入1 000 mL蒸馏水,煮沸30 min,6层纱布过滤并最终定容至1 000 mL),121 ℃灭菌20 min。
基础发酵培养基:稻草粉(80目) 20 g/L、豆粕粉10 g、50 g/L麸皮浸出汁、CaCl22 g/L、MgSO4·7H2O 3 g/L、KH2PO43 g/L、PEG-4000 0.25 g/L、Tween 80 200 μL/L、微量元素液1 mL/L,121 ℃灭菌20 min。
微量元素溶液(mg/L):FeSO4·7H2O 5、MnSO4·H2O 1.6、ZnSO4·7H2O 1.4、CoCl2·2H2O 2。
LB液体培养基、LB固体培养基等参考文献[7]。
1.3 仪器与设备
BIOTECH-10JSA-3000PLC自动发酵罐,上海保兴生物设备工程有限公司;TC312 PCR仪,美国TECH公司;Allg642高速冷冻离心机,美国贝克曼公司;TL988实时荧光定量PCR仪,西安天隆科技有限公司。
1.4 实验方法
1.4.1 诱变前后BG酶活及转录水平的比较
将匍枝根霉TZ-03斜面接种至种子培养基中,200 r/min,30 ℃条件下培养24 h后按10%接种量接种至发酵培养基,30 ℃,200 r/min条件下培养5 d,每12 h测定1次BG酶活;对培养24 h后的种子液进行预处理,利用Trizol法提取总RNA,试剂盒法去除基因组DNA并通过反转录合成cDNA,利用RT-PCR检测bgl4的转录水平[8-9]。
1.4.2诱变株BG编码基因bgl4的获取
采用CTAB法提取基因组[8]。根据GenBank上已公布的相关BG基因序列的保守序列比对分析设计引物1-F和1-R(表1),以基因组为模板扩增目的条带,PCR产物切胶回收,连接pUCM-T载体,转化E.coliJM109,挑选阳性转化子[9],送上海生工测序,其中PCR程序为95 ℃ 2 min,94 ℃ 50 s,45 ℃ 50 s,72 ℃ 90 s,35个循环,72 ℃延伸10 min。根据测序结果设计引物,利用热不对称PCR补全上下游片段,其中上游片段设计引物SP1、SP2、SP3;下游设计的引物SP4、SP5、SP6。再根据补全的完整基因序列设计引物2-F和2-R,以基因组为模板,扩增目的基因,测序进行验证,PCR程序为95 ℃ 2 min,94 ℃ 50 s,53 ℃ 50 s,72 ℃ 90 s,35个循环,72 ℃延伸10 min。

表1 本研究所用引物Table 1 Primers used in this study
1.4.3 BGL IV生物信息学分析
利用DNAMAN软件将匍枝根霉TZ-03的BG基因bgl4和TP-02的BG基因bgl序列翻译成对应的氨基酸序列,并将氨基酸上传至Swiss model数据库(https://www.swissmodel.expasy.org/i),通过选取自由能最低的蛋白质结构模型为模板进行同源建模。并利用Discovery Studio 3.0软件,以纤维二糖为配体进行分子对接,进行结构功能分析。
1.4.4 发酵条件优化
分别以质量分数为2%的玉米淀粉、蔗糖、葡萄糖、糊精、木糖、纤维二糖、乳糖、麸皮粉、微晶纤维素、CMC、可溶性淀粉、壳聚糖为碳源进行碳源优化,对照组为稻草粉,培养条件为250 mL锥形瓶装液80 mL,30 ℃,200 r/min,接种量10%,以BG酶活为指标,确定最佳碳源;在上述优化基础上,调整氮源种类为质量分数1%的硫酸铵、胰蛋白胨、氯化铵、大豆蛋白胨、鱼粉蛋白胨、乳清粉、豆渣粉、酵母粉、玉米浆、黄豆粉和质量分数0.5%的尿素,以BG酶活为指标,确定最佳氮源;上述碳氮源优化的基础上,向培养基中添加已过滤除菌的各种氨基酸,使其终浓度为0.1%,以不加氨基酸为对照组,确定最佳氨基酸添加种类。
1.4.5 10 L发酵罐放大实验
培养基为摇瓶优化最优培养基,10 L发酵罐装液量5 L,初始pH值4.8,温度为30 ℃,接种量为10%,初始转速300 r/min,初始罐压0.06 MPa。在发酵过程中调节转速、通气量和罐压维持溶氧在30%左右;调节磷酸和氨水控制pH值维持在4.8左右;发酵24 h后控制补料量(20%淀粉水解液),使发酵液中还原糖的含量在1.2 mg/mL左右。
1.4.6 BG酶活测定
取发酵液1.2 mL于1.5 mL离心管中,3 500 r/min离心10 s后,将上清液用0.05 mol/L pH值4.8柠檬酸-柠檬酸钠缓冲液稀释适当倍数用于酶活测定。以质量分数为1%水杨苷溶液1 mL为底物,按文献的方法测定β-葡萄糖苷酶酶活[10]。
酶活定义:适当反应条件下,每分钟水解底物生成1 μmol还原糖所需的酶量即为1个酶活单位,表示为IU/mL。
2 结果与分析
2.1 诱变前后BG及转录水平的比较
在基础发酵培养基中,原始菌株TP-02和突变株TZ-03的BG酶活如图1-a所示,TP-02的BG酶活在84 h达到4.12 IU/mL,诱变后TZ-03则在108 h达到BG酶活峰值10.53 IU/mL,酶活提高了1.52倍。TP-02的BG基因bgl和TZ-03的BG基因bgl4的转录水平如图1-b所示,2个基因拷贝数分别为3.18×107和3.12×106,诱变后转录水平上调90.19%。转录水平的提高可导致蛋白表达量的提高,故而很可能引起BG酶活提高。
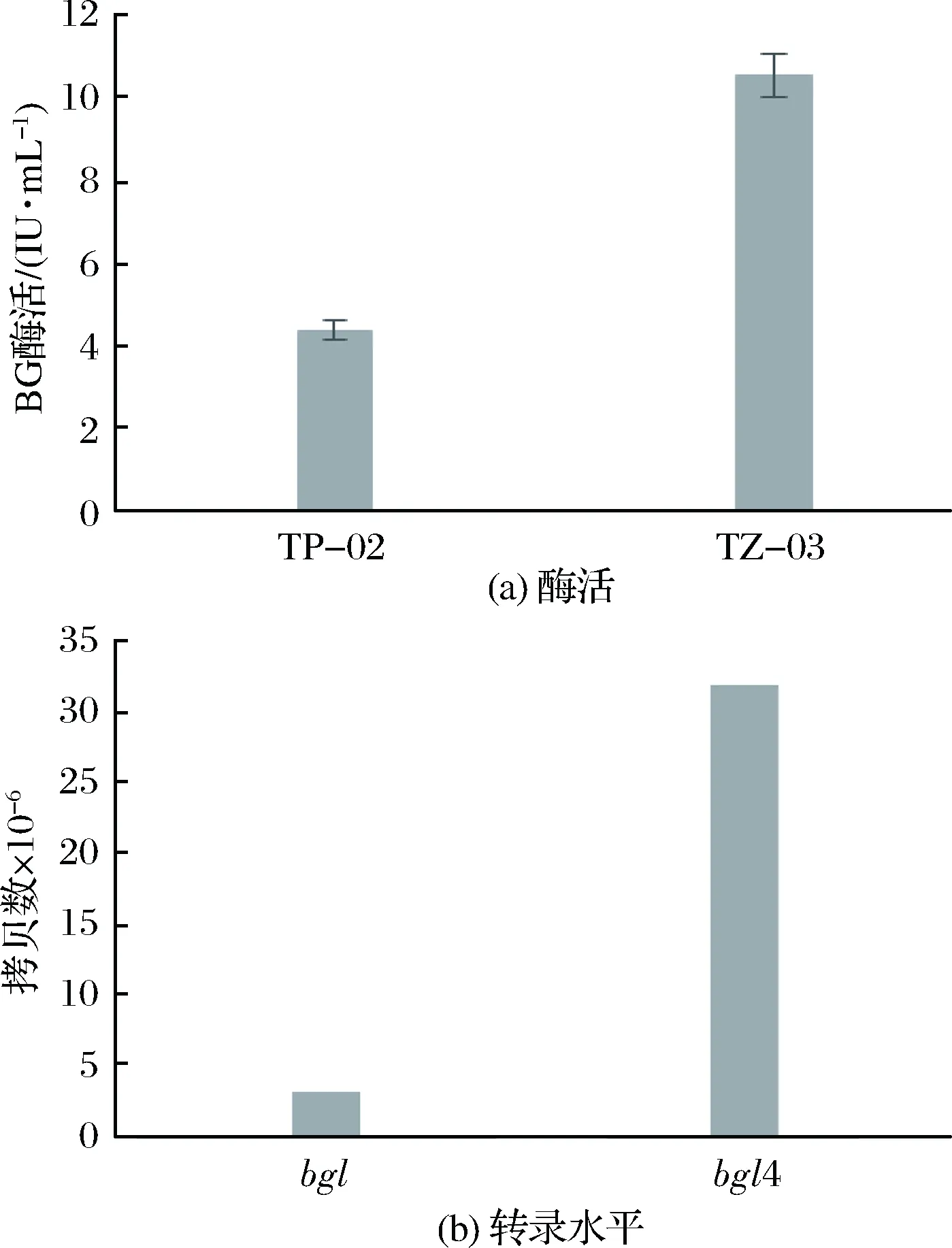
图1 BG酶活(a)及转录水平比较(b)Fig.1 The comparison of β-glycosidase activity(a) and transcriptional level(b)
2.2 诱变株BG编码基因bgl4的克隆
以基因组为模板,克隆得到的1条1 500 bp左右的条带(图2),经测序,结果显示该目的基因全长为1 479 bp,共编码492个氨基酸。

M-Marker;1,2-目的条带图2 bgl4基因的克隆Fig.2 Cloning of bgl4 gene
2.3 BGL IV生物信息学分析
利用CLUSTALW在线工具对BGL和BGL IV的氨基酸序列进行比对。结果如图3所示,与BGL氨基酸序列相比,BGL IV头尾的部分氨基酸发生了替换和缺失,此外在242~272位之间多了一段氨基酸序列。紫外诱变易引起碱基转换、颠换、移码突变或缺失,从而可能造成其编码氨基酸的小范围改变[11];而化学诱变剂则可能会与核苷结构的磷酸反应,形成酯类而将核苷酸从磷酸与糖分子之间切断,造成染色体数量变化[12]。因此诱变后氨基酸序列的改变可能是紫外和甲基磺酸乙酯2种诱变方式共同作用的结果。

图3 BGL氨基酸序列与BGL IV氨基酸序列的差异Fig.3 The difference of amino acid sequence between BGL IV and BGL
利用Swiss model对BGL和BGL IV进行同源建模,并以纤维二糖为底物,利用Discovery Studio 3.0软件进行分子对接,从而对诱变前后结构功能的变化进行分析,其结果如图4所示。图4-a为突变前BGL的分子表面,可以看出酶分子内部形成了一个口袋,与底物相互作用,纤维二糖结合到口袋深处;图4-b表示参与纤维二糖配体形成氢键的氨基酸残基,突变之前,共有ASN242、TYR315、Glu384、Glu173和Trp442等5个氨基酸可以与纤维二糖,结合,形成6个氢键这些氨基酸是关键的氨基酸,在酶的催化过程中有着不可替代的作用。
诱变之后的分子表面图4-c显示,诱变后活性中心迁移,结合区域由口袋深处变浅,这种结构可能使得活性中心更大,一定程度上解决了原中心存在的受力不均、底物堆积等问题,可能使酶分子更快速高效地与底物发生相互作用。同时诱变之后,结合区域的关键氨基酸发生显著变化。与纤维二糖形成氢键的氨基酸有Ala11,Gln70,Ala456,Tyr454,Ala71,Cys67,共形成9个氢键,氢键数量增加[13-14]。诱变后结构的改变可能更有利于酶与底物的结合,对酶活的提高也有一定的促进作用。

a-TP-02分子表面的结构;b-TP-02参与形成氢键的关键氨基酸;(c)-TZ-03分子表面的结构;d-TZ-03参与形成氢键的关键氨基酸。虚线表示氢键图4 BGL和BGL IV与底物结合的结构Fig.4 Structure of BGL-cellobiose complex and BGL IV-cellobiose complex
2.4 培养基优化
2.4.1 碳氮源对BG酶活的影响
碳氮源在微生物的生长过程中具有重要作用,除提供基本营养物质以外,碳源还可提供细胞及产物合成的碳架,氮源则可提供微生物生长所需核苷酸、维生素和矿物质元素等物质合成的原料[15-16]。碳源对BG酶活的影响如图5-a所示,对照组(稻草粉)酶活达到10.53 IU/mL,与其相比,葡萄糖、纤维二糖等糖类碳源的BG酶活普遍较低,而纤维素类碳源BG酶活较高,以麸皮粉为碳源的酶活达到11.47 IU/mL。当以2%微晶纤维素为碳源时,BG酶活在108 h达到峰值14.41 IU/mL,与对照组相比提高了36.8%。
确定碳源为微晶纤维素的基础上,选取不同氮源进行发酵,结果如图5-b所示。总体而言,与有机氮源相比,无机氮源发酵的整体效果较差,其中无机氮源中氯化铵最高酶活只有6.43 IU/mL,而有机氮源成分较为复杂,其中含有的维生素、微量元素、生长因子等可能会促进微生物繁殖和产酶,因此BG酶活普遍较高。当鱼粉蛋白胨作为氮源时,其最高BG酶活可在108 h达到18.30 IU/mL,与氮源优化前相比,提高30.5%。

a-碳源优化;b-氮源优化图5 碳氮源优化对BG酶活影响Fig.5 Effect of carbon sources and nitrogen sources on β-glycosidase activity
2.4.2 氨基酸添加对BG酶活的影响
通过往培养基中添加不同种类的氨基酸,研究氨基酸对BG酶活的影响,结果如图6所示。半胱氨酸、谷氨酸、组氨酸的添加对BG酶活影响较大,其中以谷氨酸的提高为最,其BG酶活在108 h可达22.15 IU/mL。氨基酸的添加可能会影响金属离子与相关蛋白质的结合[17],从而对蛋白质的结构起稳定作用,且氨基酸的加入可能会影响纤维素酶吸附结构域的结构,提高表面有效酶的浓度[18]。

图6 氨基酸添加对BG酶活影响Fig.6 Effect of amino acid addition on β-glycosidase activity
2.5 10 L发酵罐放大实验
根据摇瓶优化,确定最优培养基为:微晶纤维素20 g/L、鱼粉蛋白胨10 g/L、麸皮浸出汁50 g/L、CaCl22 g/L、KH2PO43 g/L、MgSO4·7H2O 3 g/L、谷氨酸1 g/L、PEG-4000 0.2 g/L、Tween 80 200 μL/L、微量元素液1 mL/L,以上培养基进行10 L发酵罐直接放大实验。同等条件下摇瓶发酵作为对照,比较发酵过程中BG酶活和残糖的变化。如图7(b)所示,0~3.5 h溶氧基本维持在95%左右,pH在4.3附近,这段时间菌体生长较为缓慢;4 h后溶氧和pH均快速下降,8.5 h溶氧下降到20.8%,9.5 h下降到9.85%,pH值下降到3.6,且还原糖快速下降,说明菌体在这段时间消耗糖类物质大量生长繁殖,其中产生的酸性物质使pH值下降;之后溶氧开始逐渐上升,13.5 h上升到18.72%,20.5 h溶氧为31%,期间pH值也略微上升,可能是产生的某些酸性物质被菌体生长所利用,40 h后pH值基本维持在4.2左右。直接进行放大实验,BG酶活在72 h达到峰值27.15 IU/mL,同批次摇瓶发酵BG酶活在108 h达到峰值22.86 IU/mL。与摇瓶发酵相比,上罐发酵的酶活提高并不显著,可能是因为发酵过程中的溶氧和pH值不合适所致[19]。不控制溶氧情况下中间有接近4 h溶氧低于10%,溶氧过低可能会产生对酶活造成严重影响的代谢物质,同时在过低的pH值条件下,BG酶活较不稳定,这些因素可能导致BG酶活偏低。
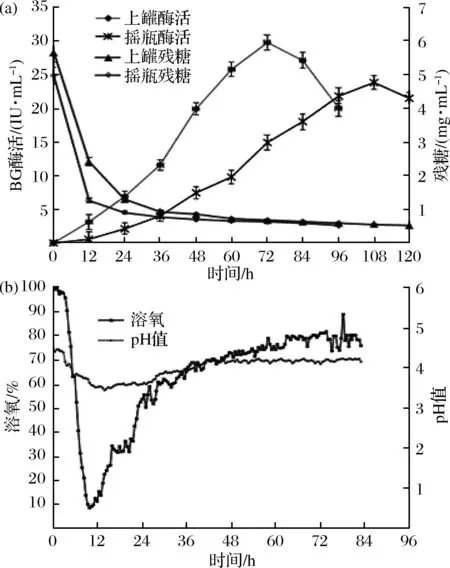
a-残糖和BG酶活曲线;b-上罐过程中溶氧和pH值变化曲线图7 摇瓶发酵与上罐发酵比较Fig.7 Comparison of fermentation process in shake flask and 10 L tank
在此基础上,发酵过程中控制溶氧在30%左右,pH值控制在4.8左右,同时考虑到发酵后期发酵液中还原糖含量仅有0.5 mg/mL,因此在发酵24 h后通过往发酵液中补充质量分数为20%的淀粉水解液并控制其补料速率,使残糖含量维持在1.2 mg/mL左右。其结果如图8所示,BG酶活在84 h达到峰值41.62 IU/mL,与未调控的实验组相比酶活提高了53.3%。

a-残糖和BG酶活曲线;b-上罐过程中溶氧和pH值变化曲线图8 最优条件下10L发酵罐放大实验Fig.8 Fermentation tank amplification culture under optimum conditions
3 讨论
本论文所使用出发菌株匍枝根霉诱变株TZ-03的BG酶活较原菌提高了1.52倍。诱变后bgl4基因的转录水平较初始提高90.19%,转录水平的提高可导致蛋白表达量的提高,很可能引起BG酶活的提高。对BGL和BGL IV的结构功能研究时发现,诱变后活性中心发生构象变化,一定程度上解决了原中心存在的受力不均、底物堆积等问题,可能对酶活的提高也有一定的促进作用。这些发现可为后续对BG结构功能改造及纤维素酶系组成优化提供一定的思路。为进一步提高BG酶活,对摇瓶发酵培养基组分、10 L发酵罐发酵参数进行优化,最终使BG酶活在84 h可达峰值41.62 IU/mL,为BG的工业化应用奠定了一定的基础。本文对诱变后BG酶活差异内因进行初步分析并通过发酵优化提高了BG酶活,为后续对BG的研究提供一定的方向。

