乳酸菌性质与抑制变异链球菌生物膜能力的相关性分析
姚沛琳,徐礼生,苏博,高贵珍
(宿州学院 生物与食品工程学院,安徽 宿州,234000)
龋病是发病率高、流行范围广的口腔疾病。微生物是龋病发生的最主要因素,其中变异链球菌是公认的致龋菌,原理是在牙面定植并形成牙菌斑生物膜[1]。牙菌斑生物膜是细菌在口腔中生存、代谢、致病的微生态环境,以生物膜状态存在的细菌的生理特性与浮游状态有显著的不同,主要表现在抗药性和各种生化代谢效率均显著高于浮游状态下的细菌[2-3]。
目前控制龋病的方法主要有机械法[4]和药物法[5],但它们都有明显的不足之处。以益生菌为主的细菌替代疗法越来越受到关注。主要集中于探讨益生菌与口腔微生物相互作用的生物化学性质,如生长抑制、细菌素的产生、共聚能力、生物膜的形成、胞外多糖的产生、对牙齿硬组织的黏附等[6]。筛选能够预防龋病的益生菌也是基于上述理论基础。NASE等[7]给1~6岁的儿童持续7个月服用含有益生菌的牛乳,发现能显著降低口腔中变形链球菌和酵母菌的数量,蛀牙的发生率也明显下降。AHOLA等[8]在研究短期食用含有LactobacillusrhamnosusGG和L.rhamnosusLC 705益生菌奶酪时,也发现益生菌可以减少口腔中龋齿病原菌的数量。TANZER等[9]研究发现,副干酪乳杆菌DSMZ16671与12株致龋性变异链球菌均有共聚能力,但与口腔中其他非致龋性的链球菌共聚能力较低,并对灭活后的副干酪乳杆菌DSMZ16671进行了动物实验,实验组动物龋齿的发生率与对照组相比降低了23%。同时发现副干酪乳杆菌DSMZ16671对唾液包被的羟基磷灰石的黏附能力极低,间接表明应用在口腔中的乳酸菌应该具有低黏附性能。KANG等[10]发现,来源于儿童唾液的2株食寇魏斯氏菌CMS1和CMS3能够显著抑制变异链球菌生物膜的形成,并且它们合成的水溶性葡聚糖也能够抑制变异链球菌生物膜的形成。TAHMOURESPOUR等[11]发现,发酵乳杆菌产生的表面活性剂能够抑制变异链球菌生物膜的形成,主要是由于该表面活性剂能够抑制生物膜状态下变异链球菌葡糖基转移酶gifB/C的基因表达,从而减少水溶性和水不溶性葡聚糖的合成。
变异链球菌在口腔中形成生物膜是导致龋齿的第一步,因此在筛选对龋病有预防作用的乳酸菌方面,越来越多的研究者利用生物膜模型进行筛选,但是在筛选标准方面,更多的是根据乳酸菌的某一种性质,并没做全面考虑,因此有必要确定比较全面的筛选标准来指导筛选工作。
1 材料方法
1.1 实验菌株
变异链球菌(Streptococcusmutans)ATCC25175,中国微生物所菌种保藏中心。
乳酸菌来源:从唾液、泡菜、健康成人粪便、内蒙古奶酪、苋菜梗卤汁等处分离。
1.2 设备及试剂
SX-300高压灭菌锅,TOMY公司; GRP-9160隔水式恒温培养箱,上海森信实验仪器有限公司;5415R和5804R冷冻离心机,Eppendorf公司;MΜLTISKAN GO酶标仪,Thermo公司;LSM 710激光共聚焦显微镜,德国蔡司公司;DG250厌氧培养箱,华粤行仪器有限公司。
MRS培养基,TSB培养基购于青岛海博生物技术有限公司。
主要试剂:溶菌酶、PI染料,Sigma公司;CFSE荧光染料,Invitrogen公司;醋酸氯己定溶液(商品名:洗必泰),北京麦迪海药业有限责任公司。
1.3 乳酸菌对变异链球菌的抑菌性实验
采用牛津杯琼脂扩散法[12]。将活化3代的乳酸菌接种到MRS液体培养基,37 ℃培养20 h,在4 ℃和12 000 r/min下离心20 min,取上清液,调pH值至4.0,经0.22 μm微孔滤膜后,收集滤液得到乳酸菌无细胞发酵上清液。取0.1 mL的1×108CFU/mL的S.mutans菌悬液与TSB固体培养基混合均匀,倒入内径一致且水平放置的培养皿中,凝固后用镊子将无菌的牛津杯(内径为6 mm)轻轻、均匀地放置在培养皿中。取0.2 mL乳酸菌无细胞发酵上清液加入到牛津杯中,将此平板正面静置于37 ℃培养48 h,测量抑菌圈大小。选取MRS液体培养基(pH值调整为4.0)作为阴性对照,醋酸氯己定溶液作为阳性对照。
1.4 乳酸菌对变异链球菌生物膜形成的影响
乳酸菌与S.mutans均过夜培养12 h,分别接种于37 ℃预热的新鲜MRS和TSB培养基中,37 ℃,厌氧培养18 h,然后调节菌浓度约为1×105CFU/mL。在直径6 cm的玻璃培养皿中放入18 mm×18 mm规格的无菌盖玻片,在0 h时加入S.mutans菌悬液1 mL、乳酸菌菌悬液0.2 mL和含有质量浓度为2.5 g/L蔗糖的TSB培养基3 mL ,37 ℃厌氧培养24 h。取出玻璃片,PBS冲洗2次,去除表面浮游细菌,立即于室温下暗箱中染色[13]。用荧光染料CFSE和PI分别对活菌和死菌进行染色。在37℃下孵育30 min,避光,最后用PBS洗涤,除去残留染料。将上述已完成荧光染料的变异链球菌生物膜标本放置在CLSM下观察[14]。生物膜中细菌量的变化和生物膜活性分别用细菌总面积减少率和活菌百分比表示:即细菌总面积减少率/%=(实验组-对照组)/对照组×100,生物膜活性/%=生物膜中活菌面积/生物膜中细菌总面积×100。阴性对照组和阳性对照组分别加入等量的生理盐水和醋酸氯己定溶液。每组3个以上平行样品,重复2次实验。
1.5 乳酸菌菌体性质与抑制效果关系的分析
1.5.1 乳酸菌的自聚集能力与抑制效果关系的研究
乳酸菌活化培养后,取一定量的菌液,3 000 r/min离心15 min,弃上清,收集菌体,用pH值为7.0的PBS洗涤2次,重悬浮于PBS中,调OD600=0.6±0.05,菌浓度约为107~108CFU/mL,37 ℃静置培养,测定不同时间下上层液体的OD600吸光值[15]。其中A0代表0 h的吸光值;At代表th的吸光值。

1.5.2 乳酸菌自身生物膜形成能力与抑制效果关系的研究
参照KHAN等[13]的方法,具体如下:乳酸菌过夜培养,接种于37 ℃预热的含有质量浓度为2.5 g/L蔗糖的改良TSB培养基中,厌氧培养18 h,调节菌浓度为1×105CFU/mL,然后取0.2 mL菌悬液加入到96孔板中。37 ℃培养24 h,弃游离细菌,每孔用0.2 mL的去离子水轻柔洗涤3次;自然干燥后每孔加入0.05 mL 10 g/L的结晶紫溶液,室温下染色15 min,使结合的细菌着色;倾去染色液后,用去离子水洗涤3次以上;干燥后每孔加入0.2 mL乙醇/丙酮混合液显色,酶标仪600 nm测定吸光度。以相同条件下S.mutans生物膜形成能力为对照组,各实验组每次做3个以上平行,重复3次。
1.5.3 乳酸菌和浮游的变异链球菌的共聚能力与抑制效果关系的研究
乳酸菌和S.mutans均过夜培养12 h,然后各取一定量的菌液,3 000 r/min离心15min,弃上清,收集菌体,用pH值为7.0的PBS洗涤2次,重悬浮于PBS中,乳酸菌调节为OD600=0.6±0.05,S.mutans调节为OD600=0.5±0.05,此时这2株菌的浓度均约为107~108CFU/mL。等量的乳酸菌和S.mutans混合,充分振荡2 min,37 ℃静置培养,测定不同时间下上层液体的OD600吸光值。其中Ax为0 h乳酸菌的吸光值,Ay为0 h变异链球菌的吸光值,Amix为th后混合的吸光值[15]。

1.5.4 乳酸菌表面疏水性与抑制效果关系的研究
乳酸菌表面疏水性的测定参考SAMOT等[16]的方法并稍有改变。以二甲苯作为疏水性有机溶剂。乳酸菌菌体在5 000 r/min的转速下,离心15 min,洗涤2次,重悬于0.1 mol/L KNO3(pH值为6.2)中,在600 nm下调吸光度为0.6,记为A0;将1 mL有机溶剂加入到3 mL菌液中,在室温下先预培养10 min,之后振荡2 min,再在室温下培养20 min,吸取并测水相在600 nm下的吸光度,记为A1。

1.5.5 乳酸菌表面酸碱电荷与抑制效果关系的研究
选择乙酸乙酯作为路易斯碱,氯仿作为路易斯酸,按照1.5.4的方法测定。
2 结果
2.1 乳酸菌的抑菌性与抑制变异链球菌生物膜间相关性分析
根据前期抑菌实验的研究结果,随机选择抑菌效果有差异,来源不同的乳酸菌,通过比较各实验组生物膜中细菌总面积较对照组的减少率来判断不同的乳酸菌抑制变异链球菌生物膜形成的效果。由图1可见,乳酸菌的抑菌性与其对变异链球菌生物膜形成的抑制效果间并不呈正相关关系,相反如RS4、RS7、17A这些抑菌效果表现差的菌株,其对生物膜形成的抑制效果表现较好;如PC-M8、LGG、La-137这些抑菌效果表现好的菌株,其对生物膜形成的抑制效果表现较差。

图1 乳酸菌抑菌性与其抑制生物膜形成效果间的相关性Fig.1 The relation between LAB antibacterial activity and inhibiting biofilm formation ability
在变异链球菌生物膜形成阶段,乳酸菌与变异链球菌的相互作用比较复杂,乳酸菌可能会产生抑制,也可能与变异链球菌发生共聚,共聚体可能一起黏附在固体表面,此种情况会加速有害生物膜的形成;也可能不黏附在固体表面,而是排出体外,这种是最理想的情况,图1显示乳酸菌对变异链球菌生物膜的抑制能力并不会随着对变异链球菌抑菌能力的增强而增强,进一步揭示了变异链球菌生物膜形成的复杂性。
2.2 乳酸菌的菌体性质与抑制变异链球菌生物膜间相关性分析
2.2.1 乳酸菌的自聚集能力与抑制效果关系的分析
为了方便分析乳酸菌的菌体性质与抑制效果之间的关系,根据2.1所示,分别从好、中、差3个水平中随机选取了10株(即RS4、FB-T9、LY-103、WT-143、YH-145、PC-T4、La-137、PC-M8、La、LGG)对S.mutans生物膜形成影响有差异的乳酸菌来研究。结果如图2所示。
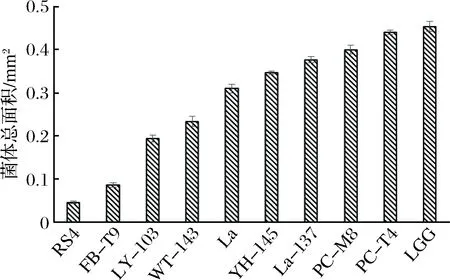
图2 乳酸菌对变异链球菌生物膜形成的影响Fig.2 Effect of LAB on S. mutans biofilm formation
本实验测定了各乳酸菌在37 ℃下第2小时和第4小时的自聚集能力,从图3可以看出,大部分乳酸菌都表现出较强的自聚能力,并且均随着时间的增加而增加。结合抑制生物膜的效果(见图2),可以看出,除了RS4这株菌外,自聚集能力较强的其他菌株,如PC-M8,PC-T4,LGG,La3137等在抑制变异链球菌生物膜形成能力上,效果均较差。
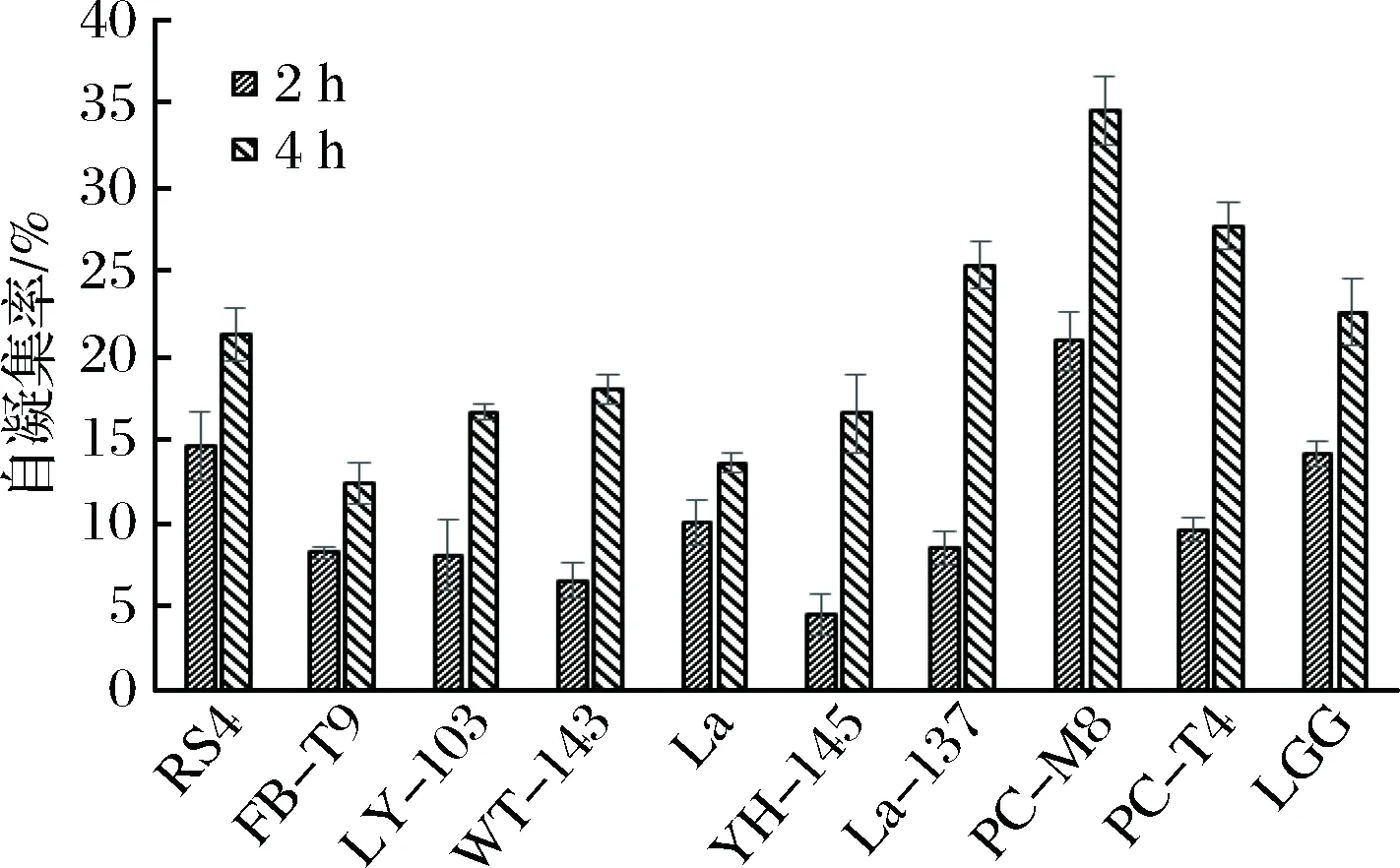
图3 乳酸菌的自聚能力Fig.3 Auto-aggregation ability of LAB
2.2.2 乳酸菌自身生物膜形成能力与抑制效果关系的分析
结合抑制生物膜的结果(见图2)与乳酸菌自身生物膜形成能力(见图4)的结果,可以看出,RS4、FB-T9、LY-103、WT-143和La自身生物膜形成能力较低,其抑制S.mutans生物膜形成效果也较好,同样,YH-145、PC-T4、PC-M8、LGG和La-137自身生物膜形成能力较强,其抑制S.mutans生物膜形成效果也较差。说明乳酸菌自身生物膜形成能力与抑制S.mutans生物膜形成效果之间呈负相关,即自身生物膜形成能力越小,抑制S.mutans生物膜形成效果越好。

图4 乳酸菌自身生物膜形成能力的评价Fig.4 The ability of LAB biofilm formation
2.2.3 乳酸菌和浮游的变异链球菌的共聚能力与抑制效果关系的分析
从图5可以看出,实验中所用到的10株乳酸菌均与浮游的S.mutans有一定的交互凝集能力,并且随着时间的增加而增加。在2 h时彼此之间的差距不是很大,但4 h时差距开始拉大。结合抑制生物膜的效果(见图2)可以看出,除了RS4这株菌外,其他菌株基本上表现出共聚能力强,抑制效果差的特点。出现这种现象的原因有可能是RS4在与浮游的S.mutans共聚时,掩盖了S.mutans与固体介质的黏附位点,其自身又不易黏附在固体介质上,所以可以携带S.mutans一起排出口腔。

图5 乳酸菌与变异链球菌的共聚集情况Fig.5 Co-aggregation of LAB and S. mutans
2.2.4 乳酸菌的表面性质与抑制效果关系的分析
从图6可以看出,这10株乳酸菌的疏水性差别较大,在5%~70%间浮动。然而结合抑制生物膜的效果(见图2)发现,乳酸菌的表面疏水性与抑制效果之间并不具有规律性。这个研究结果与SAMOT等[16]的并不相符合,他们研究发现13株能够在羟基磷灰石片上形成生物膜的乳酸菌,其中有10株具有较低的表面疏水性(0~35%),并把这一性质作为筛选口腔益生菌的标准之一。而本研究的观点是具有预防龋病潜力的乳酸菌应该具有较低的生物膜形成能力,较高的疏水性,这样可以确保乳酸菌不在牙齿表面大量聚集,同时可以保证一定数量的乳酸菌黏附在口腔粘膜上发挥作用。结合乳酸菌自身生物膜形成能力的结果(见图4),同样可以发现RS4这株乳酸菌更符合该要求。

图6 乳酸菌的表面疏水性分析Fig.6 The surface hydroxyapatite of LAB
从图7可以看出,这10株乳酸菌的表面酸电荷差别较大,在16%~70%之间浮动。而表面碱电荷普遍较低,多数在10%以下,只有RS4较高,达到了67%。
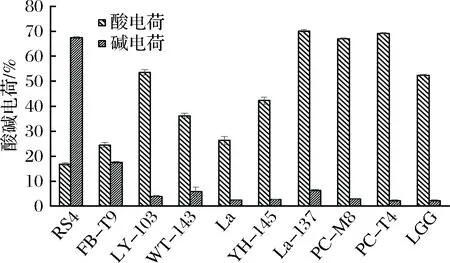
图7 乳酸菌的表面酸碱电荷Fig.7 The surface acid-base charge of LAB
结合抑制生物膜的效果(见图2),可以看出,像RS4、FB-T9、WT-143、La这些有着较低的酸电荷和较高的碱电荷的菌株,它们与变异链球菌相互作用时,能够抑制变异链球菌生物膜的形成。与之相对的,PC-M8、PC-T4、LGG、La-137有着较高的酸电荷和较低的碱电荷,它们与变异链球菌相互作用时,能够促进更加紧密的生物膜结构的形成。因此可以得出的相关性规律是较高的酸电荷和较低的碱电荷有助于抑制效果的发挥。
3 讨论
之前多是单纯研究乳酸菌对非生物膜状态下的变异链球菌的抑制作用,评价指标也较单一,即抑菌效果好的乳酸菌就被认为有预防龋病的潜力[17]。但是龋齿的发生与致龋性牙菌斑生物膜有着密切的关系,抑菌效果好的乳酸菌是否也会对处在生物膜状态下的变异链球菌有同样的作用效果,目前还没有相关的报道。本实验的研究表明乳酸菌的抑菌性与其抑制变异链球菌生物膜间没有相关性,更没有之前推测的正相关关系。
对于有预防龋病潜力的乳酸菌,一方面希望它具有较高的自聚集能力,这样有助于其自身在复杂的口腔环境中快速的生存与繁殖;另一方面不希望其以生物膜形式黏附在牙齿表面,因为它们产生的乳酸可能会腐蚀牙釉质,进而对牙齿造成不利影响[18]。本实验的研究结果表明,除了RS4这株菌外,自聚能力与抑制生物膜效果之间呈负相关。从抑制生物膜的效果上来看,RS4和FB-T9这2株乳酸菌均具有潜在的预防龋病功效,但是RS4表现出较强的自聚集能力,而FB-T9的自聚集能力较弱,说明RS4与FB-T9相比,在口腔中更易生存并且具有快速繁殖的优势。
乳酸菌与浮游的变异链球菌发生交互凝集后,可能有两种结果,一种结果是聚集体不黏附在牙齿上,随着吞咽、清洁等动作排出口腔;另外一种结果是聚集体黏附在牙齿上,加速了菌斑生物膜的形成[19]。本实验的研究结果表明,除了RS4这株菌外,共聚能力与抑制生物膜效果之间呈负相关。
结合乳酸菌自身生物膜形成能力的结果(见图2~4)可知,自身生物膜形成能力高的菌体,如果同时具有较高的自聚集能力和较高的共聚能力,则会表现出促进变异链球菌生物膜形成的结果。反之,自身生物膜形成能力低的菌株,如果在与变异链球菌共聚时能掩盖变异链球菌与固体介质的黏附位点,此时较高的自聚集能力和较高的共聚能力就能够协助乳酸菌抑制变异链球菌生物膜的形成。因此在筛选对变异链球菌生物膜形成具有抑制作用的乳酸菌时,其自身生物膜形成能力是首先考虑的因素之一。
具有预防龋病功效的乳酸菌,不仅要对牙齿表面有着较低的黏附率,还需在口腔中保持一定的数量,防止其被唾液冲刷吞咽,即要对口腔黏膜具有一定的黏附性[20-21]。菌体对黏膜系统的黏附有2种方式,一种是特异性黏附,另外一种是非特异性黏附[22-23]。特异性黏附是通过特异的黏附因子起作用的,而非特异性黏附主要是通过疏水、氢键和静电等发挥作用的,其中疏水作用和静电作用起着主要作用[24]。根据上述结果发现RS4这株乳酸菌表面疏水性较高,表面电荷也较多,因此其由疏水相互作用和静电相互作用的粘膜黏附能力比较强,可能会对口腔内颊面、舌背等具有较好的黏附性。
综上分析,所测定的这些菌体性质中乳酸菌自身生物膜形成能力与抑制S.mutans生物膜形成的效果之间呈明显的负相关,而自聚能力和共聚能力与抑制效果的关系受自身生物膜形成能力的影响。因此,乳酸菌自身生物膜形成能力可能在抑制变异链球菌生物膜形成过程中发挥着重要作用,乳酸菌较低的生物膜形成能力可以保证其自身较少参与或不参与变异链球菌生物膜的形成,不会表现出促进作用。表面疏水性与抑制效果无规律性。表面较高的酸电荷和较低的碱电荷有助于抑制效果的发挥,这一性质可能有助于乳酸菌与变异链球菌表面某种黏附位点的结合,从而抑制变异链球菌对固体表面的黏附。因此可以看出,在抑制变异链球菌生物膜形成的过程中,乳酸菌的菌体性质间是综合起作用。本文为筛选具有预防龋病潜力的乳酸菌提供了理论依据。

