TLR4在脓毒症中对调节性T细胞功能活性的影响
黄颖,曹超,王军,寿松涛
(天津医科大学总医院急诊科,天津 300052)
脓毒症指“机体对感染反应失调所引起的危及生命的器官功能障碍”[1]。研究调查显示,脓毒症具有高发病率及高致死率的特点[2],已成为现代危重病急救医学面临的世界性难题。脓毒症发病机制非常复杂,免疫功能紊乱贯穿于脓毒症病理过程的始终,宿主的免疫功能状态在很大程度上决定着炎症反应的预后。Toll样受体4(Toll-like receptors4,TLR4)可特异性识别革兰氏阴性菌表面的内毒素(lipopolysaccharide,LPS),而 LPS 是诱发脓毒症感染主要的致病原。调节性T细胞是一类具有负向免疫调控作用的T细胞亚群,其功能及活性变化影响着脓毒症免疫功能紊乱的预后[3-4],但其作用机制尚不明确。本实验通过盲肠结扎穿孔术这一经典术式复制脓毒症模型,结合Treg在免疫功能障碍中的作用,探讨TLR4在脓毒症中对Treg功能及活性的影响,并探讨其作用机制。
1 材料与方法
1.1 实验动物及分组 雄性健康SPF级C57/BL6小鼠 40只,C57BL/10ScNJNJ(TLR4-/-)小鼠 40 只,6~8 周龄,体质量约(20±2)g,均购于南京大学模式动物研究所,合格证号:scxk(苏)2010-001。小鼠饲养于天津医科大学总医院动物实验室,室温20~25℃,相对湿度40%~50%,正常日光灯照射12 h维持昼夜循环,实验开始前适应性饲养1周,无菌饲料喂养,正常进食,自由饮水。各组别用随机数字表法将小鼠分为Sham组、CLP组、TLR4-/-Sham组、TLR4-/-CLP夜循环,实验开始前适应性饲养1周,无菌饲料喂养,正常进食,自由饮水。各组别用随机数字表法将小鼠分为Sham组、CLP组、TLR4-/-Sham组、TLR4-/-CLP组,各组别20只。
1.2 研究方法
1.2.1 造模 采用盲肠结扎穿孔(cecal ligation puncture,CLP)建立脓毒症模型。腹腔注射1%戊巴比妥钠80 mg/kg麻醉,取腹正中做1 cm切口,切开皮肤、腹肌、腹膜进腹,找到盲肠,将其轻轻拉出腹腔外,在盲肠中部结扎(结扎长度约1~1.5 cm),18G注射器针头贯穿结扎远端,挤出少量肠内容物,以确保穿孔,将处理后的盲肠还纳腹腔,逐层缝合腹壁切口,术后于皮下注射1 mL生理盐水液体复苏,Sham小鼠手术不予环形结扎及针刺穿孔,余与CLP组相同。
1.2.2 检测Treg计数与凋亡率 术后24 h,分离小鼠脾淋巴细胞,加入10 μL Biotin抗体,混匀,4℃预冷孵育10 min,然后加入20 μL抗-Biotin抗体、10 μL CD25-PE抗体混匀,离心洗涤。PBS缓冲液重悬后,加10 μL抗-PE磁珠混匀,4℃避光预冷经分选,收集流出CD4+CD25-Treg细胞,在含有5%CO237℃的孵育箱中孵育24 h后计数,加入Foxp3-FITC抗体(Bioscience)标记,避光孵育30min,流式细胞仪检测CD4+CD25-Treg凋亡。
1.2.3 检测Foxp3mRNA及TLR4mRNA的表达水平 MiniMACS免疫磁性分离系统分选各组CD4+CD25+Treg细胞,按Trizol试剂盒(美国Promega公司)操作说明,采用Trizol法提取总RNA并扩增,反转录(美国Promega公司)合成cDNA。采用荧光定量PCR仪进行PCR扩增。PCR反应条件:95℃预变性 1 min,95℃变性 15 s,60℃退火/延伸 40 s,共40个循环。Foxp3上游引物:5′-CAGCTGCCTACA GTGCCCTAG-3′;下游引物:5′-CATTTGCCAGCAGT GGGTAG-3′;TLR4 上游引物:5′-TTTCACCTCTGC CTTCACTA-3′;下游引物:5′-AGATACACCAACGGC TCTGAAT-3′。分光光度仪检测Foxp3mRNA及TLR4mRNA的表达水平。PCR引物购于伯研合众(天津)生物医药科技有限公司。
1.2.4 检测Treg细胞的Foxp3、TLR4蛋白活性的表达 分离各组小鼠Treg,收集细胞,用预冷的PBS洗涤细胞,100 μL PBS重悬细胞,加入Anti-MouseCD152/CTLA-4-FITC 10 μL,4℃避光孵育后流式细胞仪检测;用同样的方法收集、洗涤、重悬Treg细胞。按Foxp3试剂盒操作说明将细胞破膜剂稀释4倍,每106细胞加入固定/穿透工作溶液1 mL重悬,4℃避光孵育2h。破膜缓冲液洗1~2次,之后将细胞悬浮于200μLPBS中通过流式细胞仪检测。
1.2.5 Western Blot检测 Treg 细胞内 NF-κB、p-NF-κB的水平 分离各组小鼠Treg,收集细胞,用预冷的PBS洗涤细胞,按照操作说明(Well-bio,上海)提取蛋白,转膜后用5%脱脂牛奶封闭,按说明书推荐比例稀释抗体NF-κB、p-NF-κB,在4℃下过夜。用TBST洗膜后用辣根过氧化物酶孵育抗体(1:6 000,Bio-Rad,美国)。用增强化学发光(ECL)(日本Millipore)对膜上的带密度进行了扫描和分析。
1.3 统计学方法 采用SPSS22.0统计学软件进行数据分析,各组标准化的样本数值用x±s,两组间比较采用独立样本t检验,以P<0.05或P<0.01为差异有统计学意义。
2 结果
2.1 Treg计数及凋亡率变化 由表1可见,与Sham组相比,WT CLP组及TLR4-/-CLP组Treg数量均增多(P<0.05),但两组中WT CLP组增多更明显(P<0.05)。与Sham组相比,WTCLP组Treg细胞凋亡率明显下降(P<0.05),而TLR4-/-CLP组较WTCLP组 Treg凋亡率升高(P<0.05)。

表1 各组小鼠脾脏Treg计数及凋亡率Tab 1 Treg count and apoptosis rate in each group
2.2 Foxp3mRNA及TLR4mRNA的表达水平 由图1可见,与WT Sham组相比,WT CLP组小鼠Treg细胞内Foxp3mRNA及TLR4mRNA表达水平明显升高(P<0.05)。与 TLR4-/-Sham 组相比,TLR4-/-CLP 组Foxp3mRNA及TLR4mRNA表达水平无明显变化(P>0.05)。与 WTCLP 组相比,TLR4-/-CLP 组小鼠Foxp3mRNA及TLR4mRNA水平则显著降低(P<0.05)。
2.3 Treg细胞Foxp3、TLR4蛋白表达水平 如图2所示,与WT Sham组相比,WTCLP组Treg细胞Foxp3及TLR4表达量明显增加(P<0.05)。与TLR4-/-Sham组相比,TLR4-/-CLP组Foxp3及TLR4的表达无明显差异(P>0.05)。与WTCLP 组相比,TLR4-/-CLP组Foxp3及TLR4表达量显著减少(P<0.05)。
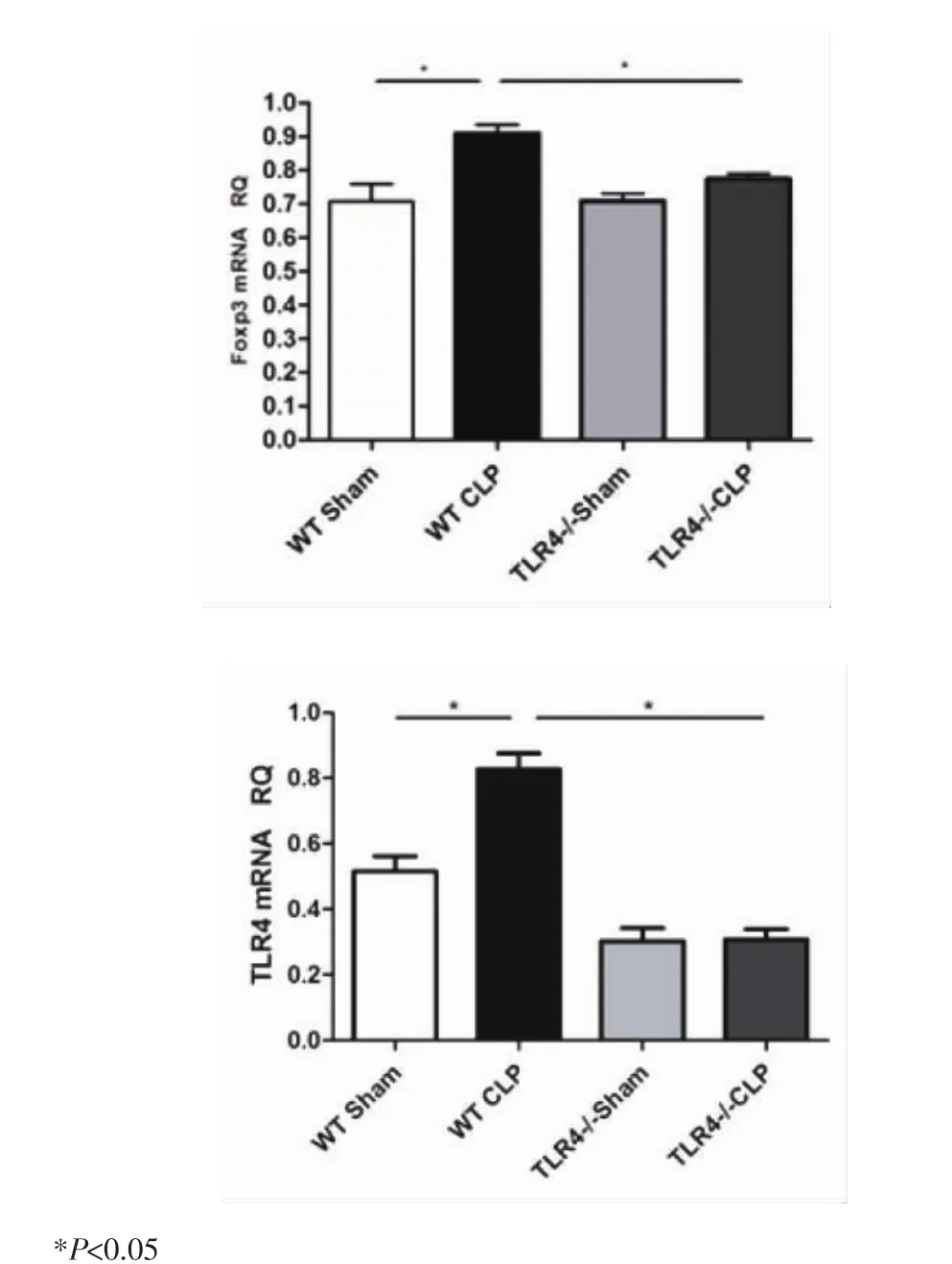
图1 各组小鼠Treg细胞内Foxp3mRNA及TLR4mRNA的表达水平Fig1 The expression of Foxp3mRNA and TLR4mRNA in Treg of each group

图2 各组小鼠Treg细胞Foxp3、TLR4蛋白活性的表达水平Fig 2 TheexpressionofFoxp3andTLR4proteininTregofeachgroup
2.4 Treg细胞内 NF-κB、p-NF-κB水平 如图 3所示,与WT Sham相比,WT CLP组小鼠脾脏的Treg细胞内NF-κB和p-NF-κB表达量显著升高(P<0.05),与 TLR4-/-Sham 组,TLR4-/-CLP 组 NF-κB和 p-NF-κB 表达量较稍升高(P<0.05)。而 TLR4-/-CLP组与WT CLP组比较,Treg细胞内NF-κB和p-NF-κB 表达量明显降低(P<0.05)。

图3 各组小鼠Treg细胞内p-NF-κB、NF-κB蛋白的表达水平Fig 3 The expression of p-NF-κB andNF-κB protein in Treg of each group
3 讨论
脓毒症是严重创伤、烧伤、休克、大手术和感染后的严重并发症之一,其病情进展可诱发脓毒症休克和多器官功能衰竭,是ICU常见的致死原因[5-6]。在脓毒症发病机制中,早期常表现为过度炎症反应,随即机体进入持续的免疫抑制状态,过度的炎症反应促使机体出现严重的免疫功能障碍,甚至出现免疫麻痹[7],而因免疫麻痹导致的感染并发症成为脓毒症患者临床死亡的主要原因[8-9]。本实验采用盲肠结扎穿孔复制脓毒症模型,与人类脓毒症特点相似,具有较高的相关性[10]。
TLR4属于Toll样受体家族,在多种类型的细胞均可得到表达,是天然免疫系统识别病原微生物的主要受体,不仅可特异性识别革兰氏阴性菌表面的内毒素(lipopolysaccharide,LPS),还能识别类脂A、热休克蛋白60(HSP60)、真菌表面的多聚体(GXM)。我们在研究中发现,CLP术后24 h,野生型小鼠脾Treg细胞中TLR4表达显著升高,且TregFoxp3mRNA及其蛋白表达亦明显升高,但Treg自身凋亡率显著减少,提示此时Treg功能及活性显著增强。而TLR4-/-鼠中,Treg自身凋亡率及Foxp3表达(mRNA和蛋白)未见显著变化,这表明脓毒症状态下Treg功能及活性的变化与TLR4表达密切相关,这与Yang[11]及Huss[12]等的研究结果一致。
本研究进一步对作用机制进行了初步探讨。TLR4作为LPS的受体,在脓毒症时两者结合,通过MyD88依赖途径和MyD88非依赖途径通过激活NF-κB[13-19]。NF-κB在几乎所有类型细胞中均存在表达。有研究表明,在脓毒症时,阻断TLR4/NF-κB信号通路炎症因子水平下降[20-21]。结果表明,CLP后24 h,在野生型鼠中Treg细胞中NF-κB和p-NF-κB表达显著升高,而TLR4-/-时蛋白表达未见显著变化,这提示脓毒症时Treg细胞功能及活性的变化与TLR4/NF-κB信号通路密切相关,但具体分子机制仍有待于进一步研究。在我们的实验结果中还发现,TLR4-/-CLP 组 Treg细胞 NF-κB、p-NF-κB 蛋白表达量较TLR4-/-Sham组轻度增加,此结果可能与脓毒症病理过程复杂,多条信号通路参与其发生发展过程有关,拟下一步对该结果进行研究分析。
脓毒症病理机制极其复杂,涉及多条信号通路及多种作用机制,本研究仅探讨其中一条信号通路,且对象为动物模型,尚需进一步研究探索后应用于临床治疗,本研究旨在为临床治疗脓毒症提供新的方向与理论依据。

