连续中毒剂量维生素D3对大鼠肾组织结构的影响※
维生素D3(Vitamin D3, VD3)的经典生物学作用是调节钙磷平衡,维持骨骼健康[1]。VD3中毒常因使用不当,或在治疗佝偻病过程中反复大量使用VD3所致[2]。肾脏是 VD3代谢的重要器官,有学者指出VD3是预测多种慢性肾脏疾病进展的独立危险因素[3]。肾损伤是不可逆转的,组织病理切片和超微结构变化是揭示机体病理变化机制的重要手段之一,长期使用小剂量VD3时对肾小球组织结构的影响以增生为主[4]。中毒剂量 VD3造成肾损伤的研究报道较少。本研究通过观察肾组织病理切片和超微结构变化,探讨VD3对肾脏产生毒性的剂量,及不同剂量VD3对大鼠肾组织结构的影响程度,为研究VD3造成肾毒性的作用机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康 SD大鼠,雄雌各半,体重150~170 g,SPF级,购自河北医科大学实验动物中心,实验动物生产许可证号:SCXK(冀)2008-1-003。饲养于山西省医药与生命科学研究院药理研究室屏障动物房,实验动物使用许可证号:SCXK(晋)2010-0005,适应性饲养1周后使用。
1.1.2 药品与试剂 VD3注射液(上海通用药业股份有限公司,批号:20170106,规格:7.5 mg:1 ml/支);甲醛(上海沪试实验室器材股份有限公司,批号:20160523);无水乙醇(优级纯GR);0.9%氯化钠注射液(山东华鲁制药有限公司,批号:20170815)。另使用电子天平(北京赛多利斯仪器系统有限公司,型号:BT2202S)、病理切片机(德国徕卡,批号:TS6016+CV6030型)、光学显微镜Olympas HB-2。
1.2 方法
1.2.1 实验分组 将40只健康SD大鼠随机分为空白对照组(0 IU/kg)、VD3小剂量组(1875 IU/kg)、VD3中剂量组(3750 IU/kg)、VD3大剂量组(7500 IU/kg)、VD3超大剂量组(15 000 IU/kg),每组8只。
1.2.2 VD3配制 采用玉米油对维生素D3注射液进行等量递增稀释,分别配成所需浓度应用,每天在实验前新鲜配制。
1.2.3 给药方式、剂量和疗程 采用常规灌胃方式给药,给药体积为0.5 ml/100 g,每天1次,连续3周。
1.3 观察肾组织变化
1.3.1 大鼠肾组织病理学变化 采血后放血处死大鼠,剪开腹腔并取肾组织块于10%甲醛内固定,24 h后换液,48 h后取材做石蜡包埋,做成4 μm厚切片,HE染色行光镜检查,观察肾小球、肾小管上皮细胞形态结构并拍照记录。
1.3.2 大鼠肾组织超微结构变化 取出单侧肾置于培养皿中,滴入4%戊二醛磷酸缓冲液(pH7.2~7.4)充分浸润,用双面刀片将肾皮质部位组织修成小块(1 mm3大小);吸取样本放入加有4%戊二醛磷酸缓冲液(pH 7.3)小瓶内固定,标记后放入4℃冰箱中保存。标本固定24 h后采用0.1 mol/L磷酸缓冲液漂洗后,于4℃冰箱内梯度乙醇脱水,50%乙醇、70%乙醇、90%乙醇各15 min,再至90%乙醇和90%丙酮混合液脱水15 min,90%丙酮脱水15 min,再在100%丙酮室温下脱水15 min,重复3次。采用环氧树脂618包埋,做1 μm厚半薄切片,行甲苯胺蓝染色,光学显微镜下定位,LKB-l型超薄切片机(瑞典Leica)切片,切片厚度为50 am,采用枸橼酸铅和醋酸双氧铀染色。日本日立H-7500 透射电子显微镜下观察肾小球基底膜及足细胞足突形态学变化并拍照记录。
2 结果
2.1 VD3对各组大鼠肾组织病理学的影响 HE染色结果显示:与空白对照组相比,VD3各剂量组肾小管上皮组织细胞均发生了不同程度变化,主要表现为近曲肾小管上皮细胞肿胀、变性,以大剂量组最明显。见图1。
2.2 VD3对大鼠肾组织超微结构的影响 组织学电镜超微结构检测观察显示:空白对照组足突、基膜和毛细血管内皮细胞、窗孔结构无明显异常,毛细血管管腔内透明;小剂量组基膜厚薄不均,毛细血管管腔内不透明,布满颗粒状物;中剂量组基膜增厚,毛细血管管腔内出现吞饮小泡;大剂量组足突部分融合,基膜增厚改变典型,内皮细胞分界不清;超大剂量组足细胞的足突和基膜、内皮细胞分界不清,融合在一起,两侧完整,出现内皮吞饮小泡,毛细血管管腔内有两个大小不等的圆形均质体,细胞器结构清晰。见图2。

图1 肾组织病理学改变(HE 400X)
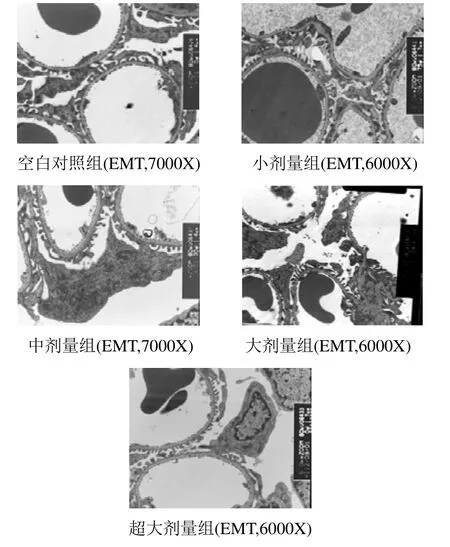
图2 VD3对大鼠肾组织超微结构的影响
3 讨论
随着对 VD3研究的不断深入,其临床应用范围不断扩大,而 VD3的合理摄入量和安全性等问题需引起临床高度重视。VD3摄入剂量过大、应用时间过长均可导致中毒。VD3在体内需经过两次羟化后才能发挥其生物活性,第一次羟化在肝脏内,生成25-OH-D3,然后通过氧化反应,最终生成水溶性VD3-23羧酸,随尿液排出[5];当机体摄入并蓄积过量VD3时,体内VD3自反馈调节作用失调,可导致血钙升高[6],进而出现一系列继发症状,临床上严重的高钙血症可能影响肾脏、胃肠道、肌肉骨骼系统、眼睛和皮肤[7]。
目前,我国儿童(0~14岁)血清25-OH-D3水平正常参考值范围为37.5~250.0 nmoL/L[8];有研究[9-10]报道,11例患者,每人平均误食VD3为1308 IU,均出现临床中毒症状,血钙均增高至3.57~4.43 mmol/L,9例出现急性肾损伤,8例为急性肾功能衰竭。本研究中 VD3小剂量组(1875 IU/kg)、VD3中剂量组(3750 IU/kg)、VD3大剂量组(7500 IU/kg)、VD3超大剂量组(15 000 IU/kg),4组给药剂量经换算均高于临床正常使用剂量,并大于引起肾损伤的剂量,故给药后大鼠均可能会出现高钙血症。
本研究组织病理学检测显示:VD3各剂量组大鼠肾小管与空白对照组比较均发生了明显变化,主要表现为近曲小管上皮细胞肿胀、变性,管腔变小,出现管型等变化,偶见间质增生,中性粒细胞、巨噬细胞等炎症细胞浸润等,以大剂量组最明显。提示使用VD3后造成的肾损伤主要以近曲肾小管上皮细胞损伤为主,以 7500 IU/kg剂量时最明显。此现象是否与VD3主要是在肾小管上皮细胞转化为1,25-(OH)2D3有关,有待进一步深入研究确证。
组织学电镜超微结构检测示:空白对照组大鼠肾小球组织结构清晰、完整。VD3各剂量组大鼠用药3周后肾小球超微结构均发生了明显变化,小剂量组基膜厚薄不均,毛细血管管腔内不透明,布满颗粒状物;中剂量组基膜增厚,毛细血管管腔内出现吞饮小泡;大剂量组足突部分融合,基膜增厚改变典型,内皮细胞分界不清;超大剂量组足细胞的足突和基膜、内皮细胞分界不清,融合在一起,两侧完整,出现内皮吞饮小泡,毛细血管管腔内有两个大小不等的圆形均质体,细胞器结构清晰。表明中毒剂量VD3可造成肾小球毛细细胞内皮细胞、基膜、足细胞这三个主要过滤屏障系统超微结构发生明显变化,破坏肾小球滤过功能,滤过功能发生异常,可能是其造成肾脏毒性的另一主要原因。虽然,电镜显示各剂量组超微结构特征有一定区别,但这种区别不能说明对肾脏的毒性改变呈剂量相关性,再增大剂量会不会导致更显著变化,需进一步研究。因为药物效应的强弱与其剂量大小并非简单的线性相关关系,剂量-反应关系可表现为S形曲线,直线、双曲线等。结合组织病理学检查结果推断,VD3对肾脏的毒性可以引起肾小管和肾小球功能损伤。
综上所述,7500 IU/kg中毒剂量VD3可造成实验大鼠明显毒性反应,是建立实验大鼠中毒模型的推荐剂量。

