异体淋巴细胞和自体淋巴细胞序贯局部注射对小鼠肝癌移植瘤的治疗作用
徐 兵 黄素钦 吴林岚 魏建威 杨晓梅 赵芝萍 陈 怡 蒋晓织
已知注射异体淋巴细胞(Heterogeneic lymphocyte,HL)可诱发荷瘤受者产生移植物抗肿瘤效应(GVTE)和宿主抗肿瘤效应(HVTE)等免疫反应[1-3]。但由于注射的HL会被受者免疫系统破坏,且HL会引发移植物抗宿主反应(GVHE),使得GVTE临床应用受限。目前报道的对策主要是减少HL对宿主的损害(比如清除反应性T细胞,用60Co照射降低供者HL活力[9],用丝裂霉素灭活供者HL[10]),或诱导受者产生免疫耐受[4-8]。本文借鉴常用的血管外动物免疫方式,先将HL注射移植到受者荷瘤组织局部,激活受者自体淋巴细胞(Autogeneic lymphocyte,AL)免疫反应,然后采集受者被激活的AL回输到荷瘤组织局部,发挥自身免疫抗肿瘤功能。本研究初步证明了本法的可行性和有效性,现介绍如下。
1 材料与方法
1.1 实验动物和主要器材
用CB6F1(BABL/c×C57BL/6,H-2d/b)小鼠作受体鼠(受鼠),用CC3HF1(BABL/c×C3H,H-2d/k)小鼠作供体鼠(供鼠)。供鼠与受鼠均为雌性,10周龄,淋巴细胞H-2为半相合;供鼠与受鼠均购自北京维通利华实验动物技术公司(动物合格证号SCXK(京)2006-009)。Hepa 1-6肝癌细胞株(H-2b)购自中国科学院细胞库。猪凝血酶和纤维蛋白胶注射装置购自广州倍绣生物技术公司。
1.2 荷瘤受鼠的制备
将Hepa 1-6细胞解冻复苏后,用DMEM完全培养液(含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素)在37℃、5%CO2条件下培养,隔日换液,每3 d传代1次。取对数生长期的Hepa 1-6细胞用无血清DMEM培养液配成4×106/mL细胞悬液,并取0.1 mL注射到受鼠右腹股沟皮下组织为荷瘤受鼠。接种后6 d全部荷瘤受鼠腹股沟均可触及肿瘤,平均瘤体积约18 mm3,成瘤率100%。而后每隔3 d用游标卡尺测瘤的长径(a)和宽径(b),计算瘤体积(V=ab2/2)。
1.3 HL和AL的制备
取供鼠、受鼠脾分别制备HL、AL(或同组同基因小鼠淋巴细胞)。将小鼠脱颈处死,手术取脾,用PBS洗一次,放于尼龙筛网上,用镊子边梳刮边加入无血清DMEM培养液至3 mL;加入红细胞裂解液(取氯化铵3.73 g、三羟甲基氨基甲烷Tris 1.3 g加水溶解并稀释至500 mL,0.22 μm孔径滤器过滤除菌)溶解红细胞,静止5 min,离心(1 000 rpm/min,10 min)去上清,再以无血清DMEM重悬细胞,同法离心洗涤3次。沉淀用PBS重悬为AL(4 g/L台盼蓝拒染法测细胞活率大于95%)。
1.4 小鼠血浆纤维蛋白胶(FG)组分Ⅰ、Ⅱ的制备
组分Ⅰ(血浆冷沉淀):取20 mL小鼠血浆置-30℃冷冻12 h,然后在4℃解冻6~12 h,4℃下离心(2 000 rpm/min,15 min),吸出上清液,留底部约1 mL沉淀物。组分Ⅱ(酶钙溶液):取500 U猪凝血酶溶于2 mL 40 mmol/L氯化钙溶液。组分Ⅰ和Ⅱ等量混合即为FG。FG与HL或AL的应用组合称为FG-HL或FG-AL。
1.5 FG-HL和FG-AL序贯局部注射疗法
序贯疗法分为前、后两阶段。前阶段给受鼠注射HL为实验组,方法是在接种瘤细胞后3 d,随机取荷瘤受鼠,在右下腹腔靠近移植瘤部位注射FG-HL;对照组用同法注射FG-磷酸盐缓冲液(FG-PBS);而后检测两组受鼠免疫指标变化。后阶段取实验组、对照组受鼠脾淋巴细胞(SL或AL),将FG-AL注射到本组其余受鼠右下腹腔内靠近移植瘤部位。FG-HL或FG-AL要在注射后才形成FG凝胶包埋HL或FG凝胶包埋AL。
实验组方法:取200 μL浓缩血浆与200 μL HL悬液混合(终细胞数24×107),为成分Ⅰ;取390 μL酶钙溶液(含50 U猪凝血酶和20 mg氮卓酮)与10 μL 0.25%胰蛋白酶溶液混匀为成分Ⅱ。在接种瘤细胞后3 d,随机取荷瘤受鼠,将成分I(400 μL)和成分Ⅱ(400 μL)各吸入一注射器,两个注射器终端合用一管道和针头,可同时或分别交替注射,将两种成分混合注射到受鼠右下腹腔局部(每鼠0.1 mL,细胞数3×107)为实验组(n=16)。对照组(n=16)用FG-PBS,在同样部位同法注射。首次注射后5 d、10 d,两组受鼠均分别按上述方法再注射1次。第3次注射后5 d从两组分别随机取8只受鼠,4只用来取脾淋巴细胞组合成FG-AL(同FG-HL组合法,含AL 9×107/0.1 mL),4只用于测免疫功能。将各组的FG-AL分别注射到本组其余8只受鼠右下腹腔局部。两组受鼠均在末次注射后10 d处死,剥出皮下移植瘤,测瘤的长径(a)和与之垂直的宽径(b);计算肿瘤体积(V=ab2/2)和肿瘤生长抑制率(抑瘤率%)(对照组肿瘤体积-实验组肿瘤体积)/对照组肿瘤体积×100%。
1.6 荷瘤受鼠脾淋巴细胞(SL或AL)对肝癌细胞的杀伤实验
在前阶段治疗后3 d,从实验组和对照组分别随机取4只受鼠,制备脾淋巴细胞(效应细胞,E)。将E与Hepa 1-6瘤细胞(靶细胞,T)按不同的E:T(数量比)混合,体外培养。用乳酸脱氢酶(LDH)法测淋巴细胞杀瘤细胞率(杀瘤率)。杀瘤率(%)=[(实验组释放值-靶细胞自发释放值)/(靶细胞最大释放值-靶细胞自发释放值)]×100%。
1.7 用流式细胞术检测荷瘤受鼠脾淋巴细胞亚群
用1.6获取的实验组、对照组受鼠淋巴细胞,按流式细胞法加入FITC-CD8抗体、FITC-CD-49/Pan NK抗体,测两组的CD8+T和NK细胞数量。
1.8 用ELISA法检测荷瘤小鼠血清IL-2、INF-γ浓度
用1.6获取的实验组、对照组受鼠血清,按ELISA试剂盒说明书测两组的血清IL-2、IFN-γ浓度。
1.9 统计学分析
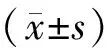
2 结果
2.1 FG-HL注射增强了荷瘤受鼠AL对肝癌细胞杀伤力
前阶段注射FG-HL治疗后,实验组AL的杀瘤细胞率(26.70±7.22)%明显高于对照组的杀瘤细胞率(5.70±2.68)%,差异有统计学意义(P<0.01)(表1)。
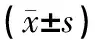
表1 实验组和对照组受鼠的淋巴细胞杀瘤细胞率
2.2 FG-HL注射增加了荷瘤受鼠脾淋巴细胞(SL或AL)、CD8+T细胞和NK细胞数量
前阶段注射FG-HL治疗后,实验组受鼠的SL或AL数(25.60±5.98)、CD8+T细胞数(0.84±0.14)、NK细胞数(0.49±0.09)均明显高于对照组相应值(12.40±2.48、0.55±0.04、0.29±0.05),配对数据比较差异有统计学意义(表2)。

表2 实验组和对照组受鼠脾淋巴细胞、CD8+T细胞、NK细胞数量
Note:Mice in the experiment group were injected with FG-HL on the tumor-bearing tissues.
2.3 FG-HL注射使荷瘤受鼠血清IL-2和INF-γ浓度增高
前阶段注射HL治疗后,实验组受鼠的血清IL-2和IFN-γ浓度明显高于对照组相应值(P<0.01)(表3)。
2.4 荷瘤组织局部序贯注射FG-HL和FG-AL对受鼠肝癌移植瘤的治疗作用
在接种瘤细胞后28 d,经前阶段注射FG-HL和后阶段注射FG-AL治疗(共25 d),受鼠经荷瘤组织局部序贯注射HL和AL治疗(实验组)或注射PBS(对照组)后,移植实验组受鼠的瘤平均体积(1.20±0.33)cm3明显小于对照组瘤平均体积(2.05±0.37)cm3(P<0.01);实验组的抑瘤率为41.5%。
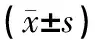


FactorsE(n=8)C(n=8)tPIL-2(pg/mL)28.60±7.438.50±2.717.452<0.01IFN-γ(pg/mL)147.80±34.5914.90±1.5515.80<0.01
Note:Experiment group were injected with FG-HL on the tumor-bearing tissues.
3 讨论
将同种异体淋巴细胞(HL)输入白血病或实体瘤患者(宿主)后,HL既可攻击受者正常细胞(移植物抗宿主反应GVHE)和癌细胞(移植物抗肿瘤反应GVTE),也可激活受者自体淋巴细胞(AL)攻击癌细胞(宿主抗肿瘤反应HVTE)。这种AL抗肿瘤作用特异性强,较安全,是最有希望清除癌细胞的生物疗法。为了减少HL对受者正常细胞的损伤,文献的方法是灭活或部分灭活HL[5-10],但这也会降低HL的免疫刺激作用。本文将活的HL或AL包裹于FG凝胶中,使这两种淋巴细胞能大体定位在所注射部位或瘤灶部位,并吸引AL靠近HL和瘤灶,FG可防止HL和AL在注射部位堆积坏死。由于HL受到FG保护和限制,且FG-HL被注射在血管外;故HL不易被受者免疫清除,HL对受者组织的免疫损伤也主要局限在注射部位。这种血管外接种外来抗原是目前通行的免疫接种法,要比血管内接种的免疫效果更好。
本文疗法分前后两阶段,前阶段用FG-HL激活受者AL免疫反应;后阶段采集被激活的AL组成FG-AL回输到自体(或同基因小鼠)荷瘤组织表面抗肿瘤。为了减少HL对受者的损害(GVHE)并保持受者的免疫敏感性,这两个阶段应交替序贯进行,使HL间歇出现在受者体内,不断激活AL以产生持久的抗肿瘤免疫力。本文所用供、受鼠的主要组织相容性复合物(MHC或H-2)为半相合,使HL较易在受鼠体内存活。这与临床上亲人间移植较接近。同理,Hepa 1-6瘤细胞接种在半相合的CB6F1受鼠身上较易成瘤。市售的纤维蛋白胶已用于临床修复伤口、止血等,浓度小于5 g/L时也可作细胞培养基质骨架[10]。注入体内的纤维蛋白胶一般在14 d左右被降解[11]。淋巴细胞可迁移穿过组织、腹膜[12],故AL可汇集到HL和肿瘤周围,发挥免疫清除和抗肿瘤作用。本文用浓缩人血浆自制纤维蛋白胶代替市售的动物纤维蛋白胶,是为了将来用于人体时避免产生异种蛋白反应。加入的胰蛋白酶可选择性降解变性的蛋白(如FG凝胶)并清除,有利于混合淋巴细胞反应和下一轮注射。月桂氮卓酮是一种透皮促进剂,可增加细胞间和腹膜通透性,便于淋巴细胞穿过。也可将胶原溶液注射到组织腔隙形成凝胶状人工囊腔,引导将HL经皮多次注入人工囊腔,移植到特定部位[13]。
综上所述,本方法要点是将FG-HL注射到受者体内荷瘤组织表面,可局限HL对受者的免疫损害,并用FG-HL募集、激活受者AL,再采集受者被激活的AL组成FG-AL回输到荷瘤组织表面。序贯反复施行本法,可将HL多次用于受者,不断激活AL,并使AL集中在肿瘤局部发挥大体靶向抗瘤作用。

