TRAP1在食管癌发展中的作用及机制研究
于 芳 赵 培
食管癌是常见的恶性肿瘤,地域分布差异显著,我国是食管癌高发地区。根据世界卫生组织最新公布的数据,2012年全球食管癌发病率为6.5/10万,死亡率为5.7/10万,而我国的发病率为22.1/10万,死亡率为16.8/10万,均远高于全球平均水平[1]。食管癌的主要病理类型分为食管鳞状细胞癌(ESCC)和食管腺癌(EAC)。我国90%以上的食管癌患者为ESCC[2]。近年来,尽管食管癌的早期诊断和治疗技术等方面都取得了很大进步,但其预后仍然较差,我国食管癌的五年生存率仅为20%[3]。因此,研究食管癌进展的机制,寻找食管癌新的诊治靶点具有重要意义。肿瘤坏死因子受体相关蛋白1(Tumor necrosis factor receptor-associated proteinⅠ,TRAP1)是线粒体热休克蛋白90家族(Hsp90)的重要成员。TRAP1家族蛋白的主要作用是抗氧化和抗凋亡,能够保持客体蛋白(如Cyclophilin D和Sorcin)的稳定性,避免细胞的氧化损伤以及凋亡。有研究表明,TRAP1在肾癌[4]、前列腺癌[5]、结肠癌[6],卵巢癌[7]等多种恶性肿瘤中表达异常,能够通过调节细胞形态,促进细胞增殖和转移等方式发挥作用。TRAP1也被证明在食管癌组织中过表达并与预后差相关[8]。在本研究中,我们将进一步探讨TRAP1在食管癌发展中的作用及其机制。
1 材料与方法
1.1 标本收集
所有病例均来自河北省人民医院诊治的食管癌患者,在经过患者同意,不影响病理诊断的前提下,从手术切除部分取下1 g左右癌组织和癌旁组织,癌旁组织为距离癌组织边缘大于5 cm的组织,并经病理切片证实无癌变。所有患者术前均未进行放化疗。
1.2 免疫组化
所有标本经过福尔马林溶液固定,石蜡包埋,4 μm连续切片,脱蜡等步骤。免疫组化染色采用SP法,具体操作按说明书进行。阳性细胞百分比计分标准为:5%以下计0分,5%~25%计1分,25%~50%计2分,50%~75%计3分,75%以上计4分。阳性细胞染色强度计分标准为:无色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。两项计分乘积作为最终结果:0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(++),6分以上为强阳性(+++),以≥2分计为阳性表达。
1.3 细胞培养
食管癌细胞系ECa109、TE1购自中国科学院上海细胞库,食管癌细胞系KYSE150、KYSE180购自广州吉妮欧生物科技有限公司。下调TRAP1病毒液购自上海吉凯基因化学技术有限公司,siRNA序列为A:GCA UCA AUG AUU GUG GAU GCA UCA AUU CC,B:CGU AGU UAC UAA CUC CUA CGU AGU UCC GG。食管癌细胞系ECa109、TE1、KYSE150和KYSE180用RPMI1640培养基加10%胎牛血清,37℃,5% CO2培养。选择TRAP1相对表达水平最高的KYSE150细胞系,构建TRAP1稳定低表达细胞系KYSE150-TRAP1及其对照组细胞系KYSE150-control。
1.4 qRT-PCR实验
用Trizol法提取细胞总RNA,用实时荧光定量PCR试剂盒行qRT-PCR。反应条件为:55℃ 30 min,95℃ 2 min,60℃ 20 s,35个循环,65℃ 30 s。qRT-PCR试剂盒购自Thermo公司,采用7500 Real Time PCR系统。qRT-PCR用于检测ECa109、TE1、KYSE150、KYSE180四种细胞系中TRAP1的表达水平,以及KYSE150-TRAP1和KYSE150-control细胞系中E-Cadherin、N-Cadherin、S100A8等下游基因的表达水平。
1.5 CCK-8法检测细胞增殖能力
分别用对数生长期的KYSE150-TRAP1和KYSE150-control细胞铺96孔板,24 h后用10 μL CCK-8试剂加入100 μL培养基中,于37℃,5% CO2培养2 h,在酶标仪下检测450 nm下的OD值,比较KYSE150-TRAP1和KYSE150-control细胞的增殖能力。
1.6 Transwell法检测细胞转移能力
培养细胞,分别用对数生长期的KYSE150-TRAP1和KYSE150-control细胞,以5×105/mL细胞接种于Transwell小室,于37℃,5% CO2培养24 h后取出小室,用1%多聚甲醛固定,显微镜下观察,计数,比较KYSE150-TRAP1和KYSE150-control细胞的转移能力。
1.7 统计方法
数据运用SPSS 21.0软件进行统计学分析,计量资料服从正态分布时采用均数±标准差描述,差异的比较采用t检验,不符合正态分布时采用中位数和四分位数间距进行描述,差异的比较采用秩和检验,计数资料的比较采用χ2检验或配对χ2检验,实验均重复三次,P<0.05为差异有统计学意义。
2 结果
2.1 TRAP1在食管癌组织中的表达情况
在60例癌组织中,有33例TRAP1蛋白表达阳性,阳性表达率为55.0%;在60例癌旁组织中,有7例TRAP1蛋白表达阳性,阳性表达率为11.7%,TRAP1在癌组织和癌旁组织中阳性表达率差异无统计学意义(P>0.05)(图1,表1)。
2.2 S100A8在食管癌组织中的表达情况
在60例癌组织中,有37例S100A8蛋白表达阳性,阳性表达率为61.7%;在60例癌旁组织中,有6例S100A8蛋白表达阳性,阳性表达率为10.0%,S100A8在癌组织和癌旁组织中阳性表达率差异有统计学意义(P<0.05)(图1,表1)。
2.3 TRAP1与S100A8在食管癌中表达水平的相关性
卡方检验分析TRAP1与S100A8表达水平的相关性,结果显示:TRAP1在食管癌组织中表达阳性与S100A8表达阳性具有一致性(χ2=4.141,P<0.001)(表2)。

表1 TRAP1和S100A8在食管癌及癌旁组织中的表达

表2 食管癌组织中TRAP1和S100A8阳性表达的关系
2.4 TRAP1对细胞增殖、凋亡和转移能力的影响
首先检测TRAP1在4个食管癌细胞系中的表达水平,以ECa109中TRAP1的表达水平为标准1,TE1、KYSE150和KYSE180中TRAP1相对表达水平分别为1.18±0.01、1.82±0.01和1.49±0.02,选择相对表达水平最高的KYSE150进行后续实验(图2A)。用慢病毒感染KYSE150细胞,得到TRAP1表达稳定下调的食管癌细胞系KYSE150-TRAP1及其对照组细胞系KYSE150-control。验证TRAP1下调水平,结果显示,以TRAP1在KYSE150-control中的表达水平为标准,KYSE150-TRAP1中TRAP1的mRNA表达下调85%(P<0.05),蛋白表达下调78%(P<0.05),TRAP1在KYSE150-TRAP1细胞系中表达显著下调,细胞系构建成功(图2B-C)。
KYSE150-TRAP1和KYSE150-control细胞的增殖能力和凋亡率均无统计学差异(P>0.05);KYSE150-TRAP1细胞的转移能力显著弱于KYSE150-control(P<0.05),与KYSE150-control相比,KYSE150-TRAP1细胞的转移能力下降46%(图2D-E)。
2.5 TRAP1调控的信号通路
与KYSE150-control相比,KYSE150-TRAP1中TRAP1表达下调(P<0.05),N-Cadherin的表达水平改变无统计学差异(P>0.05);E-Cadherin的表达水平显著升高(P<0.05);S100A8的表达水平显著下降(P<0.05)(图3)。

图1 TRAP1和S100A8蛋白在食管组织中的表达情况Figure 1 Expression of TRAP1 and S100A8 proteins in esophageal tissuesNote:A.The expression of TRAP1 in adjacent tissues;B.The expression of TRAP1 in cancer tissues;C.The expression of S100A8 in adjacent tissues;D.The expression of S100A8 in cancer tissues.

图3 TRAP1、E-Cadherin、N-Cadherin、S100A8在KYSE150-TRAP1和KYSE150-control细胞中的相对表达水平Figure 3 Relative expression levels of TRAP1,E-Cadherin,N-Cadherin and S100A8 in KYSE150-TRAP1 and KYSE150-control cellsNote:* P<0.05,when compared with the KYSE150-control cells.
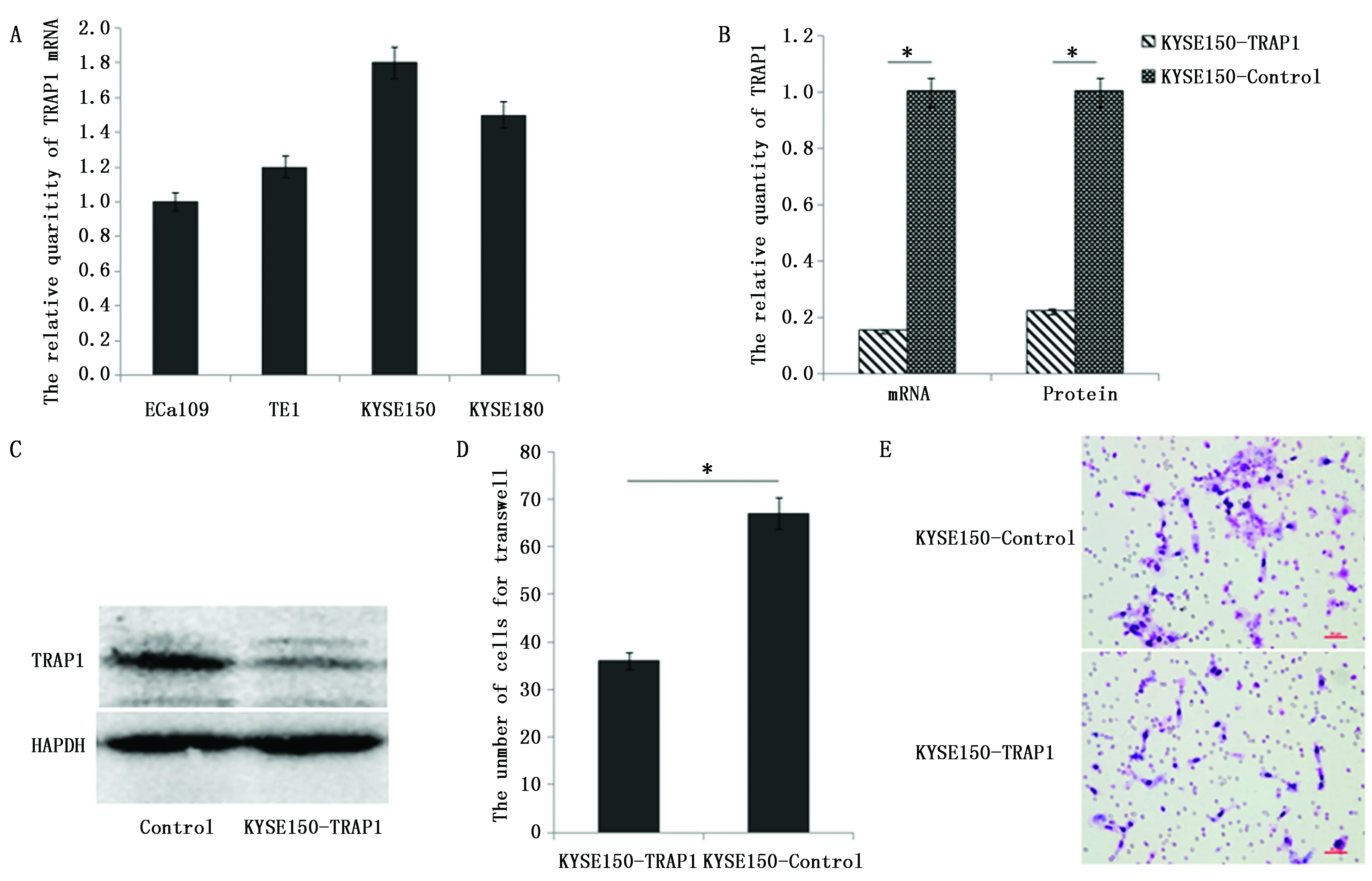
图2 在食管癌细胞系中下调TRAP1的表达水平能够降低细胞的转移能力Figure 2 Down-regulated TRAP1 reduced the invaded ability in esophageal cancer cellsNote:A.TRAP1 was highly expressed in 4 esophageal cancer cell lines;B.The level of TRAP1 expression was down-regulated in KYSE150-TRAP1 cells;C.The expression of TRAP1 and GAPDH protein in KYSE150 cells;D and E.The invaded ability of KYSE150-TRAP1 and KYSE150-control cells.
3 讨论
TRAP1是HSP90家族的重要成员,TRAP1蛋白是由645个氨基酸构成,能够通过ATP结合区域与ATP结合来发挥作用[9]。TRAP1家族蛋白主要在线粒体内膜上表达[10-12],客户蛋白(Client proteins)是调控线粒体凋亡的重要因子[13-14],TRAP1能够通过阻止变性的客户蛋白解折叠和促进其重折叠来维持线粒体的结构完整,从而调控线粒体凋亡通路。研究证明,TRAP1在多种癌症中表达异常并发挥致癌作用[15-16]。TRAP1也被证明在食管癌组织中过表达,且其过表达与食管癌进展相关[8],但其在食管癌进展中发挥的作用及其机制尚不清楚。为了进一步探讨TRAP1在食管癌发展中的作用及机制,本研究利用慢病毒介导的RNAi技术,下调TRAP1在食管癌细胞系中的表达水平,通过检测TRAP1下调后细胞功能及相关基因表达的变化来确定TRAP1在食管癌中的作用及机制。我们通过在食管癌细胞系KYSE150中下调TRAP1的表达发现,亲代细胞系和TRAP1下调后细胞的凋亡率均在5%以下,可认为未产生明显细胞凋亡,所以我们认为TRAP1下调对凋亡无影响。TRAP1下调后细胞的转移能力显著减弱,说明TRAP1过表达与食管癌的转移相关,而转移是影响预后的重要因素,这也能够解释TRAP1表达阳性的患者预后差的部分原因。
食管癌的转移是一个连续的过程,包括细胞黏附改变、细胞外基质降解、侵入邻近组织、播散至远端组织、新生血管生成等多个阶段。上皮间质转化(Epithelial to mesenchymal transition,EMT)是细胞黏附改变的重要过程,包括癌细胞间的黏附降低,使癌细胞发生转移,扩散到身体其他部位,形成新的转移灶。EMT过程受到多种基因通路的调控,主要包括上皮细胞标志物E-cadherin的表达下调,间质细胞相关标志物N-cadherin表达上调等[17]。另外,大量研究证明[18-20],食管癌的进展需要炎性反应微环境,长期的慢性炎症可刺激肿瘤释放许多促进癌症进展的因子。Taccioli等[18-19]的研究证明了食管发生炎症时S100A8表达升高能够促进食管癌的进展。而Li等[20]的研究则证明了S100A8表达升高可通过E-cadherin促进EMT过程。为了明确TRAP1过表达促进食管癌转移的机制,我们检测了EMT相关蛋白E-Cadherin、N-Cadherin以及炎性因子S100A8的表达水平,发现TRAP1表达下调,E-Cadherin的表达水平升高,说明在TRAP1介导的食管癌转移过程中,发生了EMT。而E-Cadherin的表达水平受到炎性因子S100A8的影响,TRAP1表达下调后S100A8的表达水平显著下降,说明TRAP1过表达促进食管癌转移可能是通过调控S100A8实现的,TRAP1过表达导致S100A8表达上调,形成炎性微环境,使多种细胞因子、趋化因子以及其下游的级联反应因子持续刺激,导致食管癌发生转移。

