胃癌组织中miR-320a和CYLD的表达及与临床病理特征及预后的关系
唐淑丽 何匡邦 张纯慧 程佳楠 张艳桥
胃癌是发生于胃黏膜上皮的恶性肿瘤,预后较差,据报道,2012年全球新发胃癌病例约95.1万例,死亡率约76.03%,其中约50%病例主要发生在我国,我国胃癌死亡率约占全球胃癌死亡率的45%[1]。近年来我国胃癌整体发病率呈下降趋势,但由于胃癌早期诊断率较低,多数患者未能及时有效诊疗,胃癌死亡率仍不乐观[2]。因此,发现影响胃癌发生发展的特异性标志物,进行有针对性的干预和调控治疗,对早期预防和治疗胃癌,改善患者预后有重要意义。miR-320a已被证实可通过调控FoxM1-P27~(KIP1)通路等抑制胃癌细胞增殖[3]。头帕肿瘤综合征蛋白(Cylindromatosis,CYLD)是一种肿瘤抑制因子,已证实CYLD表达量下降与肝癌、胰腺癌、甲状腺乳头状癌等多种癌症的发生发展有关[4]。但其在胃癌中的表达作用鲜有报道。因此,本研究分析miR-320a和CYLD在胃癌患者中的表达及与预后的关系,旨在为寻找胃癌治疗新靶点提供理论参考。
1 材料与方法
1.1 研究对象
选择2013年3月—2014年11月在我院确诊为胃癌并择期进行肿瘤组织切除手术的460例患者作为研究对象,其中男280例,女180例,年龄42~67岁,平均年龄(54.83±6.18)岁,根据美国癌症联合委员会与国际抗癌联盟(AJCC/UICC)第七版胃癌TNM分期标准[5]:Ⅰ期108例,Ⅱ期202例,Ⅲ期150例,低分化115例,中分化155例,高分化190例。纳入标准:(1)均符合2010年卫生部发布的《胃癌诊断标准》中胃癌诊断标准[6];(2)经胃镜检查和活组织检查确诊为胃癌;(3)经我院伦理委员会同意,受试者均知情并自愿签署同意书。排除标准:(1)合并其他组织癌变患者;(2)胃癌切除术前进行过免疫治疗,化疗等辅助治疗者;(3)患有心、肝、肾等其他系统疾病者;(4)围手术期死亡或不能接受术后随访患者;(5)临床资料不完整无法评估影响预后相关因素。
1.2 试剂和仪器
TRIzolTMReagent和SYBR®Green实时荧光定PCR试剂盒购自赛默飞世尔科技(中国)有限公司;Quant One Step RT-PCR kit(KR113)购自天根生化科技(北京)有限公司;IHC kit购自Cell Signaling Technology(CST);兔抗人CYLD抗体购自上海抚生实业有限公司。miR-320a上游引物5′-GTTGGATCCGGCGTTTCCTTCCGACATG-3′,下游引物5′-GCTGAATTCGTCCACTGCGGCTGTTCC-3′,U6上游引物:5′-ATTGGAACGATACAGAGAAGATT-3′,下游引物5′-GGAACGCTTCACGAATTTC-3′,本研究引物均合成于生工生物工程(上海)股份有限公司。
1.3 方法
1.3.1 组织样本采集 分别采集每例患者肿瘤组织,置于冰上,用冷生理盐水冲洗干净,分别留取黄豆大小的肿瘤组织两部分,一部分放入4%甲醛中固定,用于免疫组织化学染色,一部分在冰上研磨后用于提取RNA。另在距离肿瘤边缘5 cm外采集癌旁非肿瘤胃粘膜组织,同上分两部分保存。
1.3.2 荧光定量PCR 取研磨后的肿瘤组织和癌旁非肿瘤组织,采用TRIzolTM Reagent提取组织RNA,采用Quant One Step RT-PCR kit反转录后,以U6为内参,实时荧光定量PCR分别检测miR-320a相对表达量和CYLD mRNA相对表达量。以2-△△Ct法计算组织中miR-320a和CYLD mRNA相对表达量。
1.3.3 免疫组织化学染色 取经甲醛固定后的肿瘤组织和癌旁非肿瘤组织,制作石蜡切片,采用IHC kit进行免疫组织化学染色,一抗为兔抗人CYLD抗体,以PBS代替一抗作为阴性对照,分别检测CYLD蛋白表达量,以组织中出现黄棕色颗粒为CYLD阳性表达。400倍视野下,随机观察5个区域,并进行细胞计数,结合阳性细胞比例评分和染色强度评分评估CYLD蛋白在肿瘤组织和非肿瘤组织中的表达水平,其中阳性细胞比例评分为0~3分:无阳性细胞记0分,阳性细胞比例小于10%记1分,小于50%记2分,大于50%记3分;染色强度评分为0~3分:细胞无染色记0分,染色为淡黄色表示弱阳性记1分,染色为黄棕色表示阳性记2分,染色为棕色表示强阳性记3分。两项评分之积为切片免疫活性分数,以总分≥4分为阳性表达(+),<4分为阴性表达(-)。
1.4 随访
入组患者均获随访3年,随访期间定期复查CT、MRI等,统计患者总生存率(即从手术开始至死亡的时间),计算中位生存期。
1.5 统计学分析
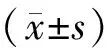
2 结果
2.1 miR-320a、CYLD mRNA和CYLD蛋白表达水平
肿瘤组织中miR-320a的相对表达量(0.37±0.09)低于癌旁非肿瘤组织(0.86±0.15),肿瘤组织中CYLD mRNA的相对表达量(0.91±0.23)也低于癌旁非肿瘤组织(1.56±0.42),差异均有统计学意义(t=60.078,29.113,P<0.001);CYLD蛋白在肿瘤组织胞质中少量表达,胞核中几乎不表达,阳性表达率43.48%,而在癌旁非肿瘤组织胞质和胞核中均有不同程度表达,阳性表达率73.91%,CYLD在肿瘤组织中阳性表达率低于癌旁非肿瘤组织,差异有统计学意义(χ2=8.788,P=0.003)(表1-表2、图1-图2)。

表1 肿瘤组织与癌旁非肿瘤组织间miR-320a和CYLD mRNA相对表达量比较

表2 肿瘤组织与癌旁非肿瘤组织间CYLD蛋白表达水平比较

图1 miR-320a和CYLD mRNA在胃癌及癌旁非肿瘤组织中的相对表达量Figure 1 The relative expression of miR-320a and CYLD at level of mRNA in gastric cancer and non-tumor tissues.Note:*P<0.05,when compared to the non-tumor tissues.

图2 CYLD蛋白在胃癌及癌旁非肿瘤组织中的表达Figure 2 The expression of CYLD protein in gastric cancer and non-tumor tissuesNote:A.The expression of CYLD protein in tumor tissues;B.The expression of CYLD protein in non-tumor tissues.
2.2 miR-320a 和CYLD表达水平与胃癌患者临床病理特征的关系
miR-320a在肿瘤组织中的表达量以所有患者相对表达量的中位数为界分为高表达和低表达,miR-320a表达量与患者性别、年龄、TNM分期和肿瘤分化程度无关(χ2=1.142,0.131,0.794,2.346,P>0.05),而肿瘤直径>1 cm患者中miR-320a高表达与肿瘤直径≤1 cm患者比较,差异具有统计学意义(χ2=25.859,P=0.000),淋巴结转移患者中miR-320a高表达与淋巴结未转移患者比较,差异具有统计学意义(χ2=13.742,P=0.000);CYLD阳性表达与患者性别、年龄、肿瘤直径、淋巴结是否转移无关(χ2=0.156,1.558,0.044,1.113,P>0.05),而TNM分期Ⅰ~Ⅱ患者CYLD阳性表达率与Ⅱ~Ⅲ期患者比较,差异具有统计学意义(χ2=37.725,P<0.001),肿瘤中低分化患者CYLD阳性表达率与肿瘤高分化患者比较,差异具有统计学意义(χ2=59.323,P<0.001)(表3)。
表3miR-320a和CYLD表达水平与胃癌患者临床病理特征的关系
Table3Relationship between miR-320a and CYLD expression and clinicopathological characteristics in patients with gastric cancer

ParameternmiR-320a expressionHighLowχ2PCYLD+-χ2PSex1.1420.2850.1560.693Female180801009189Male280140140135145Age(years)0.1310.7171.5580.212≥54250128122126124<542101129811991TNM staging0.7940.37337.725<0.001Ⅰ~Ⅱ310148162183127Ⅲ150797142108Tumor diameter25.859<0.0010.0440.834>1cm11031794961≤1cm350198152162188Degree of tumor differentiation2.3460.12659.3230.000Milled-low differentiation27012714388182High differentiation1901048613258Lymph node metastasis13.7420.0001.1130.292Yes1706210868102No290159131132158
2.3 miR-320a和CYLD表达水平与患者预后的关系
460例患者术后随访3年,367例患者死于胃癌,3年总死亡率79.78%,剩余93例患者幸存。miR-320a低表达患者中位生存期(20.36±0.56)(95%CI:19.252~21.462)与miR-320a高表达患者中位生存期(28.29±0.58)(95%CI:27.158~29.412)比较,差异具有统计学意义(χ2=87.967,P<0.001);CYLD阴性表达患者中位生存期(17.70±0.56)(95%CI:16.599~18.796)与CYLD阳性表达患者中位生存期(26.74±0.64)(95%CI:25.474~27.997)比较,差异具有统计学意义(χ2=109.887,P<0.001);miR-320a和CYLD共表达患者中位生存期(29.01±0.77)(95%CI:26.831~28.946)与非共表达患者中位生存期(17.13±0.61)(95%CI:17.214~19.568)比较,差异具有统计学意义(χ2=117.680,P<0.001)(表4,图3-图5)。

图3 miR-320a高表达与低表达患者间生存曲线比较Figure 3 Survival curves of patients with a high or low expression of miR-320a by Kaplan-Meier analysis

图4 CYLD阳性表达与阴性表达患者间生存曲线比较Figure 4 Survival curves of patients with a positive or negative expression of CYLD by Kaplan-Meier analysis

图5 miR-320a和CYLD共表达与非共表达患者患者间生存曲线比较Figure 5 Survival curves of patients with or without co-expressed miR-320a and CYLD
2.4 miR-320a和CYLD mRNA表达相关性分析
肿瘤组织miR-320a与CYLD mRNA表达水平呈正相关(r=0.607,P<0.001)(图6)。

图6 miR-320a与CYLD mRNA表达水平相关性分析Figure 6 Correlating analysis between the expression miR-320a and CYLD at level of mRNA
2.5 影响胃癌患者预后的COX多因素回归分析
以性别、年龄、TNM分期、肿瘤直径、肿瘤分化程度、淋巴结转移、miR-320a表达水平及CYLD表达水平为自变量,进行COX多因素回归分析,结果证实,miR-320a低表达、CYLD阴性表达、TNM分期、淋巴结转移及肿瘤分化程度是影响胃癌患者预后的独立危险因素(表5)。

表5 影响胃癌患者术后3年总生存率相关因素的COX回归分析
3 讨论
越来越多的研究证实,miRNA在肿瘤生物学中发挥着调控基因表达的重要作用[7]。在胃癌中已发现多种miRNAs与患者病情发生发展密切相关,如miRNA-223在胃癌组织中表达量降低,miRNA-223与Sp1基因的3′-UTR结合,抑制Sp1基因表达,从而调节上皮-间质转化(EMT),调节癌细胞增殖和侵袭。EMT在各种癌细胞的转移和侵袭过程中发挥重要作用,近年来研究表明,波形蛋白是EMT的典型标志物,波形蛋白在发展性胃癌组织中表达量明显增加,与肿瘤进展及淋巴结转移密切相关[8]。Lv等研究表明,miR320a通过调节STAT3信号途径,抑制肺腺癌细胞转移和增殖[9]。另有研究证实,miR-320a在多种癌症中有多种靶向基因,如在腺样囊性癌和膀胱癌,miR-320a通过靶向ITGB3抑制癌细胞转移和侵袭[10-11]。说明miR-320a可通过多种途径调控肿瘤的发生及发展过程。本研究结果显示,胃癌组织中miR-320a相对表达量明显低于非肿瘤组织,与前人研究结果一致,进一步分析发现,miR-320a表达量在肿瘤不同大小,淋巴结是否转移患者中表现出明显差异,且miR-320a低表达患者3年死亡率明显高于miR-320a高表达患者,说明miR-320a低表达与胃癌细胞增殖和迁移有关,影响患者预后。Ying等对胃癌组织进行miRNAs微阵列芯片分析显示miR-320a表达量显著降低,对其作用靶基因分析表明,波形蛋白和泛素化蛋白酶14是miR-320a的靶基因,过表达miR-320a能够抑制波形蛋白和泛素化蛋白酶14对胃癌细胞恶化的促进作用,提示miR-320a具有抑制胃癌细胞增殖,迁移和侵袭作用[12]。
CYLD是一种去泛素化酶,可通过去泛素化影响TGF-β,NF-kB等多条信号通路,调控癌细胞凋亡,发挥抑癌作用。Kinoshita等研究表明,CYLD在肝癌组织中显著低表达,通过负调节NF-kB,促进TGF-β,加重患者病情,且CYLD低表达的肝癌患者总生存率明显低于CYLD高表达患者,提示CYLD与肝癌发展有临床相关性[13]。姜维民等研究表明,CYLD在胰腺癌组织中表达下调,与患者肿瘤分期和分化程度有关[14]。本研究结果显示,CYLD mRNA在胃癌组织中表达量明显降低,CYLD蛋白在非肿瘤组织胞质和胞核中都有表达,但在胃癌组织中表达明显减少,只在胞质中观察到少量表达,进一步分析表明,CYLD表达与患者TNM分期,肿瘤分化程度相关,与姜维民等在胰腺癌中的研究结果相似,KM生存函数分析表明,CYLD阴性表达患者3年死亡率明显高于CYLD阳性表达患者,说明CYLD与患者预后有关。CYLD参与肿瘤发展的分子机制研究表明,CYLD可通过阻断JNK/AP1信号通路,调控表皮肿瘤的发生及发展[15]。其在胃癌中的作用机制有待进一步深入探究。Li等研究表明,在甲状腺乳头状癌中,抑制miR-181b表达能够上调CYLD蛋白水平,起到抑制癌细胞生长,促进癌细胞凋亡作用[16]。Sun等研究表明,miR-130b在胃癌组织中显著上调,CYLD是miR-130b的潜在靶基因,高表达的miR-130b可通过调节CYLD蛋白水平发挥增强癌细胞增殖,抑制癌细胞凋亡作用[17]。Yan等[18]研究表明,在胃癌中,CYLD是miR-425-5p的直接靶点,miR-425-5p表达上调与CYLD表达水平呈负相关关系。本研究相关性分析发现,miRNA320a表达水平与CYLD mRNA表达水平呈正相关关系,且两者共表达患者3年死亡率显著低于非共表达患者,因此可推测胃癌中miRNA-320a可能正调控CYLD表达,通过过表达miRNA-320a可能促进CYLD mRNA表达,抑制胃癌患者病情发展。多因素回归分析表明,miR-320a低表达、CYLD阴性表达、TNM分期、淋巴结转移及肿瘤分化程度是影响胃癌患者预后的独立危险因素,提示miR-320a和CYLD不仅与胃癌患者临床病理特征相关,也影响患者预后,可作为早期诊断,治疗及预测患者预后的标志物。
综上所述,胃癌组织中miR-320a和CYLD低表达与患者病情发展有关,检测miR-320a和CYLD表达量有助于早期诊断及预测患者预后,同时基于miR-320a和CYLD在肿瘤中发挥重要作用,二者可能成为肿瘤治疗的新靶点。但miR-320a和CYLD在胃癌中的作用机制,miR-320a和CYLD在胃癌中是否存在相互作用,有待进一步研究证实。

