冠突散囊菌与茶叶生物碱共培养液态发酵体系的构建及特性
黄浩,郑红发,赵熙,钟妮,,余鹏辉,,黄建安,刘仲华
(1.湖南省农业科学院茶叶研究所,湖南长沙 410125)(2.湖南农业大学茶学教育部重点实验室,湖南长沙410128)(3.国家植物功能成分利用工程技术研究中心,湖南长沙 410128)
茯茶中的优势真菌-冠突散囊菌[1~3],俗称“金花”菌,一直被视作衡量茯茶品质的重要指标。现行研究已从茯茶品质化学[4]与功能成分化学[5~7]角度证实了冠突散囊菌对茯茶的重要性。课题组曾借助人工接种冠突散囊菌至茶叶固体发酵-“散茶发花”技术对不同茶类原料“发花”茯茶加工过程中的水浸出物、茶多酚、儿茶素组分、氨基酸、黄酮类、可溶性糖和可溶性蛋白等茶叶常量成分进行含量检测与分析,并考察加工各阶段微生物及优势真菌的动态变化,其已基本探明茯茶的品质风味形成机理[8,9]。然而,茶是一种较为复杂的基质,其生化成分因产地、品种而异。因此,在特定的载体中加入规定的介质对更进一步研究微生物对茶叶单一生化成分的代谢机制具有重要的意义[10]。王小刚[11]等人用黑曲霉等5种微生物分别接种绿茶和红茶的干茶与茶汤的发酵体系(32 d)来考察咖啡碱的含量变化,结果表明不同生长基质的同种真菌发酵体系对咖啡碱的含量产生较大差异。
本研究在前人研究的基础上,设计已知、固定的培养基作为满足冠突散囊菌生长需要的特定基质,并以高纯度咖啡碱、可可碱和茶碱作为冠突散囊菌液体发酵培养的唯一外源添加底物,考察冠突散囊菌对上述3种单体成分为期10 d的发酵特性,为进一步丰富茯茶品质形成机理提供理论依据。
1 材料与方法
1.1 材料与试剂
“金花”菌-冠突散囊菌(Eurotium cristatum),为本实验室自藏菌株[12],分离自益阳茶厂股份有限公司产茯砖茶(800 g装,产于2007年)。
冠突散囊菌分离、纯化培养基:PDA(马铃薯葡萄糖琼脂培养基)、察氏等固体培养基;种子培养基、发酵培养基:1.0%(m/V)葡萄糖,国药集团化学试剂有限公司;0.1%(m/V)蛋白胨,北京生工生物工程有限公司;0.05%(m/V)柠檬酸,成都市科龙化工试剂厂;2%(V/V)Vogel’s N[13](Vogel,1964)、0.015%(V/V)吐温 80,中国医药上海化学试剂公司;校准pH 5.5。
马铃薯提取物,上海一研生物科技;葡萄糖(食品级),国药集团化学试剂有限公司;琼脂粉,北京振泰生物;咖啡碱(纯度≥99%)、可可碱(纯度≥95%)、茶碱(纯度≥99%)。葡萄糖试剂盒、蛋白质含量检测试剂盒,南京建程生物工程研究所。
1.2 仪器与设备
Delta 320 pH计,Mettler;Motic B1光学显微镜,Motic公司;万分之一电子天平,Mettler AE240;MIKRO-35 高速冷冻离心机,德国产;苏净超净工作台,苏净集团安泰公司;振荡式恒温培养箱,上海苏坤实业有限公司;恒温培养箱,江苏环保仪器厂;高温高压灭菌锅,上海医用核子仪器厂;恒温鼓风干燥箱,上海精宏实验设备公司;10 mL一次性注射器,河南曙光健士医疗器械集团有限公司;0.22 µm过滤头,Millipore;定量滤纸,杭州特种纸业有限公司;多功能酶标仪,Thermo;96孔板,海门博阳实验器材厂;7.5 cm玻璃漏斗、50 mL三角瓶、隔菌封口膜、10 mL、1.5 mL 离心管、1000 µL、200 µL Tip 头,上海生工生物工程有限公司等。
1.3 实验方法
1.3.1 种子液培养
将预先培养5 d的斜面冠突散囊菌菌种转接于种子培养基(200 mL)中,置振荡培养箱中30 ℃,转速200 r/min条件下培养24 h。
1.3.2 诱导培养与取样
从种子液中吸取4%接种量转接至50 mL发酵培养基中,添加过滤除菌的 Caffeine母液终浓度 0.2 mg/mL(Caffeine组)、可可碱母液终浓度0.08 mg/mL(Theobromine组)、茶碱母液终浓度 0.08 mg/mL(Theophylline组),未添加单体的培养基为Caffeine空白对照(F-wC组)、Theobromine空白对照(F-wTheob组)、Theophylline空白对照组(F-wTheop组),以及设置添加单体但未接种冠突散囊菌的空白对照(C-wF)、(Theob-wF)、(Theop-wF);在温度为28 ℃,转速为160 r/min条件下震荡培养10 d;每24 h取样观察,三组发酵培养液均经过滤处理,得到滤液和菌丝体,测定菌体干重和发酵清液的pH值,剩余葡萄糖含量,总蛋白质含量。
1.3.3 HPLC法分析咖啡碱、可可碱、茶碱在发酵液中的代谢情况
采用HPLC方法来定量分析底物咖啡碱、可可碱、茶碱在发酵过程中的消耗情况,反应液原液稀释至合适倍数后经HPLC进样分析,三种生物碱的定量检测方法采用色谱条件[14,15]:C18柱(4.6×200 mm,5 µm,welchrom),流动相:A:去离子水,B:N, N-二甲基甲酰胺:甲醇:乙酸=40:2:1.5,流速:1 mL/min。进样量:10 μL等条件在278 nm下检测,试验重复六次(n=6),分析并计算结果。
1.3.4 数据统计分析
试验数据采用数学统计分析软件SPSS 19.0进行检验分析,试验重复三次并取 3次重复的平均值。
2 结果与分析
2.1 冠突散囊菌-咖啡碱共培养发酵液中发酵产物含量的变化
HPLC方法对添加咖啡碱的发酵液进行含量检测分析,图1结果显示为期10 d的发酵对发酵液中咖啡碱的含量变化无明显影响,这意味着以发酵液中的咖啡碱不能被冠突散囊菌生长繁殖所直接利用,这可能与咖啡碱较稳定的化学性质相关。
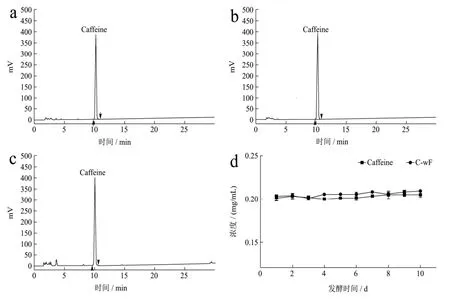
图1 HPLC法检测发酵液中咖啡碱的含量Fig.1 The content of caffeine in the fermentation broth was detected by HPLC
2.2 冠突散囊菌-咖啡碱共培养发酵体系的理化特性
图2结果显示咖啡碱组发酵液的pH值随着发酵时间的增加持续下降,发酵前 6~7 d,咖啡碱组与未加咖啡碱组变化趋势表现出高度一致,当发酵进入第7 d,咖啡碱组pH值下降的幅度逐渐增大直至第9 d趋于稳定,这可能是咖啡碱刺激菌体生长加速菌体代谢出有机酸,同时延缓了菌体自溶,进而导致延缓了发酵液pH值上升。总得来说,咖啡碱组菌体生物量增加并不明显,这可能与咖啡碱的稳定性质而不易被菌体所利用有关。
两组发酵液中剩余葡萄糖含量的变化趋势一致,相比之下,添加咖啡碱的发酵液中葡萄糖的含量下降的更为明显,说明有咖啡碱的存在可能对刺激菌体的生长繁殖存在积极作用,从而加速冠突散囊菌对发酵液中葡萄糖的消耗;二组发酵液总蛋白质含量都随着发酵时间的增加而逐渐升高,而又分别在发酵第8、9 d相继开始下降,一方面冠突散囊菌在发酵培养过程中胞外酶的分泌和积累,另一方面,也可能是由于菌体自溶导致胞内蛋白等大分子物质快速降解。
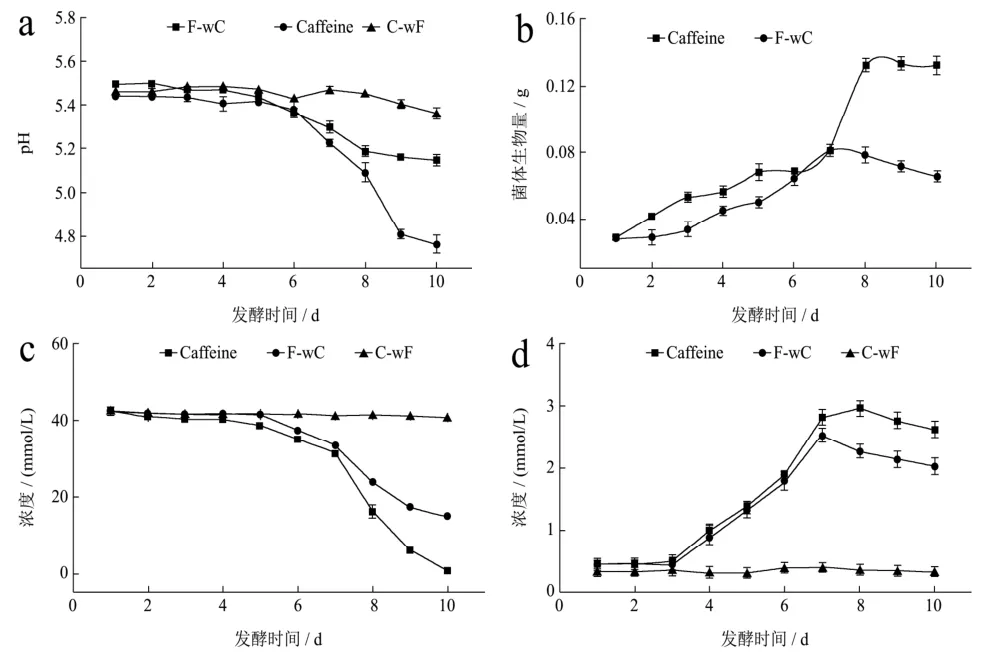
图2 冠突散囊菌-咖啡碱共培养发酵体系的理化特性Fig.2 The physical and chemical characteristics of the co-culture fermentation system of Eurotium cristatum-caffeine
2.3 冠突散囊菌-可可碱共培养发酵液中发酵产物含量的变化
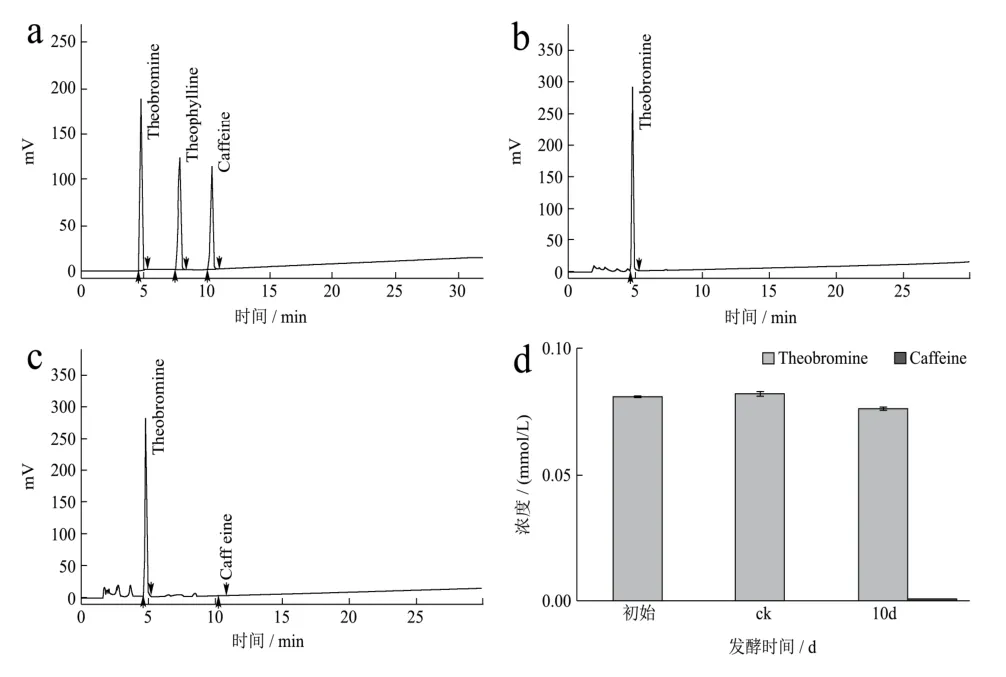
图3 HPLC法检测发酵液中可可碱及其发酵产物的含量Fig.3 The content of theobromine and its fermentation products in the fermentation broth was detected by HPLC
采用HPLC方法对添加可可碱的发酵液进行含量检测分析,结果显示为期10 d的发酵对发酵液中可可碱的含量变化无明显影响,这意味着发酵液中的可可碱可能不能被冠突散囊菌生长繁殖所直接利用,这可能与咖啡碱较稳定的化学性质有关,由图3可知,发酵结束时在发酵液中能检测到少量的咖啡碱,这说明冠突散囊菌可能能以可可碱为前提合成咖啡碱。
2.4 冠突散囊菌-可可碱共培养发酵体系的理化特性
由图4可知,可可碱添加组发酵液的pH值随着发酵时间的增加持续下降,从发酵开始到结束,两组变化趋势表现出高度一致,菌体生长繁殖将碳源转化为有机酸而导致发酵液pH值持续下降,直至第8 d趋于稳定。
二组菌体生物量呈现逐渐增加的趋势,添加可可碱与未添加可可碱对照相比,其菌体生物量要稍高于后者,说明可可碱的添加对菌体生长有促进作用。发酵进入第8 d,菌体生物量开始下降,对照pH值曲线,这可能是因为菌体开始自溶所致。
添加可可碱的发酵液与未添加咖啡碱对照组发酵液中剩余葡萄糖含量的变化趋势一致,相比之下,添加可可碱的发酵液中葡萄糖的含量下降的更为明显,说明有可可碱的存在可能对刺激菌体的生长繁殖存在积极作用,从而加速冠突散囊菌对发酵液中葡萄糖的消耗;二组发酵液总蛋白质含量均随着时间的增加而逐渐升高,而又分别在发酵第8、9 d相继开始下降,一方面冠突散囊菌在发酵培养过程中胞外酶的分泌和积累,另一方面,也可能是由于菌体自溶导致胞内蛋白等大分子物质快速降解。

图4 冠突散囊菌-可可碱共培养发酵体系的理化特性Fig.4 The physical and chemical characteristics of the co-culture fermentation system of Eurotium cristatum-theobromine
2.5 冠突散囊菌-茶碱共培养发酵液中发酵产物含量的变化
采用HPLC方法对添加茶碱的发酵液进行含量检测分析,图5结果显示为期10 d的发酵对发酵液中茶碱的含量变化无明显影响,这意味着发酵液中的茶碱不能被冠突散囊菌生长繁殖直接利用;由图5-K可知,发酵结束时在发酵液中能检测到少量的咖啡碱,这说明冠突散囊菌可能以茶碱为底物合成咖啡碱。
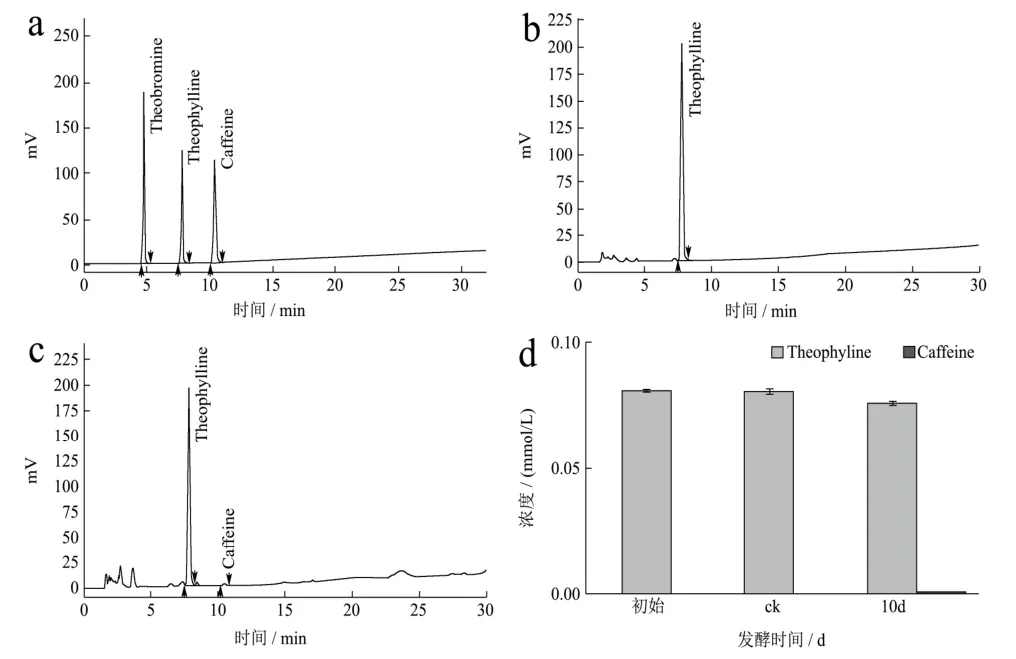
图5 HPLC法检测发酵液中茶碱及其发酵产物的含量Fig.5 The content of theophylline and its fermentation productsin the fermentation broth was detected by HPLC
2.6 冠突散囊菌-茶碱共培养发酵体系的理化特性
图6结果显示茶碱组发酵液的pH值随着发酵时间的增加持续下降,从发酵开始到发酵结束,茶碱组与未加茶碱组变化趋势表现出高度一致,菌体生长繁殖将碳源转化为有机酸而导致发酵液pH值持续下降,直至第8 d趋于稳定。
二组菌体生物量均呈现增加的趋势,添加茶碱与未添加茶碱对照比相比,其菌体生物量前者要稍高于后者,说明茶碱能刺激菌体生长。发酵进入第8 d,菌体量开始下降,对照pH值曲线,这可能是由于菌体自溶所引起的。
两组发酵液中剩余葡萄糖含量的变化趋势一致,添加茶碱的发酵液中葡萄糖的含量下降的更为明显,说明有茶碱的存在可能对刺激菌体的生长繁殖存在积极作用,从而加速冠突散囊菌对发酵液中葡萄糖的消耗;二组发酵液总蛋白质含量都随着时间的增加而逐渐升高,而又分别在发酵第8、9 d相继开始下降,一方面冠突散囊菌在发酵培养过程中胞外酶的分泌和积累,另一方面,也可能是由于菌体自溶导致胞内蛋白等大分子物质快速降解。
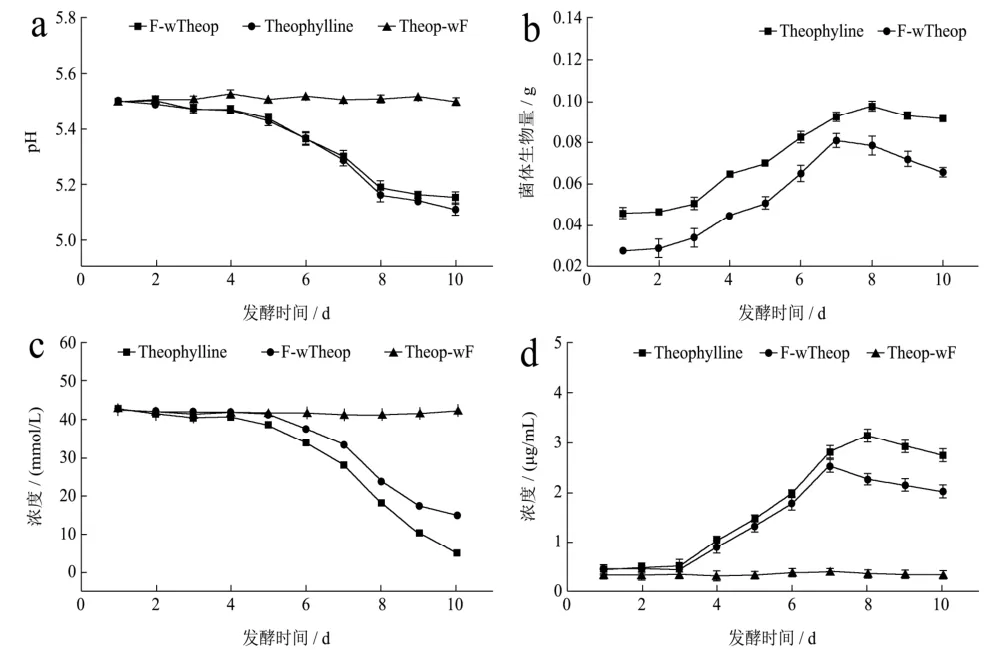
图6 冠突散囊菌-茶碱共培养发酵体系的理化特性Fig.6 The physical and chemical characteristics of the co-culture fermentation system of Eurotium cristatum-theophylline
3 结论
3.1 茯茶中的“金花”菌(冠突散囊菌)之所以能生长繁殖是因为茶叶能为“金花”菌的生长繁殖提供必需的碳源、氮源,一方面,“金花”菌直接利用简单含碳、氮化合物进行生长繁殖,另一方面,“金花”菌分泌的孢外酶作用于茶叶内含成分发生一系列生化反应,间接的为该菌的生长繁殖提供营养基础。“散茶发花”技术[16]是在传统茯砖茶加工工艺基础上的创新与升级,其独特之处在于较大地缩短了加工周期,从压制到出烘由传统的1个月的时间缩短至1周左右,且利用该技术加工的茯茶新产品品质无异于传统茯砖,“菌花”香更为浓郁,此得益于人工大量接种纯冠突散囊菌,本研究以此为基础,配制单一基质作为满足冠突散囊菌生长繁殖的基本需求,同时分别添加已知浓度的生物碱单体成分,构建茶叶生物碱单体成分-冠突散囊菌共培养发酵体系(10 d),考察冠突散囊菌对其的发酵特性,为进一步丰富茯茶品质形成机理提供理论依据。
3.2 咖啡碱是一类嘌呤类生物碱,是也茶叶特征性成分之一,占茶叶干重的2%~4%[17]。本研究以0.2 mg/mL的咖啡碱作为代谢底物添加到冠突散囊菌的发酵培养基中,考察咖啡碱与冠突散囊菌间相互影响,结果表明,该浓度的咖啡碱的添加对冠突散囊菌的生长繁殖,
pH值,剩余葡萄糖含量和总蛋白质含量具有一定影响。咖啡碱的添加能在一定程度上刺激冠突散囊菌的生长,但在发酵过程中,其含量并未出现明显变化,这说明在该发酵系统中,冠突散囊菌既不能将其作为碳源、氮源分解代谢来维持生长,也不能利用共培养发酵体系中其他成分来合成咖啡碱。该结果与前人研究基本一致,且研究表明微生物体系中,利用真菌分解代谢咖啡因远比细菌要难的多[18],而且只发生在极少数的青霉属和曲霉属类群中,逐级代谢为茶碱和3-甲基黄嘌呤[19]。
3.3 可可碱与茶碱互为同分异构体,是茶叶中除咖啡碱外两种重要的生物碱,其添加与咖啡碱相似,能在一定程度上刺激冠突散囊菌的生长与繁殖,但不能将其作为碳、氮源消耗和分解,同时经HPLC检测分析,在可可碱、茶碱与冠突散囊菌的共培养发酵体系中均能检测到少量咖啡碱,意味着冠突散囊菌可能具有将可可碱与茶碱作为前提合成咖啡碱的能力,本研究结果为后续研究可可碱、茶碱的具体转化途径及共培养发酵转化体系的进一步优化奠定了重要的前期基础。
——陕西泾阳县茯茶小镇转型观察

