宁夏种植甘草δ13C组成与水分利用的关系
胡海英,梁新华,伏晓昭,王 兴,谢应忠
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学生命科学学院,宁夏 银川 750021;3.宁夏大学西北土地退化与生态恢复省部共建国家重点实验室培育基地,宁夏 银川 750021;)
在降水量少、蒸发强烈、土壤含水量低的干旱、半干旱地区,土壤水分依旧是影响植物生长和发育的最重要的环境因素之一。因此,植物能否适应当地的极限环境条件,最主要还是要看它们能否很好地协调碳同化和水分耗散之间的关系。植物水分利用效率(water use efficiency,WUE )能够很好地衡量和解析这种相关性[1-2]。当水分不足时,植物会关闭部分气孔,使通过气孔进入叶片的CO2减少,引起植物叶内CO2浓度(Ci)下降,植物对CO2的识别能力必然降低,从而使叶片 δ13C 值升高。δ13C 值与WUE呈正相关,高δ13C 值对应高WUE,许多试验证实了两者之间具有很强的相关性[3-5],目前测定植物δ13C 值成为鉴定植物WUE的一种常规方法,推算的WUE其实就是单位气孔导度所能同化的碳量,可以用来表征植物对环境变化所产生的生理响应。张正斌等[6-7]提出植物必须具有水分高效利用和抗旱性的双重能力,充分利用生长季节的一定有限降水,才能够生存和高产。因此了解植物WUE,探明植物水分利用特征不仅为生长在水分为限制因子的区域估计水分平衡提供思路,还能为荒漠化地区植被恢复的物种选择、种植策略、人工管理等提供实践应用支持。
乌拉尔甘草(GlycyrrhizarualensisL,下文简称甘草,Liquorice) 是一种用途广泛的资源植物,也是人类开发利用最早的物种之一。其地下根茎是传统的大宗中草药,地上茎、叶、花果是荒漠畜牧业优良的天然牧草[8],而且以其强大的地下根系和对风沙、盐碱等恶劣环境的适应性,有效发挥着保护生态环境的重大作用。宁夏盐池被誉为“中国甘草之乡”,该地区累计发展人工种植甘草56 600 hm2,成为全国最大的甘草种苗培育基地[9]。但是近几年受市场价格和管理成本等多重影响,人工甘草产区面积骤缩,灌溉栽培技术粗放,病虫害肆虐,产量与品质不佳等诸多问题存在。尤其是随着气候变化和水资源日益匮乏,大面积种植甘草势必存在如何用水问题,不同水分条件下甘草WUE存在何种差异,如何适应土壤水分变化,是目前需要解决的关键问题。针对此,本文在宁夏盐池县退耕还草地选择不同水分来源的人工栽培甘草,利用稳定碳同位素技术,比较研究不同生境栽培甘草的WUE以及适应土壤水分变化特征,提出有效水分利用建议,为荒漠化地区人工种植甘草的栽培策略、水资源利用和管理提供研究资料。
1 材料与方法
1.1 研究区概况
研究区位于宁夏吴忠市盐池县(106°30′~107°41′E,37°04′~38°10′N),该地区属中温带大陆性气候,为典型半干旱地区,年平均气温8.1℃,年降水量在250~350 mm,年际变化幅度高达30%以上。降雨主要集中在6-9月,约占全年降水量的60%以上,年蒸发量达2 710 mm,约为降水量的5~7倍,年均无霜期为165 d,≥10℃年有效积温为2 945℃左右,年日照时数为2 867 h,全年太阳辐射总量为140 kJ·cm-2。土壤类型主要以灰钙土和风沙土为主。
1.2 试验材料与设计
在宁夏盐池县高沙窝镇所辖退耕还草地乌拉尔甘草野生分布区和人工种植基地,选择封育草地补播的2 a生和3 a生野生甘草为对照1(CK1)和对照2(CK2),利用自然降水栽培种植2 a生和3 a生甘草分别为处理1(T1)和处理2(T2),利用灌溉水栽培种植2 a生和3 a生甘草分别为处理3(T3)和处理4(T4),共有6个试验样地,每个试验样地设3个重复,即分为3个试验小区,每小区面积为223 m2,各试验样地气候、地势及土壤质地相近,年均降水量337.95 mm。栽培种植甘草定植密度为10 000~12 000 株·667m-2。人工灌溉甘草种植试验区6-7月每月灌水定额为30~40 m3·667m-2,8月灌水定额为20~30 m3·667m-2,全年抽水漫灌3~4次水。
1.3 样品采集
在2016年甘草旺盛生长期同期采集植物及土壤样品。植物样品采集:在各试验小区随机选取10株长势相似植株,采集叶片混合成1份样品,装在干燥信封中冷藏保存带回实验室待测,3次重复。土壤样品采集:在每个试验小区按对角线5点法采集0~20、20~40、40~60、60~80 cm土壤剖面样品,相同层次5点混合为1个样品,装入铝盒带回实验室待测,3次重复。
1.4 样品分析
1.4.1 植株样品分析 叶片相对含水量(RWC)采用生物量差减法,游离脯氨酸(Pro)采用酸性茚三酮法,叶绿素含量采用95%乙醇浸提法[10]分别测定。δ13C值的测定分析:将甘草叶片用去离子水洗净后于70℃恒温条件下烘干72 h,用球磨仪粉碎并过100目筛后密封保存于1 mL离心管,寄送至深圳市华科精信检测科技有限公司稳定同位素实验室用DELTA V Advantage 同位素比率质谱仪(Isotope Ratio Mass Spectrometer)测定样品碳同位素比值,样品在元素分析仪中高温燃烧后生成CO2,质谱仪通过检测CO2的13C与12C比率,并与国际标准物(Pee Dee Belnite或PDB,一种海洋中的贝壳化石,其13C含量为1.124%)比对后,根据公式:δ13C=(Rp-Rs)/Rs(Rp、Rs分别表示植物组织样品和标准化石PDB的13C /12C)计算出样品的δ13C值。
1.4.2 土壤样品分析 土壤含水量采用烘干差减法测定。
1.5 数据统计和分析
数据用平均值±标准差(Mean±SE)表示。采用SAS软件对试验结果进行单因素方差分析,利用IBM SPSS 22.0软件进行相关性统计分析,处理间采用LSD法进行多重比较。用Excel 2007软件作图。
2 结果与分析
2.1 不同生境土壤含水量的差异分析
图1结果表明,自然降雨条件下 0~20、20~40、40~60、60~80 cm各土层土壤平均含水率分别为6.38%、5.49%、3.71%、2.99%,随着土层深度增加土壤含水量逐渐降低,深层60~80 cm的含水量只有3%左右,显著低于其他土层。人工灌溉下各土层平均值分别为13.50%、14.18%、16.22%、17.6%,土壤含水量随着深度的增加而增加,深层60~80 cm的含水量达到18%左右。人工灌溉条件下的土壤含水量是自然降水下的3.31倍,人工灌溉显著增加了土壤含水量。自然降水条件下,野生甘草(CK1、CK2)与人工栽培甘草(T1、T2)0~20 cm剖面土壤含水量有显著差异,其它各剖面差异不显著。
2.2 不同水分条件下甘草δ13C值组成与WUE
如图2a所示,不同水分来源条件下,各生境的甘草叶片δ13C值在-25.91‰~-27.31‰之间,属于C3植物,自然降水各处理(CK1、CK2、T1、T2)与灌溉条件下2个处理(T3、T4)甘草叶片δ13C值之间有显著差异 (P<0.05);在自然降水条件下,野生甘草叶片δ13C均值(-26.33‰)略高于人工栽培甘草叶片δ13C均值(-26.67‰),但两者之间差异不显著;而同种水分条件下的2 a生与3 a生甘草之间的δ13C值无显著差异 (P>0.05)。
植物体在光合作用过程中会对13C进行选择吸收,其δ13C值的高低主要取决于光合作用途径的差异,而植物CO2的同化过程与植物水分利用(主要是蒸腾作用)之间是相互偶联的,因此通过测定植物叶片的δ13C值可以估算长期的WUE[11]。借鉴严昌荣[11]关于植物WUE推算公式:WUE=13.712+0.354 δ13C,估算不同处理甘草的WUE,如图2b所示,自然降水条件下各处理甘草的WUE显著高于人工灌溉甘草;野生甘草与人工栽培甘草之间的WUE差异不显著,但降水条件下栽培甘草(T1、T2)显著高于灌溉下栽培甘草(T3、T4)的WUE;同种水分条件下2 a生与3 a生甘草之间的WUE无显著差异(P>0.05)。
2.3 不同水分条件下甘草叶片RWC和脯氨酸的变化特征
植物RWC可以反映植物的水分亏缺[12],而且在干旱环境中植物普遍存在着水分亏缺。如图3a所示,甘草在不同的水分条件下水分亏缺程度差异显著,自然降水条件下各处理(CK1、CK2、T1、T2)甘草叶片RWC均值与灌溉条件下各处理(T3、T4)甘草RWC均值之间有显著差异(P<0.05) ,且在自然降水条件下野生甘草和栽培甘草叶片RWC之间亦差异显著(P<0.05),灌溉条件下生长年限之间的RWC无显著差异,但降水条件与灌溉条件之间栽培甘草的RWC差异显著(P<0.05)。
植物叶片游离脯氨酸含量的积累可以反映植物应对水分亏缺的能力,研究表明[13-16],在适宜水分条件下,植物的游离脯氨酸含量随着时间推移变化不大,但干旱胁迫条件下,随着时间变化其游离脯氨酸含量明显呈现先上升后下降的趋势。如图3b所示,自然降水条件下各处理(CK1、CK2、T1、T2)甘草脯氨酸含量均值为150.39 μg·g-1,灌溉条件下各处理(T3、T4)甘草脯氨酸含量均值为451.87 μg·g-1,两者之间呈显著差异(P<0.05),野生甘草(CK1、CK2) 脯氨酸含量均值(317.33 μg·g-1)与栽培甘草各处理(T1、T2、T3、T4)脯氨酸含量均值(326.14 μg·g-1)之间未呈现差异,自然降水条件下栽培甘草的脯氨酸含量显著低于灌溉条件下的。可见,各处理甘草叶片RWC和脯氨酸含量会随着土壤水分改变而发生变化。

图1 不同生境土壤含水量变化特征Fig.1 Soil moisture content of different soil layers in different habitats

图2 不同水分条件对甘草叶片δ13C值和WUE的影响Fig. 2 Effect of moisture conditions on the δ13C value and WUE in leaves of liquorice
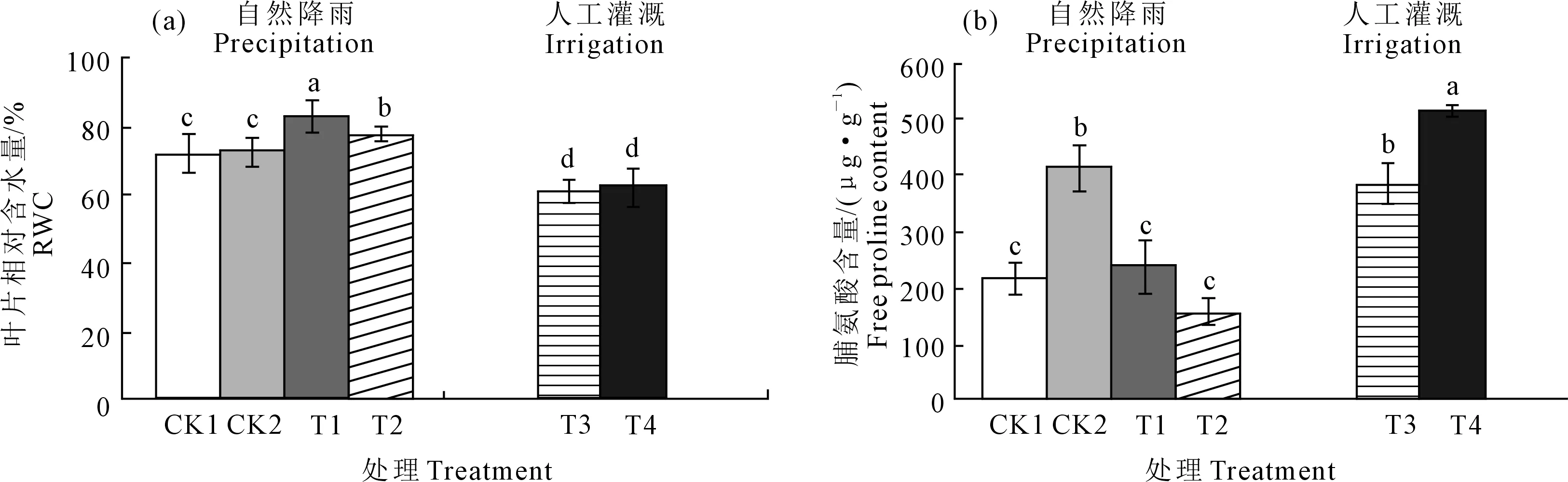
图3 不同水分条件对甘草叶片RWC和脯氨酸含量的影响Fig.3 Effect of moisture conditions on relative water content and proline content of liquorice
2.4 不同水分条件下甘草叶片叶绿素含量的变化特征
植物叶片中光合色素含量的高低在很大程度上反映了植物的生长状况和叶片的光合能力,可以指示植物对水分胁迫的敏感性[17]。如表1所示,不同生境中甘草叶绿素a、叶绿素b、叶绿素a/b值及叶绿素含量均呈显著性差异(P<0.05)。自然降水条件下的各处理(CK1、CK2、T1、T2)甘草的叶绿素a均值(1.17 mg·L-1)、叶绿素b均值(0.63 mg·L-1)及叶绿素总含量均值(1.79 mg·g-1)显著低于灌溉条件下各处理(T3、T4)甘草的叶绿素a均值(2.08 mg·L-1)、叶绿素b均值(1.25 mg·L-1)及叶绿素总含量均值(3.33 mg·g-1);而叶绿素a/b值的变化则相反。自然降水条件下栽培甘草与野生甘草之间的叶绿素各组分含量无显著差异,而灌溉条件下不同生长年限之间的叶绿素各组分含量有显著差异(P<0.05)。可见,土壤水分条件也是影响甘草光合色素含量的主要因子,其能够维持叶绿素a/b稳定的比值。说明甘草叶片在自然降水条件下虽然总叶绿素含量下降,但因叶绿素a/b值提高,因此可以维持较稳定的光能吸收、传递、转换功能,进而可以为光合作用顺利进行提供保障。
2.5 甘草叶片δ13C值与土壤含水量、WUE、脯氨酸含量、叶绿素等指标间的相关性
从以上结果分析发现,不同生境中甘草因土壤含水量的不同而表现出δ13C值、RWC、脯氨酸含量、叶绿素含量等指标的显著差异,将甘草各项指标进行相关性分析,发现甘草δ13C值与RWC极显著正相关,与脯氨酸含量、叶绿素含量、叶绿素a含量显著负相关,与土壤含水量极显著负相关,相关系数分别为0.978、-0.804、-0.799、-0.775、-0.929;RWC与脯氨酸含量、叶绿素a含量显著负相关,与叶绿素含量、土壤含水量极显著负相关,相关系数分别为-0.756、-0.812、-0.836、-0.861;叶绿素含量与土壤含水量显著正相关,相关系数为0.813。从这些相关性可以看出,甘草叶片δ13C值能够同时反映植株与土壤的水分状况,与植物光合及渗透调节也有一定的联系。
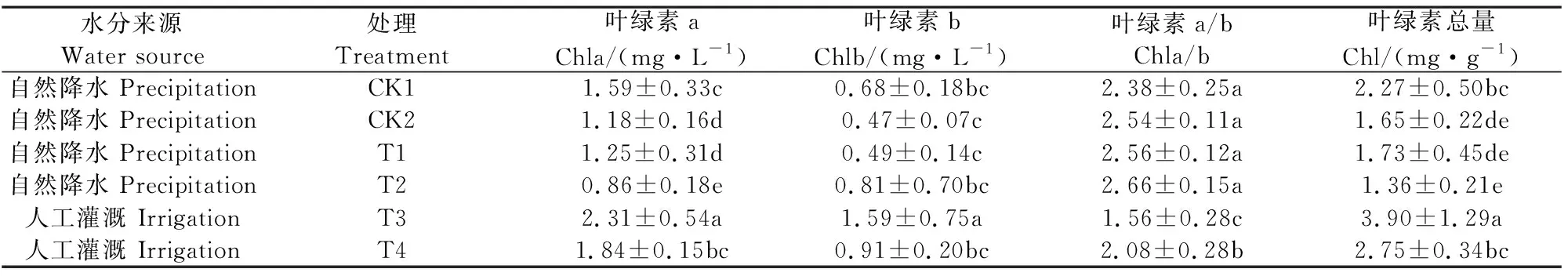
表1 不同水分条件下甘草叶绿素及其组分含量变化
注: 同列数据后不同小写字母代表不同处理差异达显著水平(P<0.05) 。
Note: Data with different lowercase letters in the same column means significantly different (P<0.05) .

表2 δ13C值与土壤含水量、RWC、脯氨酸含量、叶绿素等指标间的相关性分析Table 2 Correlation between the δ13C values and the soil water contents, the relative leaf water contents,the proline content, and the content of chlorophyll
注:*表示在0.05水平上显著相关(双侧);**表示在0.01水平上显著相关(双侧).
Note: * and ** indicate significant correlation atP=0.05 andP=0.01 levels, respectively.
3 结论与讨论
研究表明[18],干旱可提高植物δ13C值和WUE,而灌溉则降低植物的δ13C值和WUE,而且C3植物δ13C值与土壤水分呈现很好的负相关关系[19]。甘草是典型的C3植物,本研究中,甘草叶片δ13C值随土壤含水量的增加而减少,且两者之间呈极显著负相关,这一结果与前人研究结果一致[5,19-22]。自然降水条件下栽培甘草与野生甘草之间的δ13C值无显著差异,但土壤含水量大的灌溉地栽培甘草δ13C值显著低于降水条件下的δ13C值,相应地栽培甘草在灌溉条件下的WUE显著低于自然降水条件下的WUE。由于植物生长年龄影响根系的类型和分布深度,导致不同年龄的植物具有不同的水分利用效率[6],在本文中,相同水分条件下2 a生与3 a生野生和栽培甘草叶片δ13C 值与WUE并无显著差异。可见,利用自然降水的栽培甘草具有高的水分利用效率,与野生甘草一样能够节约并有效地利用土壤水分,并在一定可利用水分条件下最大程度地固定碳,这是对干旱土壤环境的长期适应结果。
同一植物生长在不同的环境中,通常可以用其叶片RWC来指示环境水分亏缺程度,而且植物RWC可以直观地反映植物的抗脱水性,RWC越高,抗脱水性就越强[12],本研究结果显示,甘草叶片的δ13C 值与叶片RWC呈极显著正相关,土壤含水量与叶片RWC呈极显著负相关,说明叶片的δ13C 值可以同时反映出环境和植物体本身水分的亏缺程度,当甘草叶片水分不足时,通过气孔调节保持膨压稳定,维持植物正常的代谢活动,可见,在不同水分条件下甘草能通过调节气孔导度达到合适的WUE。赵则海等[23]研究表明 3 a生栽培甘草的净光合速率、表观量子效率和水分利用效率等参数与野生甘草最接近,种植3 a的栽培甘草已基本具备了野生甘草的光合能力。本研究区野生甘草植被生长相对稀疏,但是在栽培种植条件下,甘草植被呈现出植株高大、浓密的外观,说明当生长环境条件变好时,其光合能力可能是调节甘草δ13C值和WUE变化的主要因子。叶绿素是植物吸收太阳能进行光合作用的重要物质,在光合作用中起到接受和转换能量的作用,在一定范围内,叶绿素含量越高,光合越强,就能制造更多的光合产物[24]。本研究中甘草叶绿素a及叶绿素含量与δ13C 值之间具有一定负相关关系,而与土壤含水量之间呈显著正相关。这进一步说明,水分条件的改变引起了光合色素的变化,进而引起光合功能的改变,从而影响到甘草δ13C值和WUE的变化。
当植物受环境胁迫(干旱、水涝、冷害等)时脯氨酸会大量累积,以维持细胞一定的含水量和渗透势,从而增强植物的抗逆能力。本研究发现不同土壤含水量条件下的甘草叶片δ13C 值与脯氨酸含量呈显著负相关,与马剑英等[20]研究认为荒漠植物红砂脯氨酸含量与叶片δ13C 值呈正相关关系不同,说明脯氨酸含量与δ13C 值对土壤含水量变化生理适应机制因物种不同而不同。自然降水条件下,甘草已处于一定时期的干旱胁迫(0~80 cm剖面平均土壤含水量为4.65%±0.46%),唐晓敏等[14-15]研究认为,随着干旱胁迫时间的延长,脯氨酸含量均呈先上升后下降并趋于稳定的变化态势。因此,自然降水条件下,栽培甘草和野生甘草一样,其脯氨酸含量处在较稳定的状态,脯氨酸积累值与唐晓敏[14]研究结果相近。而在有灌溉条件的生境中,由于土壤水分过多,土壤渍水阻断根系的氧气供应,妨碍有氧呼吸,使得甘草处于水分过多的胁迫,因此,甘草的脯氨酸含量在短期内积累增加,极显著高于自然降水条件下甘草的脯氨酸含量,可见,甘草应对水分条件变化具有明显的渗透调节敏感性和适应能力。
综上所述,土壤水分仍然是栽培甘草δ13C 值的主要影响因子,甘草叶片δ13C 值不仅能够指示甘草长期WUE,也能够指示环境水分亏缺程度。以自然降水为主要水分来源的人工种植甘草与野生甘草一样具有较高的WUE,通过自身强大根系,以一定的生理适应机制来防止体内水分散失,可见,甘草会以较强的碳同化能力和节水型生理对策来适应干旱,且适度的干旱胁迫,有利于甘草生长量的积累和品质的提高[23-24]。因此,在干旱半干旱荒漠草原地区,要根据退耕地的水分环境条件,合理布设药用甘草种植面积,不提倡利用地下水漫灌,应科学利用自然降水规律,创新甘草栽培管理模式,节约用水的同时有效提高甘草的产量和品质。在退化草场植被恢复过程中,应选择如甘草这种WUE高、不依赖表层水稳定生存、且具有生态经济价值的野生乡土牧草,能够以高的水分利用效率和抗旱能力来维持稳定的群落结构。今后的研究重点将把植物的水分利用效率与抗旱性结合起来,从而综合有效地筛选出水分高效利用和耐旱性强的乡土优势植物,并研究制定如何以较少的耗水获得更多绿色产出的种植策略。

