氟比洛芬酯相关肝损害的自动监测与风险因素研究
刘 浩,宋艳东,赵粟裕,柴 栋,马 亮,郭代红( .解放军总医院药学部临床药学中心,北京 00853;.天津医科大学药学院,天津 300070)
氟比洛芬酯注射液(flurbiprofen axetil injection,FA)2004年在中国上市,商品名:凯纷。作为非甾体抗炎药氟比洛芬的酯类前体药物,能够非选择性地抑制环氧合酶,阻断前列腺素合成,临床上用于缓解术后及因癌症引起的疼痛。常见的不良反应为恶心、呕吐、头痛、嗜睡等,罕见严重不良反应有急性肾衰、胃肠道出血、伴意识障碍的抽搐[1]。笔者临床实践中发现该药对患者肝功能有相关影响,而查阅文献及说明书等证据并不充分[2],因此利用我院自主研发的“医疗机构ADE主动监测与智能评估警示系统”(adverse drug events active surveillance and assessment system,ADE-ASAS)[3-6],对真实世界中FA致药物性肝损害(drug induced liver injury,DILI)的发生率进行评估测算,获取FA相关DILI准确发生率,同时分析评估FA致DILI的相关风险因素。
1 资料与方法
1.1 研究对象
利用ADE-ASAS回顾性监测2017年1月- 12月期间在我院使用FA(北京泰德制药股份有限公司,注册证号0499003IJ1,规格 5 mL:50 mg)的所有住院患者。采集患者年龄、身高、体重、体重指数(BMI)、性别、既往史、诊断信息、饮酒史、用药史、手术史及DILI等基本信息,必要时查阅住院治疗经过、临床症状、基本生命体征、仪器检查及实验室检查结果。
1.2 DILI事件配置器参数设置
基于国家药品不良反应监测中心制定的《药品不良反应术语使用指南》设计“DILI”事件配置器标准,包括入选标准、排除标准、筛选标准。
1.2.1 病例入选标准经静脉途径使用FA;临床资料及用药医嘱完整、准确、可靠。
1.2.2 病例排除标准①排除以下病区的病例:肝胆外科、肿瘤外二科(接收肝胆癌患者);排除有以下基础疾病的病例:肝胆癌、酒精性肝病、肝胆部位感染、遗传代谢性肝病、非酒精性脂肪性肝病、妊娠急性脂肪肝、自身免疫性肝病、胆汁淤积性疾病、急性中毒、病毒性肝病等。②排除用药前指标异常的患者:使用FA前丙氨酸氨基转移酶(ALT)或天门冬氨酸氨基转移酶(AST) > 40 IU·L-1或/和总胆红素(TB) > 21 μmol·L-1或/和直接胆红素(DB) > 8.6 μmol·L-1;系统筛选病例之前设置排除“肝功能指标缺失”选项。
1.2.3 病例筛选标准连续2次检测ALT > 40 IU·L-1或/和TB > 21 μmo·L-1;或单次检测ALT > 80 IU·L-1或/和TB > 42 μmol·L-1,该过程所筛选病例即为报警病例。
1.3 报警病例关联性评价
ADE-ASAS监测完成后给出的报警病例,由两名药师进行背靠背的人工逐一甄别,参照《药品不良反应术语使用指南》中肯定、很可能、可能、可能无关、待评价及无法评价的6级评价标准进行因果关联性评价,评价结果为“可能”、“很可能”、“肯定”为阳性病例。若所评结果有差异时,通过深度讨论得出一致结论。
1.4 阳性病例严重程度分级评价
根据《药物性肝损伤诊治指南(2017年版)》[7]人工评价FA相关性肝损害的严重程度分级,见表1。

表1 DILI严重程度分级Tab 1 Severity grades of DILI
1.5 阳性病例肝损害分型评价
根据《药物性肝损伤诊治指南》(2017年版)[7]人工评价FA相关性肝损害的分型标准。国际医学组织理事会(CIOMS)建立并修订的DILI分型标准如下:①肝细胞损伤型:ALT ≥ 120 IU·L-1且R ≥ 5;②胆汁淤积型:ALP ≥ 260 μmo·L-1且R ≤ 2;③混合型:ALT ≥ 120 IU·L-1,ALP ≥ 260 μmo·L-1且2 < R < 5。若ALT和ALP达不到上述标准,则称为“肝脏生化学检查异常”,其中R = (ALT实测值/ALT正常值上限)/(ALP实测值/ALP正常值上限)。
1.6 统计学分析
采用Microsoft Excel 2013对数据进行整理,采用SPSS 22.0统计软件进行分析。单因素分析时计量资料若满足正态分布及方差齐性时则采用t检验,若不满足则采用秩和检验,采用Mann-Whitney U检验;计数资料采用χ2检验;多因素分析时采用二分类logistic回归分析。检验水准α = 0.05。
2 结果
2.1 系统自动筛查与再评价结果
ADE-ASAS预设排除标准及筛选标准后,用时9600 s完成了FA住院用药患者7319例、8041例次的肝损害自动监测,其中排除基值异常、诊断混杂及指标缺失3080例次,共纳入4961例次,其中男性2240例次,女性2721例次,平均年龄(54.60 ± 14.68)岁;系统报警191例次,双人盲评的阳性病例分别为156例、149例,最终人工评价确定阳性病例149例[很可能63例,可能86例,平均年龄(55.99 ± 13.43)岁],系统阳性报警率78.01%(149/191),肝损害发生率3.00%,发生时间主要集中在用药后1 ~ 7 d(65.00%),平均(5.40 ± 4.06) d;42.62%的病例发生在停药之前。具体肝损害类型及肝损害程度见表2。
2.2 FA致DILI相关危险因素分析
2.2.1 单因素分析对FA致DILI的性别、年龄、BMI、用药剂量及用药时长5种危险因素进行单因素检验,结果显示性别及用药时长差异有统计学意义(P < 0.05),具体见表3。

表2 149例ADR阳性病例基本情况Tab 2 The basic situation of 149 ADR positive cases
2.2.2 二分类logistic回归分析临床认为BMI也是肝损害发生的可能危险因素,为避免漏掉重要因素,将P值放宽至P < 0.15,暂时将BMI纳入危险因素,因此以下logistic回归模型中将纳入以下自变量:性别、用药时长及BMI,回归过程默认各自变量为哑变量,以最高赋值作为参照,具体赋值见表4。模型似然比检验显示该回归模型有意义(χ2= 35.293,P <0.001),拟合优度检验显示模型拟合良好(P = 0.196),可以进行logistic回归分析。回归结果显示,在均衡其他因素的影响下,BMI对FA致DILI没有影响(P >0.05),性别和用药时长是其风险因素(P < 0.05),男性比女性较少发生FA相关DILI (OR = 0.652),患者用药时间较长时更易发生该不良反应,详见表5。
3 讨论
3.1 FA致DILI特征分析
系统报警ADR经人工评价后DILI发生率3.00%,其中轻度88.59%、中度4.70%、重度2.01%,未见急性肝衰竭及致命情况。而说明书仅提示“消化系统有时可出现转氨酶升高”[1],缺乏明确的DILI发生率及发生程度。国外报道药物性肝损害发生率在1 ~ 20/100 000[8-9],本研究中FA发生率远远高于这个比例,考虑可能的原因如下:①Ohmuka[10]研究中1089例服用氟比洛芬酯的患者中有1%出现AST或ALT异常升高超过正常值,提示FA致DILI本身的概率超过其他常见药物;②本研究纳入患者均为住院患者,且笔者所在医疗机构接收患者大多病情较重,救治过程中用药剂量及联用种类较多,加重肝功能代谢负担,导致用药后DILI发生概率较高。
ADR发生时间多在用药后1 ~ 7 d(65.00%),平均(5.40 ± 4.06) d;42.62%的病例发生在停药之前。71.81%肝损害类型为肝脏生化学检验异常,20.13%为肝细胞损伤型,胆汁淤积型仅占1.34%。说明FA致DILI以轻度肝损害为主,较少达到肝细胞损伤型及胆汁淤积型。但有报道显示肝细胞损伤型容易进一步发展成急性肝衰竭,死亡率较高[11],所以出现药物性肝损害患者后,应及时判断停药指征并给予保肝治疗。此外需指出的是,由于血清ALT敏感性高[12],本研究中仅以患者住院期间血生化ALT最高值血样为标准评估肝损害类型及程度,今后的研究需多收集其他指标数据,更准确的评价DILI的动态变化。
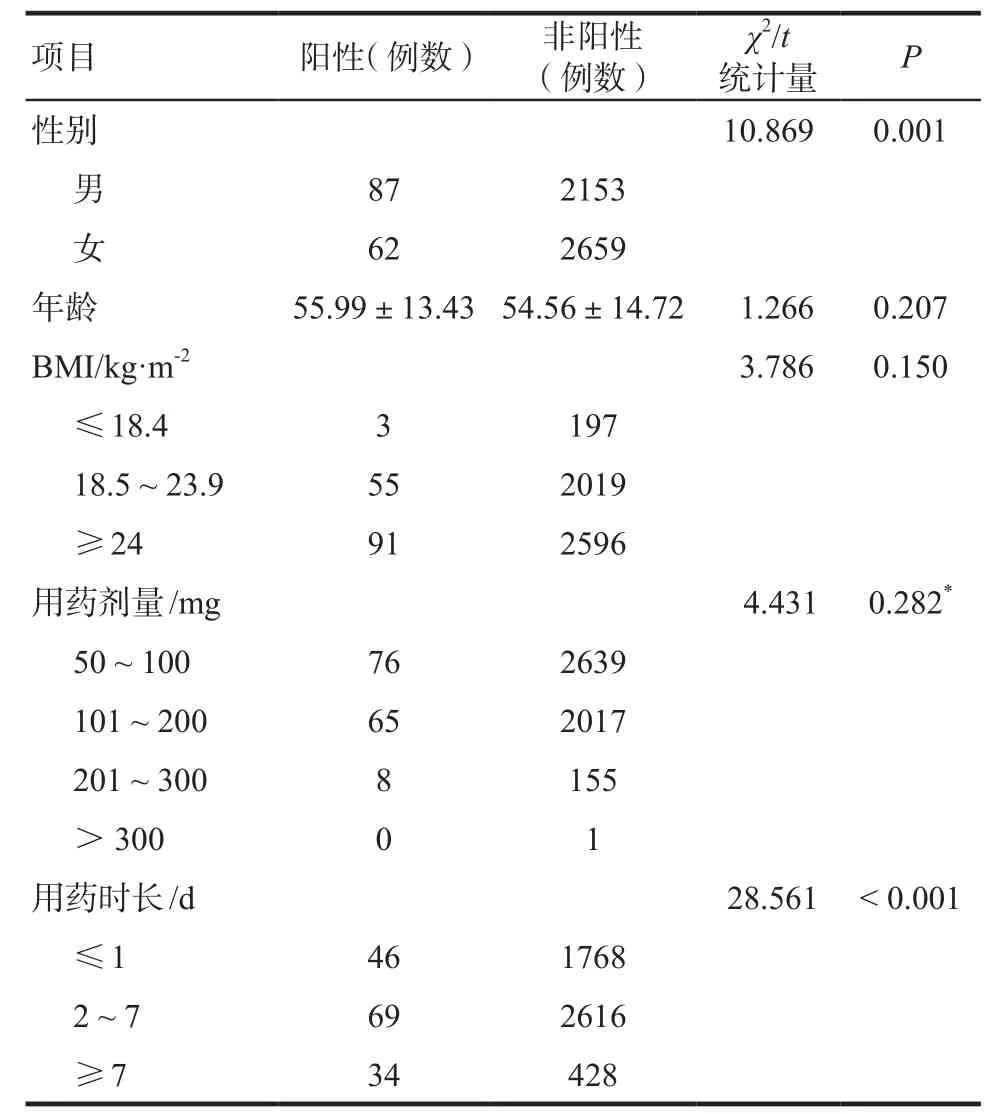
表3 FA致DILI相关因素分析Tab 3 Risk factor analysis study of FA-induced liver injury

表4 变量名及其赋值Tab 4 Variables and assignments

表5 FA致DILI的二分类logistic回归分析Tab 5 Binary logistic regression analysis of FA-induced liver injury
3.2 FA致DILI风险因素分析
研究显示年龄、BMI、用药剂量不是FA致DILI的风险因素,性别和用药时长是具有显著性统计学差异。男性患者发生DILI的风险明显低于女性(OR =0.652),为女性发生DILI的0.652倍。Fontana等[13]对660位确定、很可能以及可能DILI的患者进行危险因素回归分析,其中59.5%的患者为女性,但并未指出性别是该不良反应的风险因素。是否由于男性与女性在机体免疫力、激素水平以及肝肾微粒体药酶活性不同,导致不同性别的患者对药物的敏感性各异,有待进一步证实。患者用药时长与该ADR的发生概率呈正相关(< 1 d:OR = 0.353;2 ~ 7 d:OR = 0.362;> 7 d:OR = 1),但与用药剂量无关,约65.00%的患者ADR发生在用药一周内,分析部分DILI发生机制可能与特异质肝损害有关,此类型肝损害与代谢酶基因多态性[14]及个体异质性[15]密切相关,在药物性肝损害中较为常见[8];相关机制尚未充分阐明。
3.3 ADE-ASAS自动监测效能分析
ADE-ASAS用时9600 s完成了8041例次住院患者自动监测与智能评估,且阳性报警率达78.01%,双人盲评的阳性病例吻合度为95.51%。显示基于信息化技术发展的自动监测模式能够大大减少人力物力的消耗,降低工作强度,为高效准确的开展药品上市后安全性再评价提供了可能。而且在监测相关患者肝损害异常指标的同时,能够将基础疾病、其他药品使用情况如保肝药、其他肝损害可疑药清晰明了的呈现给研究人员,助其快速精准判断FA与DILI的关联性,也为其他药品相关肝损害的发现提供了可能[5-6]。
3.4 研究局限性
本研究中考虑到系统导出信息量大而人力物力有限,设置ADE-ASAS事件配置器参数的排除条件较严格,用药人群的纳入率仅有61.70%;但是排除条件严苛难免漏报,放宽又降低阳性报警率,增加人工甄别量[16];尽管对非报警病例进行了随机抽样检查,仍不能排除ADR发生率偏低的可能;本研究未进一步深度分析患者放射学和B超检查结果,亦有可能会将某些肝功能指标正常但已经出现器质性改变的病例排除在报警病例之外。
综上,FA致DILI损伤程度以轻度为主,发生率在常见范围。损伤类型主要表现为肝脏生化学检查异常,风险因素为性别及用药时长。临床用药中对于女性及用药时间较长的患者应更加关注其肝功能变化;一旦出现异常应及时评判,确定是否停药并给予对症治疗。基于ADE-ASAS的自动监测,病例筛选高效、快速,数据回溯完整,有助于开展药品上市后安全性再评价研究。

