不产毒黄曲霉菌株的筛选鉴定及分子机理研究
刘 俊,张国朋,张智猛,冯东晓
(1.青岛至成生物技术有限公司,山东 青岛 266101;2.山东省花生研究所,山东 青岛 266100;3.滨州医学院药学院,山东 烟台 264003)
黄曲霉毒素(Aflatoxin,AFT)主要是由黄曲霉 (Aspergillusflavus)和寄生曲霉 (A.parasiticus)产生的次生代谢产物,是一种剧毒物质,黄曲霉毒素B1毒性最大,也是世界上最强致癌物之一。黄曲霉菌广泛存在于土壤、植物及果实上,生命力顽强,花生是最容易感染黄曲霉菌的农作物之一。黄曲霉菌污染会造成花生品质下降、质量安全受到极大影响。
花生黄曲霉菌污染的防治主要在花生生育后期和晾晒储运过程中,在花生荚果发育后期,首先保证土壤水分适宜,避免收获前干旱造成种皮的破裂而增加黄曲霉菌感染机会;其次,在结荚期和荚果发育期避免耕作造成荚果损伤;第三,在收获后及时晒干荚果,使含水量迅速低于10%以下;第四,选用具有抗性的花生新品种等。但是由于黄曲霉菌的生存力强,产生的孢子可以抵抗多种恶劣自然条件,难以彻底避免黄曲霉菌的感染[1]。
目前国内外已有关于从土壤中分离不产毒黄曲霉菌的报道,美国已经批准将不产毒的黄曲霉菌用于黄曲霉毒素的生物防治。国内研究仅限于实验室内抑制产毒黄曲霉菌生长的报道[2-3],并无对不产毒菌的分子机理进行研究,也未开展相关田间试验研究和实际应用效果报道。由于霉菌在自然环境中繁殖,发生突变的比例高。一些不产毒的黄曲霉菌可能发生回复突变,重新产毒[4]。因此,有必要选择培养原生的不分泌黄曲霉毒素的黄曲霉菌,并研究其突变机理,选择低回复突变的菌株用于黄曲霉毒素的生物防治[5-6]。
本研究在山东省莱西市孙受镇沈庄村筛选对该地区土壤条件自然适应的、可以用于黄曲霉毒素防治的不产黄曲霉毒素的黄曲霉菌,并对其分子机理及田间实际应用进行研究,旨在为花生黄曲霉生物防治提供理论支撑。
1 材料与方法
1.1 材料
1.1.1 试验材料
大米购自青岛市普通超市,PDA固体培养基和LB琼脂培养基购自北京陆桥。黄曲霉毒素ELISA试剂盒购自南京森贝伽公司产品;引物序列合成及PCR产物纯化试剂盒购自上海生工;酶标仪:帝肯Tecan50;高效液相色谱:安捷伦Agilent-1200;分孢机:南京千尚电子科技有限公司 BFQ-100。
1.1.2 菌株
菌株M1、M2、D1来源:自山东省青岛市莱西市孙受镇沈庄村土壤中分离获得。
1.2 方法
1.2.1 菌种分离筛选
花生收获后取0.2 g土样,加无菌水充分震荡10 min,2000 r/min室温离心,取上清20 μL涂布于PDA 培养基。 30 ℃恒温培养,10~14 h后选取菌落直径3~7 cm、最初带黄色然后变为黄绿色、老后颜色变暗、平坦或有放射状沟纹、反面无色或带褐色、分隔良好的黄曲霉菌落,置于1.5 mL离心管,标记备用。
1.2.2 荧光复筛和鉴定
将初步选取的黄曲霉菌孢子在PDA培养基划线培养,30 ℃培养14 d后,于暗室中365 nm紫外灯下对菌落进行观察,因黄曲霉毒素在紫外灯下发荧光,可用于区分产毒和不产毒的黄曲霉菌。
1.2.3 菌株培养及产毒鉴定[7]
取250 g大米置于不锈钢盘中,加100 mL水,用铝箔纸密封盘口,120 ℃湿热灭菌15 min,冷却至室温。取黄曲霉菌株的孢子,用200 μL无菌水悬浮,取100 μL均匀涂布于LB培养基中,37 ℃培养3~4 d待菌落变成深绿色,产生明显的分生孢子后,用无菌细胞刮刀从培养基的表面刮取黄曲霉菌的分生孢子,重悬于5 mL无菌水中,充分震荡混匀,在无菌条件下均匀添加到已消毒的大米固体培养基中,用4层消毒的无菌纱布覆盖不锈钢盘,30 ℃培养箱中培养13~14 d。
收集长满黄曲霉菌的大米,取少量生长有黄曲霉菌的大米,称重后,加10倍体积的无菌水,在匀浆器中充分匀浆至无明显颗粒状物,对混悬液进行梯度稀释到1:105,取20 μL稀释后的黄曲霉菌悬液均匀涂布于PDA培养基上,30 ℃倒置培养7~10 d,进行菌落计数。
取培养黄曲霉菌株的大米样品,干燥后在研钵中充分研磨,加10 mL的甲醇:水(1:1)提取黄曲霉毒素,采用高效液相色谱法检测大米样品中的黄曲霉毒素含量[8]。
1.2.4 黄曲霉菌AflR基因的启动子DNA序列分析
取少量分离的黄曲霉菌孢子置于陶瓷研钵中,液氮研磨破坏孢子外壁,加入1mL TE-葡萄糖溶液,充分洗涤研钵,回收溶液置于离心管中,加入1mL NaOH/SDS溶液,混匀,冰浴10min,加1mL复性溶液,12000r/min 4 ℃离心10min,取500μL上清,加入等体积的酚/氯仿(24:1),混匀,4 ℃ 12000r/min离心5 min,小心吸取上清,加2倍体积的无水乙醇,冰上沉淀10min,12000r/min室温离心10 min,弃上清,沉淀用500μL 75%的乙醇洗涤,室温干燥5min后,用100μL无菌水溶解黄曲霉菌基因组DNA[9]。
以黄曲霉菌DNA为模板采用PCR扩增AflR基因的启动子DNA序列,所用引物序列为:F:5'-CTCATGCAGGTGCTAAAGA-3',R:5'-GCACAACTCGTACAGCTAT-3' ,PCR扩增条件为94℃预变性5 min,然后94℃ 40 s,57℃ 40 s,72℃ 40 s,30个循环。2%琼脂糖凝胶电泳检测PCR产物,PCR产物回收后进行测序及序列分析。
2 结果与讨论
2.1 不产黄曲霉毒素菌株筛选
从花生田采集的土壤样品经过培养、初筛,根据菌落形态和显微镜菌丝显微结构观察,共获得黄曲霉菌株1200株。荧光筛选后得到2株不产毒的黄曲霉菌株(M1、M2),其初筛菌落图及荧光复筛菌落图如下(图1、图2)。
2.2 菌株培养情况及产毒鉴定结果
取相同重量的不产毒黄曲霉菌株M1、M2和产毒菌株D1进行菌落培养并计数,将剩余的大米置于分孢机的进样口,收集黄曲霉菌孢子,获得孢子总量,多次试验取平均值,结果如图3所示。
由图3可见,经培养后不产毒黄曲霉菌M1、M2与产毒菌株D1的菌株克隆数间无显著差异,说明产毒和不产毒黄曲霉菌株的生长速率和繁殖速率无显著差异,其产孢量亦不存在显著差异。
2.3 不产毒与产毒黄曲霉菌的AflR基因启动子DNA序列分析
对不产毒的黄曲霉菌株M1、M2及产毒菌株D1进行PCR及序列分析[10],结果如图4、图5和图6所示。

图1 土壤中分离培养的黄曲霉菌菌落观测 Fig.1 Yellow Aspergillus colonies separated from the soil

图2 黄曲霉菌落的荧光鉴定观测图 Fig.2 Fluorescence identification of Aspergillus flavus(a) 不产毒黄曲霉菌落荧光检测; (b) 产毒黄曲霉菌落荧光检测图(a) Fluorescence identification of Aspergillus flavus which do not produce toxicant; (b) Fluorescence identification of Aspergillus flavus which produce toxicant

图3 不产毒与产毒菌株培养菌株克隆数与产生孢子数量对比 Fig.3 The comparison between the number of clones and the number of spores produced by the production of sterile and toxigenic strains
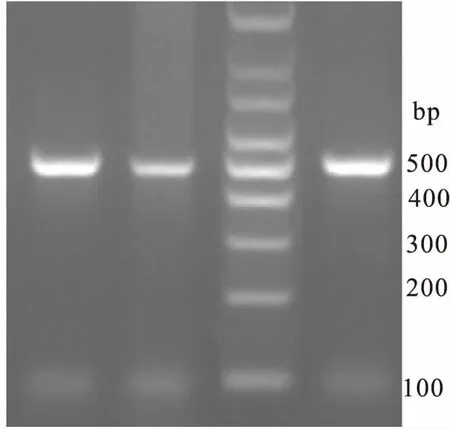
图4 黄曲霉菌AflR基因启动子DNA扩增结果电泳图谱 Fig.4 Electrophoresis of AflR gene promoter DNA

图5 M1与野生型黄曲霉菌的AflR基因启动子区的序列比较 Fig.5 The sequence comparison of promoter region of AflR gene between M1 strain and wild type

图6 M2黄曲霉菌AflR基因启动子区与野生型黄曲霉菌启动子区的序列对比示意图 Fig.6 Sequence contrast between the promoter region of M2's AflR gene and the promoter region of wild-type yellow Aspergillus
由图可见,与产毒黄曲霉菌D1的AflR基因启动子区序列对比,M2 有15个位点存在点突变,M1菌株除有27个点突变位点外,还存在3个缺失突变,分别缺失46 bp、4 bp和3 bp。由于黄曲霉菌的突变率高,因此单独的点突变存在再次突变的可能性,成为回复突变而恢复产毒,而缺失突变产生回复突变的可能性较低,因此选择了具有27个点突变位点和3个缺失突变的M1菌株作为黄曲霉毒素的生防菌株用于下一步试验。将该菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC NO. 14122,保藏日期为20170510,保藏分类命名为黄曲霉(Aspergillusflavus)。

表1 不产毒黄曲霉菌M1的各黄曲霉毒素的检测结果

表2 产毒黄曲霉菌D1的各黄曲霉毒素的检测结果
2.4 黄曲霉毒素含量
取不产毒黄曲霉菌株M1和产毒黄曲霉菌株D1进行黄曲霉毒素含量测定即产毒鉴定,表1、表2及图7、图8可见,M1样品中的各种黄曲霉毒素含量检测均为零,证明此株黄曲霉菌在生长过程中不产生黄曲霉毒素,而黄曲霉菌株D1在生长过程中可产生大量的AFB1和AFG1,其含量分别为13.8881 ng/μL和8.6018 ng/μL。
2.5 防治实施应用
正常田间种植的花生,待花生开花后,果针入土前,在每株花生周围施用分离获得的M1黄曲霉菌孢子悬液5 mL,对照组只施用无菌水5 mL,正常施肥和浇水。收获花生后,分别取施用和未施用M1黄曲霉菌孢子悬液的花生样品,粉碎后用甲醇:水溶液(1:1)提取黄曲霉毒素,采用ELISA的方法测定花生中的黄曲霉毒素的含量。收获的花生经室温保存半年后,提取黄曲霉毒素,ELISA方法测定黄曲霉毒素的含量[11-12]。图9可见,使用M1孢子的花生收获后黄曲霉毒素比未使用M1孢子的花生中黄曲霉毒素的含量低。储存半年后,使用M1黄曲霉菌孢子的花生黄曲霉毒素的含量增加到9 ng/μL,含量较低;而未使用的花生储存半年后黄曲霉毒素的含量达到了34 ng/μL,已经超过了限量。证明M1黄曲霉菌可用于花生的黄曲霉毒素污染的生物防控。

图7 不产毒黄曲霉菌M1的黄曲霉毒素含量HPLC检测曲线图

图9 使用及未使用M1孢子花生黄曲霉毒素含量变化 Fig.9 Changes in aflatoxin content of peanuts used and not used in M1 spores
3 结 论
本研究筛选出一种不产黄曲霉毒素的黄曲霉菌(该黄曲霉菌的保藏编号为CGMCC NO. 14122,保藏日期为20170510),该黄曲霉菌的AflR基因启动子序列发生了缺失突变,可能与其不能产生黄曲霉毒素相关。该黄曲霉菌能够与产毒的黄曲霉菌在土壤中展开定植竞争,而且本研究提供的黄曲霉菌在土壤中适应能力强,具有较好的生存和繁殖能力,可以减轻产毒的黄曲霉菌对农作物和贮存农作物的感染,显著降低农作物产物和贮存农作物中黄曲霉毒素的含量,具有发展成为控制黄曲霉毒素污染的生物农药的巨大潜力,对于保证易感农产品的安全,保障广大消费者的身体健康具有重要意义。

