PEG修饰Fe3O4纳米粒子(MNPs)的制备及催化氧化VB1研究
刘泓,毛祥双,刘欢,舒玥,黄凤颖,杨琳燕
PEG修饰Fe3O4纳米粒子(MNPs)的制备及催化氧化VB1研究
刘泓,毛祥双,刘欢,舒玥,黄凤颖,杨琳燕通信作者
(天津农学院 动物科学与动物医学学院,天津 300384)
维生素B1(VB1)对人体正常生理功能起着重要作用,缺乏VB1会导致人体出现多种疾病。某些温和的氧化剂可将VB1氧化为含有荧光的硫色素,硫色素在紫外光照射下发出荧光,其荧光强度与VB1浓度成正比。本文首先制备Fe3O4纳米粒子(MNPs),通过优化实验条件,制备Fe3O4@SiO2、Fe3O4@SiO2-NH2纳米粒子,对Fe3O4@SiO2-NH2样品进行双端羧基PEG修饰,得到Fe3O4@SiO2-NH2-PEG-COOH样品,设置3种不同的试验条件,利用PEG修饰产物催化VB1为有荧光的硫色素,再经荧光分光光度计检测。研究结果表明,PEG修饰的Fe3O4MNPs在不同H2O2浓度、不同温度及不同纳米粒子浓度时均可催化VB1反应,产生荧光硫色素,但效果均不明显,而Fe3O4对温度和纳米粒子浓度的反应较大。
Fe3O4;PEG修饰;VB1;催化氧化
Fe3O4是由Fe2+、Fe3+、O2-通过离子键组成的复杂离子晶体,为尖晶石型铁氧体[1-2]。纳米Fe3O4是最常见的磁性纳米材料之一,在磁记录、颜料、磁流体、医药、催化、电子、生物医学等领域具有广阔的应用前景[3-4]。目前,制备Fe3O4纳米粒子的传统方法是共沉淀法,但由于Fe2+容易被空气氧化,为了得到纯的Fe3O4,在制备过程中需要严格控制溶液的pH值,同时为了使Fe2+和Fe3+按化学计量比反应,需要用惰性气体保护反应体系[5-10],因此该方法的工艺比较复杂。
具有类过氧化物酶活性的纳米颗粒能催化过氧化物酶的底物和H2O2生成具有特征颜色的氧化产物,由于其类过氧化物酶的催化活性与H2O2浓度具有相关性,据此可以依据颜色(吸光度)的变化检测H2O2的浓度。Wei等[11]以ABTS为显色底物,基于Fe3O4MNPs的类过氧化物酶活性建立了一种可视化检测H2O2的新方法。随后,Chang等[12]基于Fe3O4MNPs类过氧化物酶的性质建立了检测雨水、蜂蜜以及牛奶等实际样品中H2O2的新方法。
Fe3O4MNPs的类过氧化物酶活性是其首先催化H2O2分解为·OH,·OH再将过氧化物酶底物氧化为具有特征颜色的氧化产物。而·OH可使CdTe量子点、罗丹明B的荧光信号猝灭。依据此原理,Gao等[13]用Fe3O4MNPs、CdTe量子点建立了一种荧光检测H2O2的新方法;随后,Jiang等[14]以Fe3O4MNPs、罗丹明B建立了检测H2O2的荧光新方法,检测限为5.8×10-9mol/L。
VB1在人体正常生理生化过程中起着很重要的作用,若人体缺乏VB1,就会产生体内丙酮中毒及神经组织受损而引起神经炎和脚气病。VB1传统的荧光分析方法是铁氰化钾氧化-异丁醇萃取法[15],操作较为繁琐。近年来发展起来的采用某些温和氧化剂,将VB1氧化为具有荧光的硫色素,直接进行荧光分析的方法是测定VB1较有效的荧光分析方法[16]。
本文采用FeCl2,FeCl3和NaOH在氮气的保护作用下,水浴加热同时磁力搅拌产生Fe3O4,后用原硅酸四乙酯(TEOS)对其表面进行包覆,得到Fe3O4@SiO2样品,再用3-氨丙基三甲氧基硅烷(APTMS)对其表面进行修饰,得到Fe3O4@SiO2- NH2样品,后经双端羧基PEG修饰,得到最终产物PEG修饰的Fe3O4@SiO2-NH2-PEG-COOH MNPs。产物与H2O2结合,在不同条件下催化VB1产生含荧光的硫色素。
1 材料与方法
1.1 试剂和仪器
试剂:无水乙醇(天津市康科德科技有限公司);原硅酸四乙酯(TEOS);3-氨丙基三甲氧基硅烷(APTMS);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC);N-羟基琥珀酰亚胺(NHS,上海源叶生物有限公司);双羧基聚乙二醇(CM-PEG-CM,Mw2000,上海金畔生物技术有限公司)。
仪器:超声波清洗机(宁波新芝生物科技股份有限公司,SB-100D);水浴恒温摇床(上海达平仪器有限公司,SKY-110WX);真空干燥箱(上海一恒科学仪器有限公司);磁力搅拌器(北京中兴伟业仪器有限公司);荧光分光光度计(美国VARIAN公司,Cary Eclipse)。
1.2 Fe3O4的制备
将7.5 mL 0.12 mol/L FeCl2和7.5 mL 0.2 mol/L FeCl3加入100 mL三颈瓶中,混匀,加热至55 ℃,磁力搅拌15 min后,快速加入7.2 mL 3 mol/L NaOH溶液,同时快速磁力搅拌,反应40 min 后,形成的黑色流体加热至90 ℃,30 min后,冷却至室温,将样品放入50 mL塑料离心管中,置于强力磁铁上,磁铁吸附,弃去上清液,超纯水洗涤沉淀物多次,直至pH呈中性,弃去上清液,置于真空干燥箱中,烘干。
1.3 Fe3O4@SiO2的制备
称取10 mg干燥Fe3O4样品,分别称取10 份,依次放入50 mL塑料离心管中,每管中加入2 mL0.1 mol/L的稀盐酸,超声震动20 min使其充分混合,后置于磁铁上,磁铁吸附,弃去上清液,后超纯水洗涤沉淀物。再向每管沉淀物中加入20 mL无水乙醇,5 mL超纯水,0.25 mL氨水,超声震动20 min使其充分混合,之后向每管加入32 μL原硅酸四乙酯(TEOS),将其放入摇床,室温震荡6 h。取出后置于磁铁上,磁铁吸附,吸去上清液,用无水乙醇洗涤沉淀物,得到样品。
1.4 Fe3O4@SiO2-NH2的制备
磁铁吸附,弃去上述样品中的无水乙醇,再向每管样品中加入4 mL无水乙醇,然后加入50 μL 3-氨丙基三甲氧基硅烷(APTMS),超声震荡30 min使其充分混合,后放入摇床,室温震荡24 h,得到样品Fe3O4@SiO2-NH2后磁铁吸附,吸去上清液,用无水乙醇洗涤沉淀物一次,后放入真空干燥箱中干燥。
1.5 Fe3O4@SiO2-NH2-PEG-COOH的制备
将双羧基聚乙二醇(0.2 g,0.1 mmol)溶于2.5 mL MES(0.1 mol/L, pH 6)中,加入EDC·HCl(0.038 3 g,0.2 mmol)超声30 min,后加入NHS (0.023 g,0.2 mmol)超声30 min,置于摇床中,过夜活化。将Fe3O4@SiO2-NH2浸入其中,每管20 mg,超声30 min使其充分混合后,放入摇床中,过夜活化。置于磁铁上,弃去上清液,使用超纯水洗涤一次,将其置于真空干燥箱中,过夜干燥。得到样品,留样用于XPS表征。
1.6 催化氧化VB1研究
使用Fe3O4和Fe3O4@SiO2-NH2-PEG-COOH两种样品,在不同条件下与VB1进行反应,催化VB1产生有荧光的硫色素。采用荧光分光光度计进行检测,判断不同环境下催化VB1的不同效果。
1.6.1 Fe3O4@SiO2-NH2-PEG-COOH催化氧化VB1反应的研究
来自H2O2浓度的影响:将120 μL的Fe3O4@SiO2-NH2-PEG-COOH(1 500 μg/mL)悬浮液分别置于5个10 mL离心管中,分别在每管中加入2.7 mL PBS缓冲液(pH=11)和不同浓度的H2O2(20、40、60、80、100 μL),完成后,再向每管中分别加入80 μL VB1溶液(0.2 mmol/L),剩余部分用PBS补足至3 mL。室温搅拌1 h,使其充分反应。后用磁铁吸附,将沉淀物与上清液分离,分别置于不同离心管中,并做好对应的标记。上清液作为样品冷藏保存。
来自纳米复合材料浓度的影响:取10 mL离心管5 个,每管中加入2.7 mL PBS缓冲液(pH=11),分别在每管中加入120 μL不同浓度的样品溶液(3 000.0、1 500.0、750.0、375.0、187.5 μg/mL),再向每管中加入60 μLH2O2,40 μL超纯水,80 μL VB1溶液(0.2 mmol/L),室温搅拌1 h,使其充分反应。后用磁铁吸附,将沉淀物与上清液分离,分别置于不同离心管中,并做好对应的标记。上清液作为样品冷藏保存。
来自温度的影响:将120 μL的Fe3O4@SiO2- NH2-PEG-COOH(1 500 μg/mL)悬浮液分别置于5个10 mL离心管中,分别在每管中加入2.7 mL PBS缓冲液(pH=11),再向每管中加入60 μL H2O2,40 μL超纯水,80 μL VB1溶液(0.2 mmol/L),每管分别在25、35、45、55、65 ℃下水浴加热20 min,后取出,用磁铁吸附,将沉淀物与上清液分离,分别置于不同离心管中,并做好对应的标记。上清液作为样品冷藏保存。
1.6.2 Fe3O4催化氧化VB1反应的研究
来自H2O2浓度的影响:将120 μL的Fe3O4(1 500 μg/mL)悬浮液分别置于5个10 mL离心管中,分别在每管中加入2.7 mL PBS缓冲液(pH=11)和不同浓度的H2O2(20、40、60、80、100 μL),完成后,其余步骤与之前Fe3O4@ SiO2-NH2-PEG- COOH在不同H2O2浓度下催化VB1步骤相同。
来自纳米复合材料浓度的影响:取10 mL离心管5 个,每管中加入2.7 mL PBS缓冲液(pH=11),分别在每管中加入120 μL不同浓度的样品溶液(3 000.0、1 500.0、750.0、375.0、187.5 μg/mL),其余步骤与之前Fe3O4@ SiO2-NH2-PEG-COOH在不同纳米复合材料下催化VB1步骤相同。
来自温度的影响:将120 μL的Fe3O4(1 500 μg/mL)悬浮液分别置于5个10 mL离心管中,其余步骤与之前Fe3O4@SiO2-NH2-PEG-COOH在不同温度下催化VB1步骤相同。
2 结果与分析
2.1 XPS分析
修饰前后样品的扫描全谱见图1。由表1结合图2的N1s谱可知,399.255 eV (C-N)和400.247 eV(-NH2)峰的出现,表明APTMS修饰成功。表1结合图5的C1s谱,287.722 eV峰出现(COO/ CO-NH),原子百分含量为9.35%,意味着PEG修饰是成功的。表1结合图4的N1s谱,401.108 eV峰出现(CO-NH),原子百分含量为55%,同样意味着PEG修饰是成功的。因此,Fe3O4@SiO2-NH2和Fe3O4@SiO2-NH2-PEG-COOH纳米粒子的N1s谱和C1s谱说明APTMS和PEG修饰成功(图2~图5)。

图1 XPS扫描全谱

图2 Fe3O4@SiO2-NH2的N1s谱
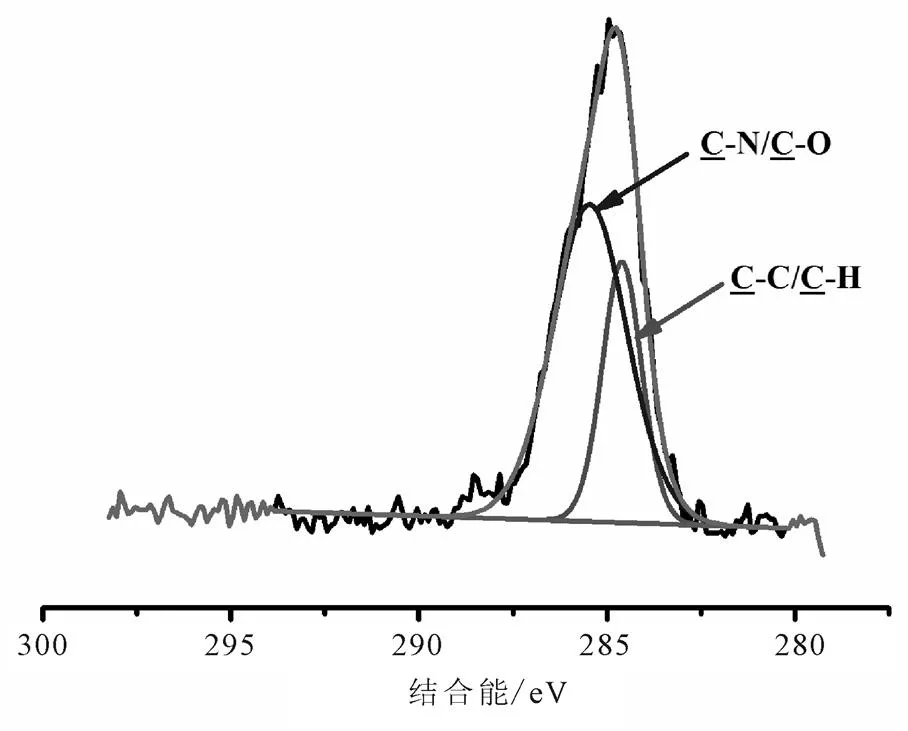
图3 Fe3O4@SiO2-NH2的C1s谱
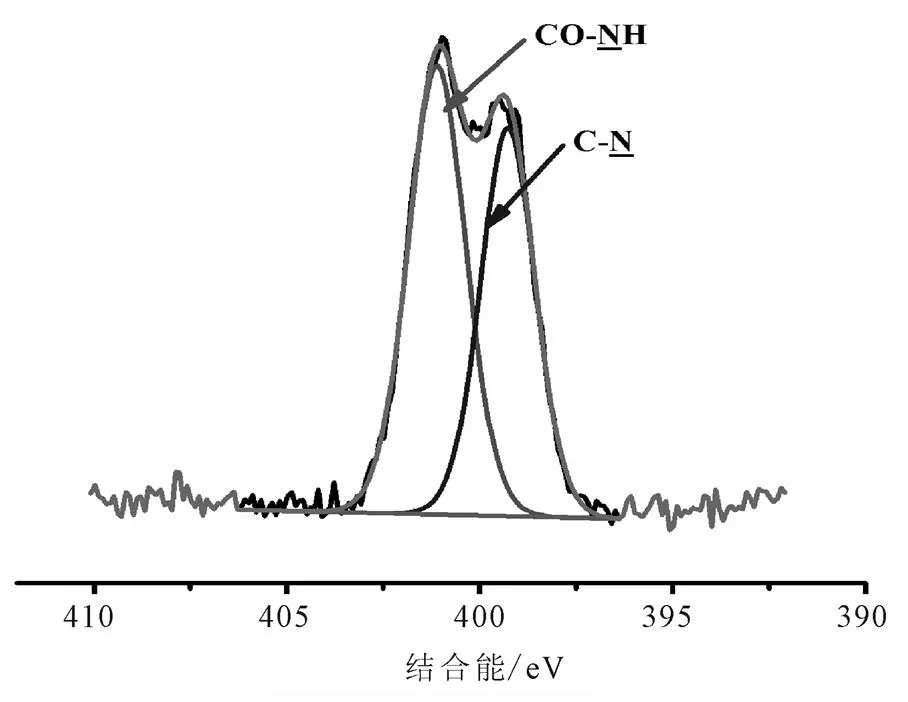
图4 Fe3O4@SiO2-NH2-PEG-COOH的N1s谱
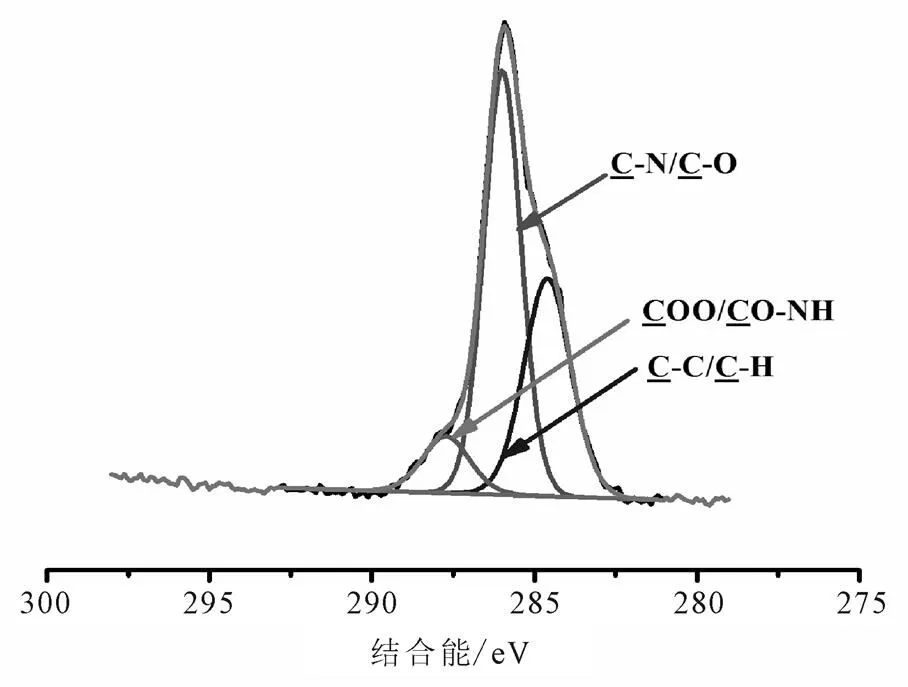
图5 Fe3O4@SiO2-NH2-PEG-COOH的C1s谱
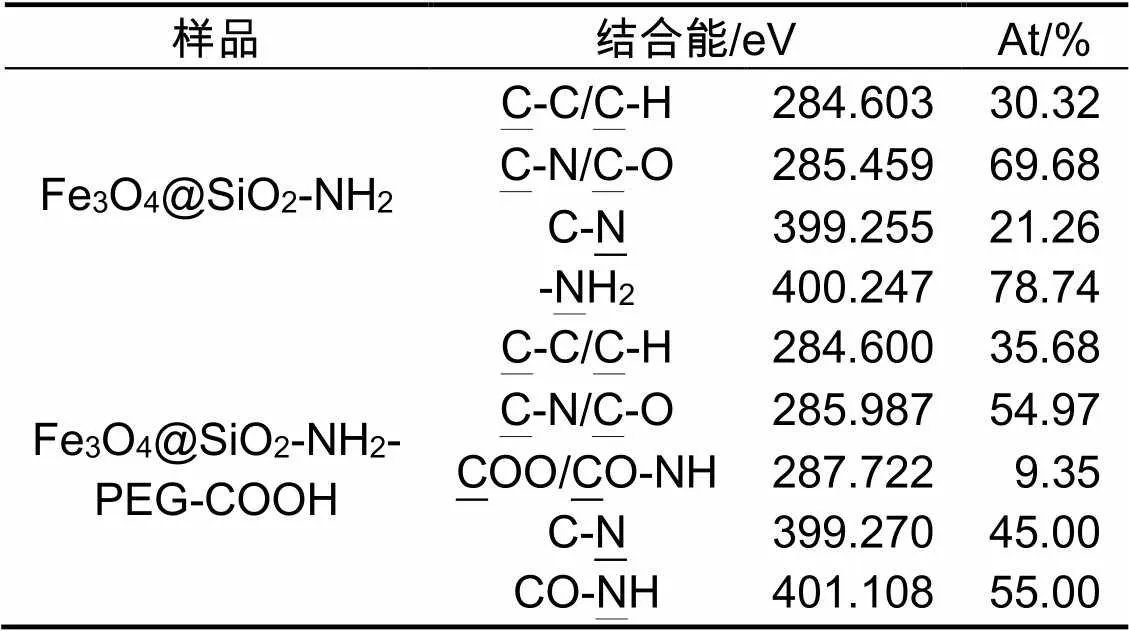
表1 修饰前后材料的结合能和元素比例
2.2 来自纳米粒子浓度影响的研究
利用荧光分光光度计,激发波长λex=332 nm,狭缝宽10 nm,进行VB1的测定,结果见图6、图7。
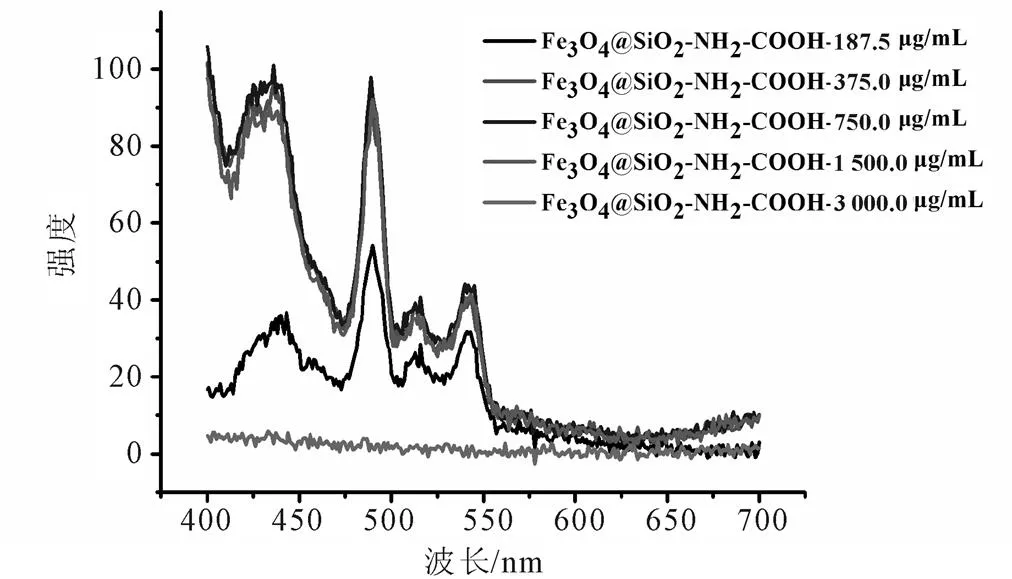
图6 Fe3O4@SiO2-NH2-PEG-COOH在不同浓度(187.5~3 000.0 μg/mL)时与VB1产生荧光硫色素的数据曲线图
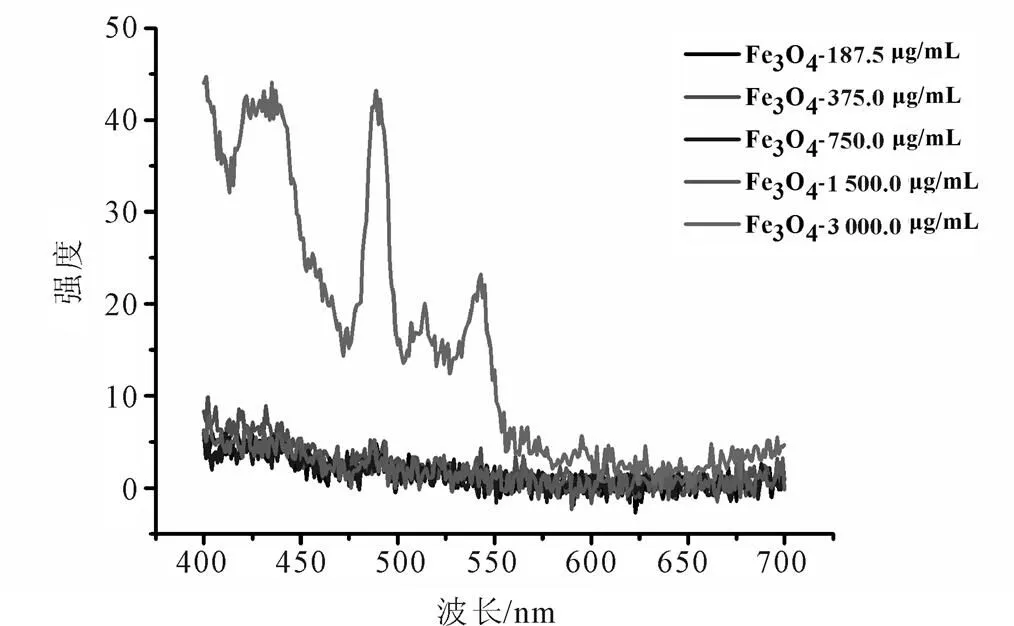
图7 Fe3O4在不同浓度(187.5~3 000.0 μg/mL)时与VB1产生荧光硫色素的数据曲线图
在纳米粒子浓度影响的研究中,根据图6表明,Fe3O4@SiO2-NH2-PEG-COOH在浓度为187.5~1 500.0 μg/mL中均有峰值,表明在这4个浓度时,样品均与VB1反应,产生荧光硫色素,但4个峰值差别不大,表明以上4种浓度对产生荧光硫色素的影响不明显。在3 000.0 μg/mL的浓度时并未检测到峰值,原因可能为样品浓度过大,产生荧光淬灭。总体来说,在样品含量为1 500.0 μg/mL时,峰值较好,后续试验以此浓度为标准。根据图7表明,Fe3O4在浓度为187.5~1 500.0 μg/mL时,均未产生峰值,即未与VB1产生荧光硫色素。在浓度为3 000.0 μg/mL时,产生峰值,即与VB1产生荧光硫色素,说明浓度对Fe3O4与VB1反应有影响。
2.3 来自H2O2浓度影响的研究
利用荧光分光光度计,在激发波长λex=332 nm、狭缝宽为10 nm时进行VB1的测定,结果见图8、图9。
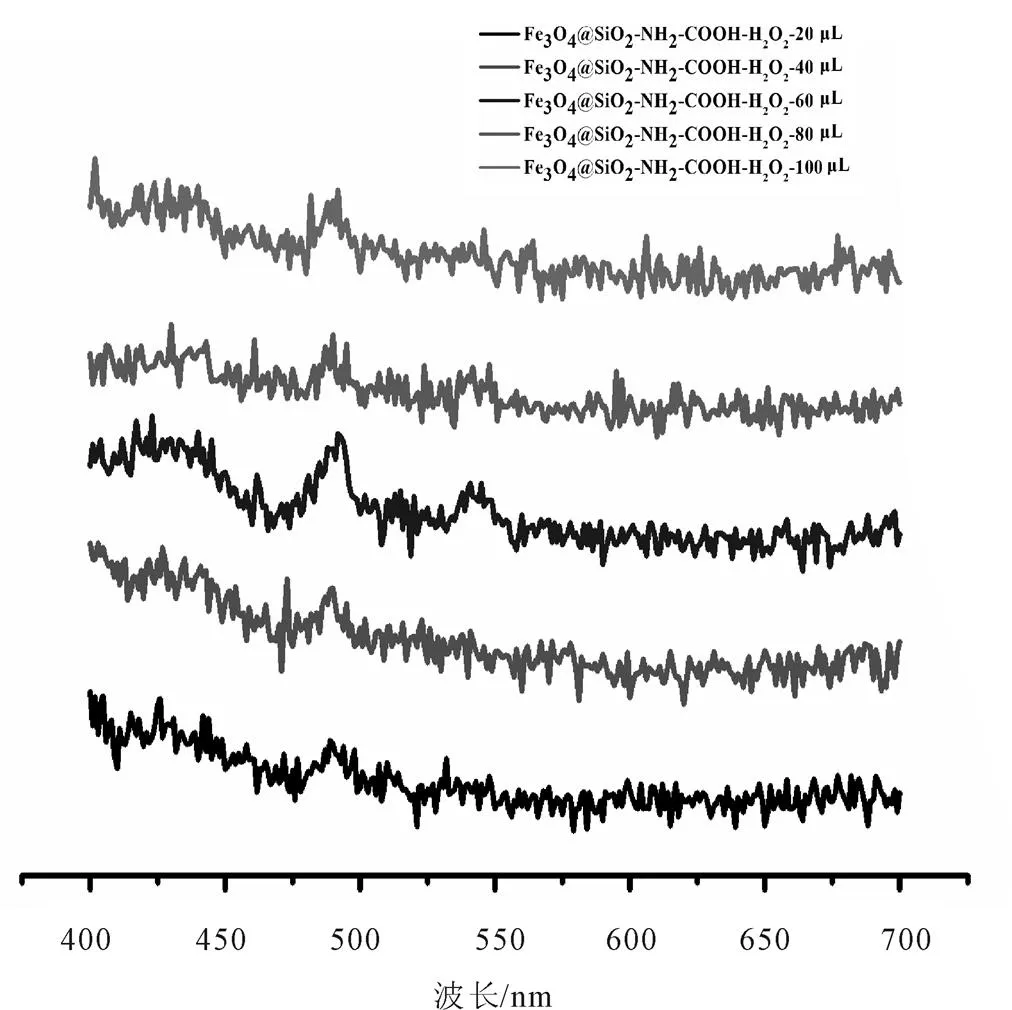
图8 Fe3O4@SiO2-NH2-PEG-COOH在不同H2O2浓度(20~100 μL)时与VB1产生荧光硫色素的数据曲线图
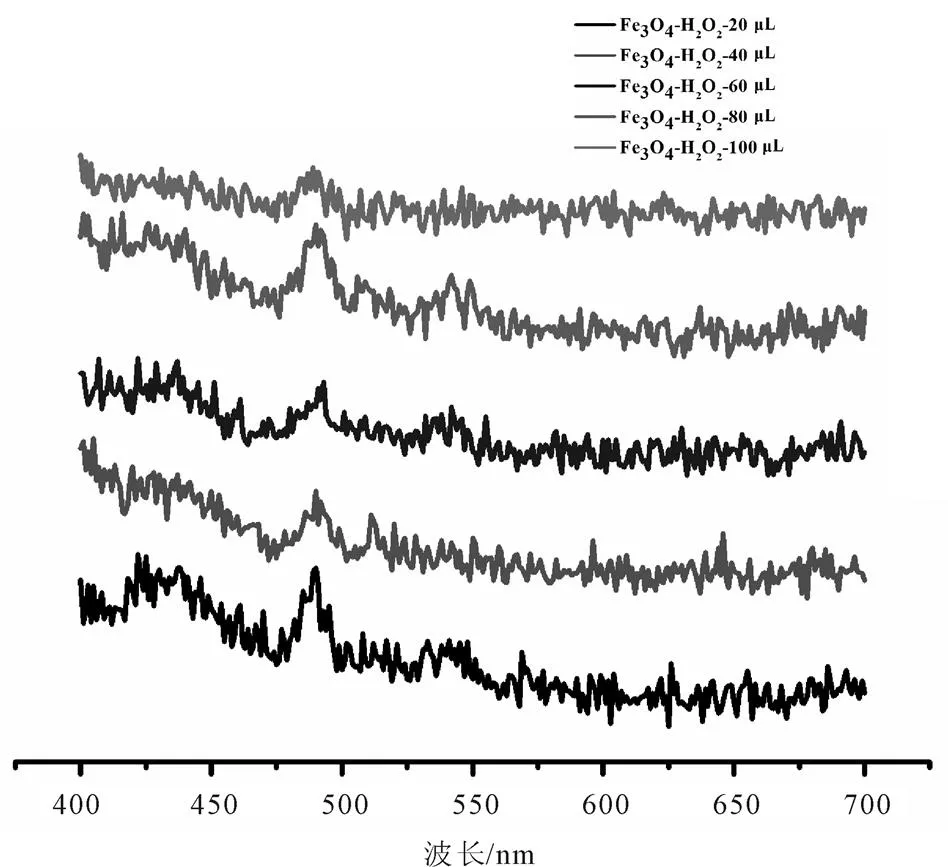
图9 Fe3O4在不同H2O2浓度(20~100 μL)时与VB1产生荧光硫色素的数据曲线图
在H2O2浓度影响的研究中,根据图8表明,Fe3O4@SiO2-NH2-PEG-COOH在H2O2浓度为20~100 μL中,60 μL时峰值较明显,说明在H2O2浓度为60 μL时与VB1产生荧光色素的反应较明显,其余浓度也有峰值,但峰值较微弱且总体差别不大。结果表明不同浓度的H2O2对Fe3O4@SiO2-NH2- PEG-COOH与VB1的反应有影响。根据图9表明,Fe3O4在H2O2浓度为20~100 μL中,20 μL时峰值较明显,说明该浓度下的反应较强烈,其余浓度虽均有峰值,但峰值较微弱且总体差别不大。结果表明不同浓度的H2O2对Fe3O4与VB1的反应也有影响,但此条件对两种样品的影响并不明显。
2.4 来自温度影响的研究
利用荧光分光光度计,在激发波长λex=332 nm、狭缝宽为10 nm时进行VB1测定,结果见图10、图11。

图10 Fe3O4@SiO2-NH2-PEG-COOH在不同温度(25~65 ℃)时与VB1产生荧光硫色素的数据曲线图

图11 Fe3O4在不同温度(25~65 ℃)时与VB1产生荧光硫色素的数据曲线图
在温度影响的研究中,根据图10表明,Fe3O4@SiO2-NH2-PEG-COOH在温度为25~65 ℃中,45 ℃时产生较明显峰值,其余温度下均有峰值,但峰值较弱,总体差别不大。说明在45 ℃时,Fe3O4@SiO2-NH2-PEG-COOH与VB1反应效果较好。根据图11表明,Fe3O4在温度为25~65 ℃中,在45 ℃时,峰值最明显,反应效果最好。其余温度虽有峰值,但较微弱。结果说明,温度对Fe3O4与VB1反应有较强烈的影响。
3 结论
通过实验表明,Fe3O4@SiO2-NH2-PEG-COOH在H2O2存在的条件下均可成功催化VB1产生荧光硫色素。不同浓度的H2O2对Fe3O4@SiO2-NH2-PEG- COOH催化VB1产生的影响并不明显,根据数据得知在H2O2浓度为60 μL时,对VB1影响较明显,但与其他浓度相比总体差别不大;而Fe3O4在H2O2浓度为 20 μL时,效果较明显,但总体差别不大。以此判断,H2O2的浓度对Fe3O4@SiO2-NH2-PEG- COOH和Fe3O4催化VB1并无较大影响。在不同纳米粒子浓度时,1 500.0 μg/mL浓度的Fe3O4@SiO2- NH2-PEG-COOH产生的峰值较其他浓度时产生的峰值明显,在3 000.0 μg/mL浓度时,因浓度过大,产生荧光猝灭,未产生峰值;而3 000.0 μg/mL浓度的Fe3O4反应效果明显,产生峰值,其余浓度的Fe3O4均未产生峰值。由此判断,不同纳米粒子浓度对Fe3O4@SiO2-NH2-PEG-COOH和Fe3O4催化VB1均有影响,且对Fe3O4影响较大。在温度为45 ℃时,Fe3O4@SiO2-NH2-PEG-COOH产生较明显峰值,其余温度虽有峰值,但总体偏弱;而在45 ℃时,Fe3O4峰值最明显,其余温度下也均有峰值。由此判断,不同温度对Fe3O4@SiO2-NH2-PEG- COOH和Fe3O4催化VB1均有影响,但对Fe3O4影响最大。
[1] 宋丽贤,卢忠远,刘德春,等. 分解沉淀法制备磁性纳米Fe3O4的研究及表征[J]. 化工进展,2006,25(1):54-57.
[2] 聂阳,王永花,胡良锋,等. Fe3O4@SiO2-NH2磁性复合材料对水中全氟化合物的检测研究[J]. 分析测试学报,2016(1):1-7.
[3] 赵志伟,师杰,刘杰. 高pH条件纳米Fe3O4催化H2O2分解去除水中4-氯酚[J]. 后勤工程学院学报,2015,31(4):11-15.
[4] 付佳. 溶剂热法制备纳米四氧化三铁研究[D]. 西安:西安建筑科技大学,2007.
[5] 张鑫,李鑫钢,姜斌. 四氧化三铁纳米粒子合成及表征[J].化学工业与工程,2006,23(1):45-48.
[6] Xu J,Yang H B,Fu W Y. Preparation and magnetic properties of magnetite nanoparticles by sol-gel method[J]. J Magn Magn Mater,2007,309(2):307-311.
[7] Asuha S,Zhao S,Wu H Y,et al. One step synthesis of maghemite nanoparticles by direct thermal decomposition of Fe-urea complex and their properties[J]. Journal of Alloys and Compounds,2009,472:L23-L25.
[8] Fan R,Chen X H,Gui Z,et al. A new simple hydrothermal preparation of nanocrystalline magnetite Fe3O4[J]. Materials Research Bulletin,2001,36:497-502.
[9] Zhou Z H,Wang J,Chan H S,et al. Synthesis of Fe3O4nanoparticles from emulsion[J]. J Mater Chem,2001,11:1704-1709.
[10] Zhao S,Wu H Y,Song L,et al. Preparation of γ-Fe2O3Nanopowders by direct thermal decomposition of Fe-urea complex:Reaction mechanism and magnetic properties[J]. Journal of Materials Science,2009,44:926-930.
[11] Wei H,Wang E. Fe3O4magnetic nanoparticles as peroxidase mimetics and their applications in H2O2and glucose detection[J]. Analytical Chemistry,2008,80(6):2250-2254.
[12] Chang Q,Deng K,Zhu L,et al. Determination of hydrogen peroxide with the aid of peroxidase like Fe3O4magnetic nanoparticles as the catalyst[J]. Microchimica Acta,2009,165(3-4):299-305.
[13] Gao Y,Wang G,Huang H,et al. Fluorometric method for the determination of hydrogen peroxide and glucose with Fe3O4as catalyst[J]. Talanta,2011,85(2):1075-1080.
[14] Jiang Z,Kun L,Ouyang H,et al. A simple and sensitive fluorescence quenching method for the determination of H2O2using rhodamine B and Fe3O4nanocatalyst[J]. Journal of fluorescence,2011,21(5):2015-2020.
[15] 王益林,韦月早,莫利书,等. 荧光光度法测定花生和黄豆中的维生素B1[J]. 广西大学学报,2009,34(1):60-62.
[16] Bardajee G R,Hooshyar Z. A novel bliocompatible magnetic iron oxide nanoparticles/hydrogel based on poly(acrylic acid)grafted onto starch for controlled drug release[J]. J Polym Res,2013,20:298.
责任编辑:张爱婷
Studies on catalytic oxidation of VB1by PEG modified Fe3O4nanoparticles
LIUHong, MAO Xiang-shuang, LIU Huan, SHU Yue, HUANG Feng-ying, YANG Lin-yanCorresponding Author
(College of Animal Science and Veterinary Medicine, Tianjin Agricultural University, Tianjin 300384, China)
VB1plays an important role in the normal life of human body. Relevant literature suggest that VB1could be oxidized to sulfur containing fluorescent pigment by some mild oxidant. Sulfur fluorescent dyes could fluoresced under UV irradiation, and the fluorescence intensity is proportional to the concentration of VB1. In this study, Fe3O4, Fe3O4@SiO2and Fe3O4@ SiO2-NH2MNPs were prepared. Fe3O4@SiO2-NH2-PEG-COOH MNPs could be prepared by Fe3O4@SiO2-NH2MNPsvia PEG modification. Under three different test conditions, VB1could be oxidized by Fe3O4@SiO2-NH2-PEG-COOH MNPs, and the obtained sulfur fluorescent dyes could be detected by fluorescence spectrophotometer. The results showed that VB1could be catalyzed by the PEG modified Fe3O4MNPs in different H2O2concentration, different temperatures and different concentration of nanoparticles and produce fluorescent sulfur pigment, but the effect is not obvious. As for Fe3O4, response to temperature and concentration of nanoparticles is big.
Fe3O4; PEG modification; VB1; catalytic oxidation
1008-5394(2018)04-0038-06
10.19640/j.cnki.jtau.2018.04.009
O656.22
A
2018-06-06
天津校级大学生创新创业训练计划项目(201810061120);国家自然科学基金(31572492,31372482);天津市教委科研计划项目(2017KJ190);省部共建药用资源化学与药物分子工程国家重点实验室资助课题(CMEMR2016-B12);天津农学院杰出科研业绩奖励资助项目(无编号)
刘泓(1996-),女,本科在读,主要从事纳米药物载体研究。E-mail:1460300805@qq.com。
杨琳燕(1982-),女,讲师,博士,主要从事纳米药物载体研究。E-mail:y_linyan@163.com。

