百合鳞片褐变过程中膜脂过氧化研究
阚 娟,万 冰,解王晶,陈翠翠,刘 俊,金昌海*
(扬州大学食品科学与工程学院,江苏 扬州 225127)
百合是我国卫生部审批通过的首批药食兼用资源,其食用价值和药用价值日益受到海内外消费者的重视,有很高的市场价值。百合鳞片由许多肉质鳞片组成,鳞片肥厚、营养丰富,具有芳香气味与微苦滋味,能刺激食欲、帮助消化[1]。但是百合在采后贮藏过程中极易发生褐变[2-3]。Aguilera等[4]提出细胞膜是一种半透性膜,维持着细胞内外渗透压的平衡,当膜结构遭到破坏时,细胞的区室化被破坏,细胞内容物渗出,使底物渗出,并与酶反应导致褐变。Purev等[5]研究发现,在干旱、光照、重金属及高渗透压等逆境下,植物体内过氧化氢酶(catalase,CAT)的表达量及活性都有所提高,说明CAT在植物抗逆方面发挥着重要作用。Siedow[6]通过研究发现,过量的H2O2会对果实细胞产生伤害。脂氧合酶(lipoxygenase,LOX)启动并参与膜系统的脂质过氧化进程,加剧细胞膜的降解[7]。超氧化物歧化酶(superoxide dismutase,SOD)能够缓解膜脂过氧化反应中代谢产物丙二醛(malondialdehyde,MDA)的积累以及使细胞膜通透性增加,促使果蔬形成防御结构,提高果蔬抗性[8-9]。目前国内外对百合鳞片的研究主要在生物活性和抗氧化等方面[10-12],对百合鳞茎贮藏过程中褐变的研究主要集中在褐变相关酶类,如有研究认为百合褐变与多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)活性密切相关[13]。对膜脂过氧化与百合鳞茎褐变之间关系的研究还少有报道,对于百合鳞茎不同层面鳞片贮藏过程中褐变与膜脂过氧化之间的关系研究也鲜见报道。
本研究以宜兴卷丹百合作为实验材料,对新鲜的百合进行剥片处理并分成外层、中层、内层3 部分,并避光贮藏于4 ℃环境中,研究了百合鳞片在贮藏过程中褐变及膜脂过氧化相关指标,为进一步了解百合鳞片褐变与膜脂过氧化之间的关系以及深入研究百合鳞片的褐变机制提供一定的实验依据。
1 材料与方法
1.1 材料与试剂
本实验以宜兴卷丹百合(Lilium lancifolium Thunb.)为材料,采自宜兴市百合种植基地。
二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒上海碧云天生物技术有限公司;其他试剂均为分析纯,购自生工生物工程(上海)股份有限公司。
1.2 仪器与设备
Lambda 35紫外-可见分光光度计 美国Perkinelmer公司;PT-MR-2100高速组织匀浆机 瑞士Kinematica公司;5804R高速冷冻离心机 德国Eppendorf公司;SHJ-A6磁力搅拌恒温水浴锅 上海比朗仪器有限公司;CX41RF显微镜 日本OLYMPUS公司。
1.3 方法
1.3.1 原料处理
采收大小、果色均匀、成熟度基本一致、无机械损伤和病虫害的产品。采后即刻运往实验室,对新鲜百合鳞片进行剥片处理,选择无明显机械损伤、无虫害的百合鳞片,将百合鳞片分为外、中、内3 部分,外层即从外向内数1~3 层,内层即由内向外数1~3 层,其余为中层,避光贮藏于4 ℃冰箱中,并于贮藏的第0、3、6、9、12、15天分别取样测定。
1.3.2 表观变化的记录和细胞活力的测定
贮藏过程中每隔3 d取大小相近的各层百合鳞片置于白纸上拍照记录表观变化情况。
细胞活力的测定参照Heese等[14]的方法略作修改。随机取外、中、内百合样品,切成1 mm左右厚的薄片浸入台盼蓝染液中(V(台盼蓝)∶V(乙醇)∶V(水)∶V(乳酸)∶V(甘油)∶V(苯酚)=0.067∶1∶1∶1∶1∶1),沸水浴加热2 min使切片快速染色。冷却后,将切片浸入适量2.5 g/mL三氯乙醛溶液中,振动脱色过夜。将脱色完成的切片浸入体积分数60%甘油溶液中,用显微镜观察并采集图片。
1.3.3 褐变度、细胞膜透性和呼吸强度的测定
褐变度的测定按照K u m a r等[15]的方法,以10×OD420nm表示。
细胞膜透性的测定按照Zhang Zhengke等[16]的方法,用相对渗透率表示百合鳞片细胞膜透性,具体计算见下式。

呼吸强度的测定按照Grozeff等[17]的方法,以每小时每千克新鲜组织吸收CO2的质量表示。
1.3.4 内源POD活力的测定
内源POD活力用二氨基联苯胺DAB显色试剂盒测定,显微镜观察和采集图片。
1.3.5 H2O2含量和超氧阴离子自由基(O2-·)产生速率的测定
H2O2含量的测定按照Liu Hong等[18]的方法,H2O2的含量以每克新鲜组织含有的H2O2物质的量表示;·产生速率的测定按照Ren Chunguang等[19]的方法,以每分钟每克新鲜组织催化羟胺生成NaNO2的物质的量表示·产生速率。
1.3.6 MDA含量和LOX活力的测定
MDA含量测定按照Gao Hui等[20]的方法,单位为µmol/g;LOX活力的测定按照Wang Jinghua等[21]的方法,LOX活力以每分钟每毫克蛋白引起234 nm波长处吸光度增加0.01为1 个酶活力单位(U)。1.3.7 SOD、CAT活力的测定
SOD活力的测定按照Mahdavian等[22]的方法,1 个SOD活力单位(U)定义为每克新鲜组织每分钟对氮蓝四唑光化还原抑制为50%时消耗的酶量;CAT活力的测定按照Bailly等[23]的方法,以每分钟每毫克蛋白引起240 nm波长处吸光度减少0.1表示1 个酶活力单位(U)。
1.4 数据处理
所有实验取样重复3 次,通过SPSS 17.0软件对数据进行方差分析,Duncan法进行显著性检验,P<0.05表示差异显著。
2 结果与分析
2.1 不同部位的百合鳞片在贮藏过程中表观和细胞活力的变化

图1 不同部位的百合鳞片在贮藏过程中细胞活力的变化Fig.1 Change in cell activity in different parts of lily bulbs during storage
检测细胞活力最常用的染色试剂是台盼蓝,未受损的细胞其膜结构完整、活力强,细胞质内不沉淀台盼蓝;而受损甚至死亡的细胞,膜结构被破坏,活力降低,则台盼蓝堆积在细胞内。由图1可以看出,随贮藏时间延长,各层百合鳞片的活细胞数量均逐渐减少,但相同贮藏时间的中层鳞片活细胞数量比外层和内层多,细胞活力较强,与图2表观变化结果一致。

图2 不同部位的百合鳞片在贮藏过程中的表观变化Fig.2 Change in appearance of different parts of lily bulbs
2.2 不同部位的百合鳞片在贮藏过程中褐变度、细胞膜相对渗透率和呼吸强度的变化
从图3A可以看出,各层百合鳞片的褐变度都随着贮藏时间的延长呈现明显的增长趋势,在0~3 d内各层百合鳞片的褐变度变化不显著(P>0.05),但是3 d之后呈显著性增加。中层百合鳞片褐变度在贮藏过程中总体低于外层和内层鳞片,与表观变化结果一致。
从图3B可以看出,随着贮藏时间的延长,各层百合鳞片的相对渗透率都呈现增长趋势,但是中层百合鳞片相对渗透率始终低于外层和内层鳞片。除了第6、9天外层和中层百合鳞片相对渗透率差异不显著外(P>0.05),在其他贮藏时间各层均呈现显著性差异。尤其12~15 d时,相对渗透率迅速升高,15 d时内层鳞片相对渗透率达到23.97%,是中层鳞片(15.78%)的1.52 倍。在贮藏过程中,中层百合鳞片细胞膜损伤程度较轻,与细胞活力和褐变度变化结果一致。
从图3C可以看出,不同层的百合鳞片在贮藏过程中呼吸强度随着贮藏时间的延长呈现不断增长的趋势,中层鳞片增长速率较为缓慢,始终低于外层和内层。贮藏当天各层百合鳞片呼吸强度无显著性差异,第3天和第15天外层和内层无显著性差异,但中层显著低于外层和内层,6~12 d期间各层鳞片呼吸强度呈显著性增加,可能是采后贮藏期间营养成分的消耗所致。呼吸强度的变化与褐变度及细胞膜透性变化结果一致。

图3 不同部位百合鳞片在贮藏过程中褐变度(A)、相对渗透率(B)、呼吸强度(C)的变化Fig.3 Changes in browning degree (A), relative permeability (B) and respiration intensity (C) in different parts of lily bulbs during storage
2.3 不同部位的百合鳞片在贮藏过程中内源POD活力的变化
DAB显色试剂盒测定内源POD的活力时,棕褐色沉淀的量反映了内源POD的活力,颜色越深表示POD活力越强。由图4可以看出,在贮藏过程中,随着贮藏时间的延长,各层百合鳞片细胞内的棕褐色沉淀先增加后减少,表明内源POD活力先升高后降低,贮藏过程中中层百合鳞片的内源POD活力低于外层和内层,其中内层鳞片中内源POD活力最高,与内层鳞片中褐变度较高密切相关。


图1 不同部位的百合鳞片在贮藏过程中内源POD活力的变化Fig.1 Change in endogenous POD activity in different parts of lily bulbs during storage
2.4 不同部位的百合鳞片在贮藏过程中H2O2含量和O2-·产生速率的变化

图5 不同部位的百合鳞片在贮藏过程中H2O2含量(A)和·产生速率(B)的变化Fig.5 Change in H2O2 content (A) and· production rate (B) in different parts of lily bulbs during storage
由图5A可以看出,随着贮藏时间的延长,各层百合鳞片的H2O2含量均呈现上升趋势,但是中层鳞片H2O2含量始终低于外层和内层鳞片。在贮藏前9 d,H2O2含量增长相对缓慢,可能是百合受到衰老损伤后引起CAT等酶活力的增加所致;贮藏后期12~15 d,各层鳞片H2O2含量均呈显著性增加,细胞受到的氧化损伤也逐渐加重,自我修复能力下降导致H2O2含量增加较快,同时加速了组织褐变。
2.5 不同部位的百合鳞片在贮藏过程中MDA含量和LOX活力的变化

图6 不同部位的百合鳞片在贮藏过程中MDA含量(A)和LOX活力(B)的变化Fig.6 Change in MDA content (A) and LOX activity (B) in different parts of lily bulbs during storage
植物体在遭受逆境伤害或者衰老时,会发生膜脂过氧化现象,最终产物为MDA。由图6A可以看出,在贮藏过程中,各层百合鳞片的MDA含量均随着贮藏时间的延长而呈现上升趋势,但是中层鳞片的MDA含量以及增长速率均低于外层和内层。在贮藏前6 d,MDA含量增长缓慢,中层和内层含量差异不显著,可能是因为百合在衰老褐变过程中产生的适量H2O2诱导机体作出一系列反应机制抵御了氧化损伤;贮藏后期9~15 d,外层和中层MDA含量呈显著性升高,而内层鳞片在9~12 d急剧增加,表明贮藏中后期内层鳞片膜脂过氧化作用增强,导致MDA大量积累,加剧了褐变的发生。
LOX活力的增强会加快细胞损伤以及植物体衰老。由图6B可以看出,随着贮藏时间的延长,各层百合鳞片的LOX活力均呈先上升后下降趋势,在贮藏12 d时达到峰值。中层鳞片的LOX活力上升幅度低于外层和内层,且峰值最小,而内层鳞片峰值最大。在贮藏前期0~6 d各层鳞片LOX活力差异不显著,但9~15 d内层与外层、中层均呈显著性差异;这与百合内层鳞片褐变严重结果一致。LOX活力的上升可能是百合鳞片对衰老等伤害反应的“应答”。
2.6 不同部位的百合鳞片在贮藏过程中SOD活力和CAT活力的变化
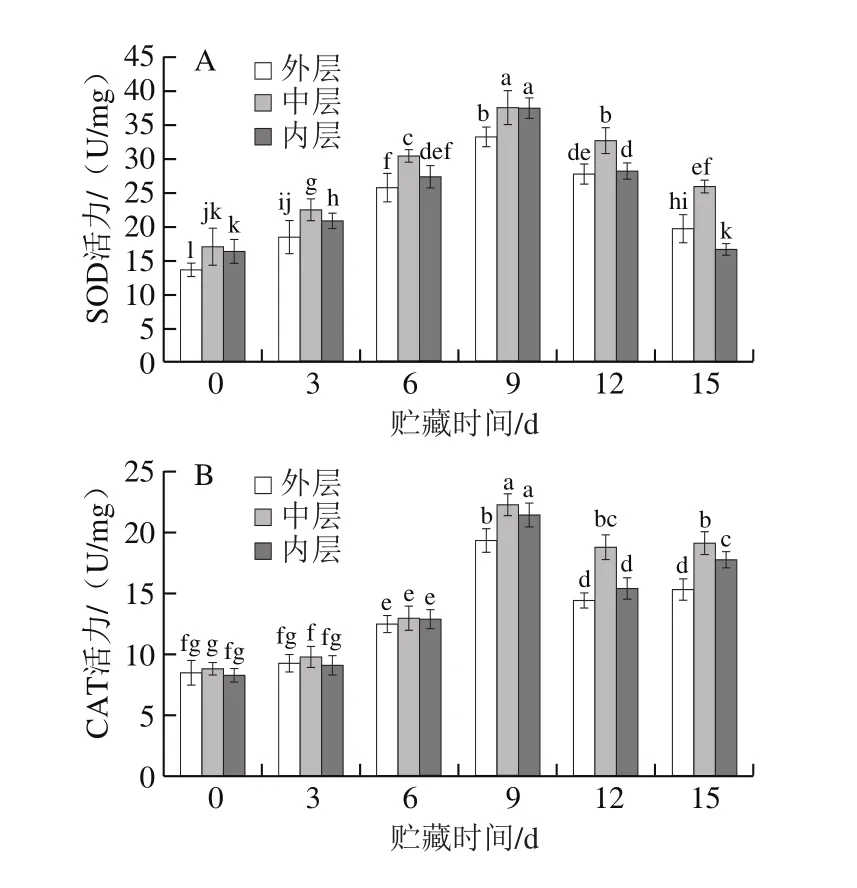
图7 不同部位的百合鳞片在贮藏过程中SOD(A)和CAT(B)活力的变化Fig.7 Change in SOD (A) and CAT (B) activity in different parts of lily bulbs during storage
由图7A可以看出,各层百合鳞片的SOD活力均随着贮藏时间的延长呈先上升后下降趋势,第9天出现峰值,但是中层鳞片的SOD活力始终比外层和内层高,而内层鳞片贮藏中、后期SOD活力急剧下降,可能是膜脂过氧化作用使组织细胞积累大量的活性氧,细胞受到不可逆伤害,自我修复力下降所致。
CAT能将植物体内的H2O2催化分解,降低植物受到的过氧化损伤。由图7B可以看出,各层百合鳞片的CAT活力均随着贮藏时间的延长呈先上升后下降趋势,第9天时CAT活力出现峰值,但是中层鳞片的CAT活力始终高于外层和内层,具有较强清除H2O2的能力。但在贮藏后期CAT活力逐渐下降,组织受到的氧化损伤不可逆,组织修复能力下降,百合鳞片褐变加剧。
3 讨 论
百合在贮藏过程中发生的一系列生理变化,最直观的表现是颜色的变化。褐变主要是因为细胞受到损伤使多酚渗出后被氧化成醌类物质,而醌类物质可进而聚合成“类黑精”,外观上表现为百合表面颜色的加深。本研究结果表明,百合鳞片采后贮藏过程中褐变程度的增加伴随着细胞活力的降低和细胞膜的损伤。
POD在过氧化物存在的条件下能催化多种酚类物质的氧化,导致采后果蔬的酶促褐变。植物细胞中内源POD活力常用DAB组织染色法来测定,在细胞内POD等氧化酶的作用下,催化H2O2释放氧,从而与显色底物DAB发生氧化反应产生棕褐色沉淀,以棕色物质在细胞内分布的多少来反映内源POD的活力。本研究中,不同部位百合鳞片细胞内POD活力先上升后下降。这与李文香等[24]对梨果实贮藏过程中POD活力的研究结果一致。
植物组织衰老过程中会因为植物代谢产生大量的活性氧攻击生物膜,造成膜脂过氧化最终产生MDA[25]。细胞膜的相对渗透率可以用来衡量细胞膜被破坏的程度,进而反映膜脂过氧化的程度[26]。本研究结果表明,在贮藏过程中百合鳞片的MDA含量呈上升趋势,而中层百合鳞片的MDA含量均低于外层和内层,细胞膜的相对渗透率、呼吸强度和MDA含量变化趋势相同,这表明细胞膜透性、呼吸强度和膜脂过氧化程度呈正相关,随着贮藏时间的延长,营养物质逐渐消耗,鳞片组织呈衰老状态;这与Lin Yifen等[26]在龙眼果实中的研究结果相似。
植物的膜脂过氧化需要LOX启动和参与。本研究中,褐变相对较慢的中层百合鳞片LOX活力较低,上升速率较平缓;褐变最快的内层鳞片在贮藏过程中LOX活力峰值最高且上升速率较快。在对鲜切荸荠[27]和梨[28]的研究中表明,LOX通过对膜的氧化损伤促进了褐变的发生。这与本研究的结果一致,LOX活力与百合鳞片的褐变也密切相关。
SOD和CAT是植物自由基清除系统中的重要保护酶,二者协同作用可以有效阻止活性氧的积累,防止膜脂过氧化,减轻衰老伤害[29-31]。本研究表明,SOD和CAT活力在贮藏初期和中期不断增强,均在第9天达到高峰,可最大程度清除活性氧,减轻氧化伤害;贮藏后期,随着细胞受到的氧化伤害不可逆,酶活力降低,膜脂过氧化程度加剧,因而还会继续产生活性氧[32-33];其中H2O2和O2-·是最主要的两种氧自由基,植物在衰老或遭受逆境时,机体内的H2O2含量和O2-·产生速率会呈现上升趋势。本研究中,百合鳞片中的H2O2含量和O2-·产生速率也随着贮藏时间的延长而不断上升,这与草莓[33]和菠菜[34]贮藏过程中活性氧含量的变化研究结果一致。
综上,在百合鳞片的贮藏过程中,百合鳞片细胞因衰老而造成活性氧积累,导致膜脂过氧化,引起褐变加剧、品质下降;但是植物对逆境(如衰老)的防御机制非常复杂,不同防御反应之间可能会存在相互影响、信号交叉等现象,而根据之前有关百合鳞片贮藏期间酚类物质研究结果推测,不同部位百合鳞片在贮藏过程中褐变程度的差异可能与不同部位酚类物质的含量组成及对膜损伤的防御能力差异相关,具体机制还需要进一步研究。百合鳞片贮藏过程中极易发生褐变,本研究结果证明其褐变与膜脂过氧化造成的膜氧化损伤密切相关。

