冷藏鲟鱼片优势腐败菌的分离与鉴定
李小义 才让卓玛 杨星 吴丹 杨明举
摘要:为确定鲟鱼片低温冷藏过程中优势腐败菌,将鲟鱼片包装后在低温(4±0.5)℃条件下贮藏,12 d后利用选择性培养基进行腐败菌的分离筛选。通过生理生化、形态学鉴定及16S rDNA序列分析,对低温贮藏过程中鲟鱼片的优势腐败菌进行鉴定。结果表明:鲟鱼片在低温条件下贮藏至12 d时的优势腐败菌属为假单胞菌属(Pseudomonas, 56.25%)、肉食杆菌属(Carnobacterium,12.5%)、哈夫尼菌属(Hafnia,12.5%)、漫游球菌属(Vagococcus,6.25%)、库特氏菌属(Kurthia,6.25%)、普罗维登斯菌属(Providencia,6.25%)等。
关键词:鲟鱼片;冷藏;腐败微生物;分离;鉴定
由于营养学家们对减少饱和脂肪摄入的提倡,富含多不饱和脂肪酸肉类的消费量大幅增加,然而,多不饱和会加速氧化过程,导致肉的味道、颜色、质地和营养价值的恶化[1]。淡水鱼类因其组织结构疏松、蛋白质含量高、脂肪高度不饱和等特点,在加工、运输及贮藏等过程中受到微生物的污染后,其肉质容易被氧化,引起鱼体腐败变质,货架期缩短,逐渐失去营养价值和商品价值[2-3]。微生物是引发鱼体腐败变质的主要原因。近年来,人们对导致鱼体腐败的微生物进行了较多的研究。高白鲑鱼片冷冻和冰鲜保藏初期腐败菌主要为假单胞菌,随着保藏时间延长,肠杆菌逐渐成为优势腐败菌[4]。李秀秀等人对鲫鱼贮藏过程中优势腐败菌研究发现:导致鱼肉腐败的优势微生物为荧光假单胞菌,与导致鱼鳃腐败的优势微生物存在差异[5]。
鲟鱼为高蛋白、多脂肪性鱼类,是世界上优良的淡水鱼品种,也是现存于世界上最珍奇、最古老的冷水性生物鱼群之一,有“活化石”之称,其肉厚骨软,含有人体必需的多种氨基酸,具有很高的经济价值和药用价值。目前对鲟鱼及鲟鱼加工产品腐败菌群和保鲜技术研究较少,阻碍了鲟鱼鲜活及加工产品的市场贸易。本文对冷藏过程中鲟鱼片腐敗微生物进行了分离鉴定,旨在提高人们对鲟鱼冷藏过程腐败微生物的认识和为鲟鱼片保鲜剂的研究制备提供依据。
1材料与方法
1.1材料
本研究所用鲟鱼采至贵州省水产研究所惠水养殖基地。
1.2主要仪器和试剂
离心机,德国Eppendorf 公司; 电泳仪,北京市六一仪器厂;Gel-Doc2000凝胶成像分析仪,美国BIO-RAD公司;PCR 仪,美国BIO-RAD 公司。
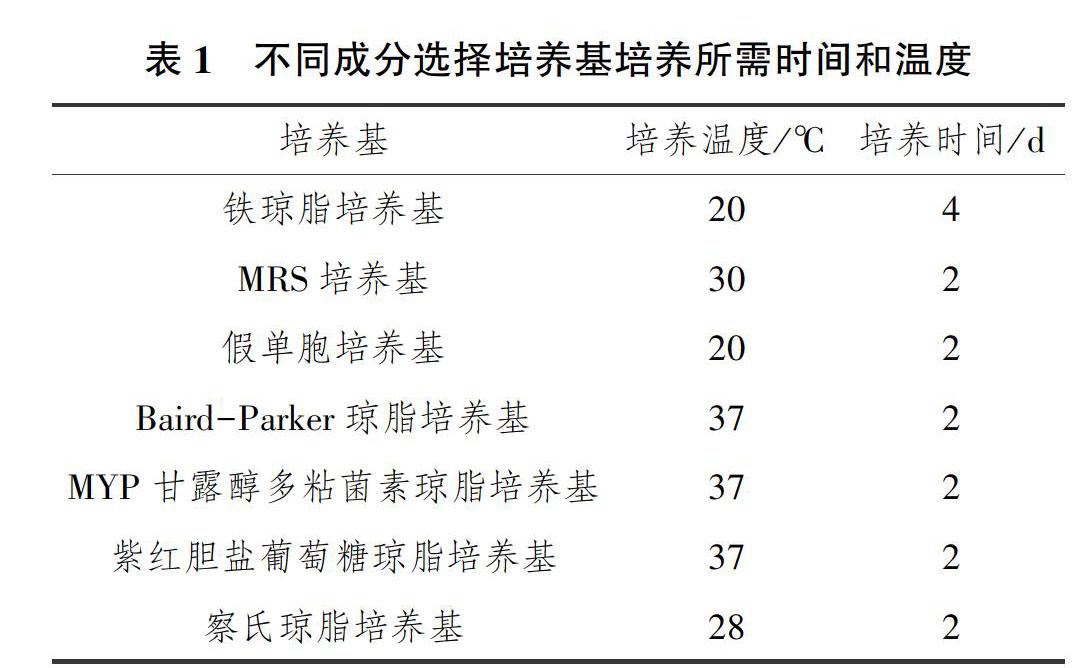
细菌基因组DNA提取试剂盒(DP302),天根生化科技(北京)有限公司;DNA Marker,上海生工生物工程股份有限;革兰氏染液、微生物生理生化微量鉴定管、铁琼脂培养基、MRS培养基、假单胞培养基、Baird-Parker Ager、MYP甘露醇多粘菌素琼脂培养基、紫红胆盐葡萄糖琼脂培养基、察氏琼脂培养基,青岛海博生物技术有限公司; 药敏试纸片,购自杭州滨和微生物试剂有限公司。
1.3鲟鱼片的制备与保藏
从贵州省水产研究所惠水养殖基地采集1500g左右的鲜活鲟鱼3条,首先将鲟鱼体表粘液清洗干净,沿腹部剖剪开,去除内脏和鱼头,随后用清水清洗干净,去除鱼骨,剥去鱼皮。对获得的鲟鱼肉用无菌水冲洗数分钟,洗净沥干切片后将鲟鱼片置于保鲜盒中,放入冰箱4±0.5℃保藏12d。取腐败变质的鲟鱼片进行腐败微生物的分离鉴定。
1.4可培养菌株的分离纯化
无菌条件下取腐败变质的鲟鱼片10g于50mL无菌离心管内,使用手持式匀质器将鲟鱼片制成匀浆状,随后在试管内加入20mL无菌水,置于震荡器上震荡5min。取1mL 上清液,梯度稀释至10-8,每个稀释度做3个重复。分别取200 μL稀释液于不同的选择分离培养基内,采用平板涂布法涂板培养。不同培养基分离培养温度和时间如表1所示。待培养基上菌落生长以后,从平板上挑取典型生长菌落。以LB琼脂培养基为纯化培养基,分离纯化3次,获得单菌落,用于菌种的初步鉴定。
1.5菌株生理生化试验
参考《常见细菌系统鉴定手册》[6]对分离纯化获得的单菌进行生理生化鉴定。
1.6单菌16S rRNA基因分析
采用细菌基因组DNA提取试剂盒对分离获得的单菌DNA进行抽提,操作方法参考试剂盒说明书。
16S rRNA基因测序及系统发育分析:16S rRNA基因正向扩增引物: 5'-AGAGTTTGATCCTGGCTCAG-3'( 位于E.coli 16S rRNA基因的第8~27个碱基位置) ; 反向扩增引物:5'-ACGGCTACCTTGTTACGACT-3'( 位于E.coli 16S rRNA基因的第1512~1493个碱基位置)[7]。PCR扩增条件:95℃预变性5min;接着94℃变性1min,55℃复性1min,72℃延伸1.5min,32 个循环;最后72℃温育10min。 扩增产物经1%琼脂糖( 质量占比) 凝胶电泳确定条带后直接交由生工生物工程(上海)股份有限公司进行序列测定。
2结果与分析
2.1可培养优势菌的分离纯化
从不同成分的选择培养基上挑取优势菌株进行纯化,剔除重复共获得16株单菌。以下实验均以这16株菌为材料。
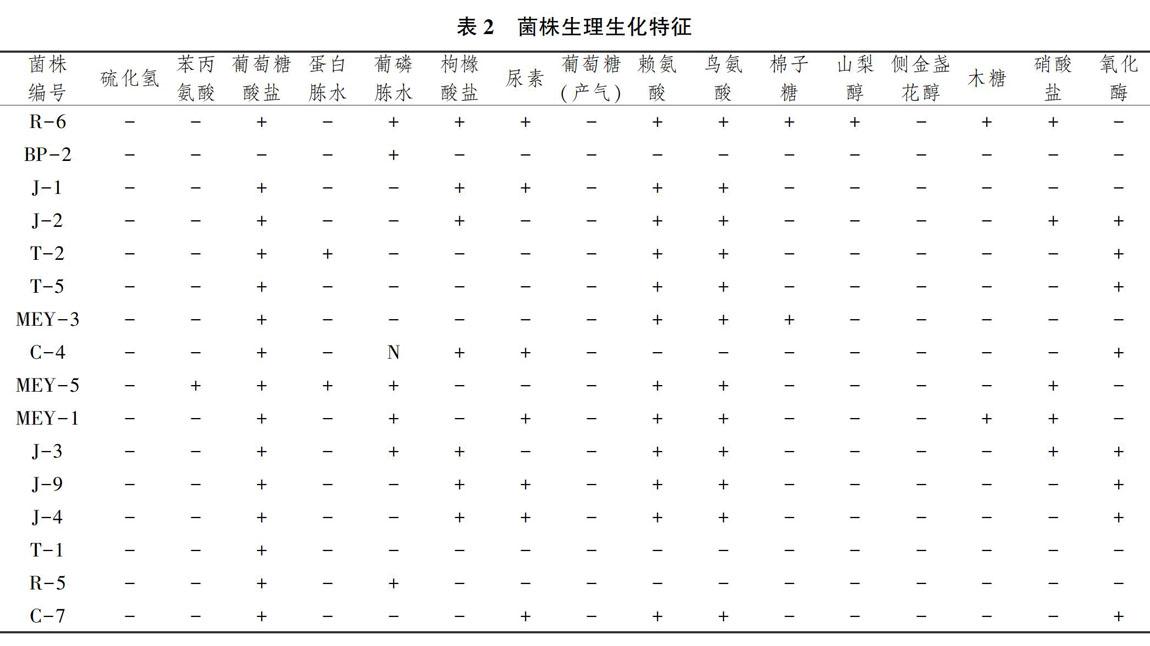
2.2单菌生理生化鉴定
16株单菌的生理生化检测结果如表2所示。结果表明,16株菌株均不能利用葡萄糖进行产气,不能产硫化氢,同时也不能利用侧金盏花醇。
2.316S rDNA基因分析
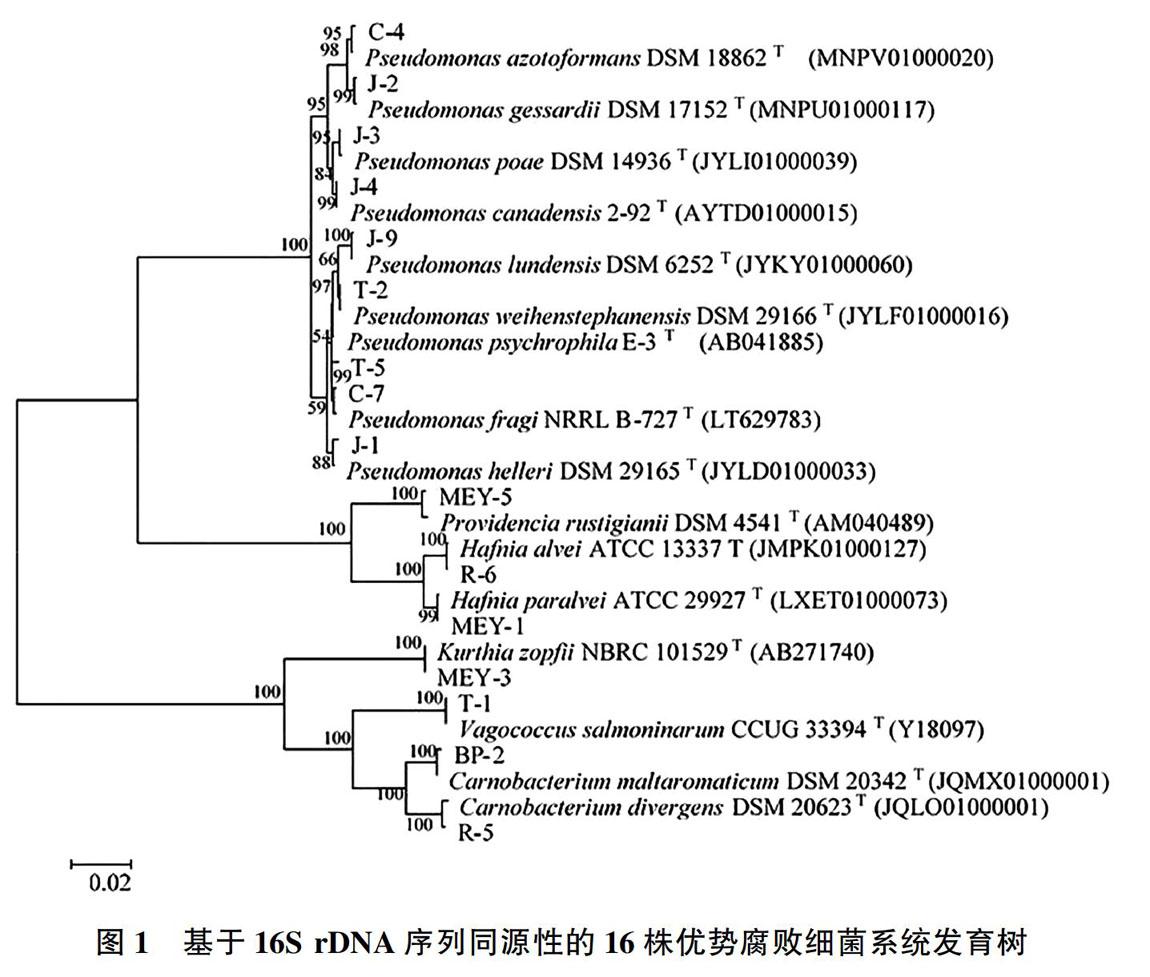
对分离的菌株进行16S rDNA基因扩增、测序和Blastn比对分析,16株单菌的16S rDNA序列相似性与模式菌株序列相似性在99.75%~100%之间。16株单菌的系统进化分析结果如图1所示。分离的16株单菌主要分布在γ-变形菌纲(Gammaproteobacteria)和芽胞杆菌纲(Bacilli),分别占比75%和25%,分属于假单胞菌属(Pseudomonas, 56.25%)、肉食杆菌属(Carnobacterium,12.5%)、哈夫尼菌属(Hafnia,12.5%)、漫游球菌属(Vagococcus,6.25%)、库特氏菌属(Kurthia,6.25%)、普罗维登斯菌属(Providencia,6.25%)等6个属。16株菌的16S rDNA系统进化树如图1所示。
3讨论
鱼体种类、来源及贮藏方式不同,优势腐败菌组成复杂且变化大。冬、春时期中冷藏鲳鱼贮藏期间优势腐败菌的种类基本一致,以革兰氏阴性菌为主,主要腐败菌为嗜冷杆菌、草莓假单胞菌、荧光假单胞菌、热杀索丝菌及腐败希瓦氏菌等[8]。在鲈鱼-2℃微冻和4℃冷藏情况下H2S菌和假单胞菌增长快,主要优势腐败菌为腐败希瓦氏菌和假单胞菌。鲳鱼在气调包装冷藏期间,腐败希瓦氏菌、荧光假单胞菌与嗜冷杆菌为主要优势菌[9]。添加0.2%山梨酸和苯甲酸等改变水产品pH值对酵母、霉菌和许多真菌具有抑制作用,但可使乳酸菌变为优势菌[10]。真空包装冷藏条件下,鲟鱼的优势腐败菌为气单胞菌和肠科菌[11]。萝卜籽蛋白提取物处理鲟鱼片后,托盘包装贮藏可有效减少腐败微生物的生长[12]。
唐文静等人对海鲈鱼冷藏期间的腐败菌进行分离鉴定,获得4株优势腐败菌,其中草莓假单胞菌具有较强的致腐能力[13]。刘爱芳等人研究了假单胞菌、不动杆菌及热死环丝菌对金枪鱼的致腐能力,结果表明假单胞菌致腐能力较强[14]。库特氏菌最初从鸡肠道分离获得,未有研究显示该菌属与肉类的腐败变质直接相关,但却是豆腐腐败的特定腐败菌[15-16]。乳酸菌广泛存在于自然界,且物种多样性丰富,其多个属被鉴定为引起食品腐败变质的优势腐败菌,肉食杆菌属是水产品中常见的乳酸菌[17]。肉食杆菌属[JP](Carnobacterium maltaromaticum)为小黄鱼在真空和气调包装冷藏条件下的优势腐败菌[18]。蜂房哈夫尼菌易引起真空包装的肉制品腐败变质[19]。本研究通过对低温冷藏12d的鲟鱼片腐败微生物进行分离鉴定,共获得16株单菌,主要分布在假单胞菌属、库特氏菌属、肉食杆菌属、哈夫尼菌属、普罗维登斯菌属及漫游球菌属等。其中,假单胞菌为主要优势菌属。本文分离获得的菌属对鲟鱼片的致腐能力还有待进一步研究。
参考文献
[HJ1.5mm][1]
Mielnik M B, Olsen E, Vogt G, et al. Grape seed extract as antioxidant in cooked, cold stored turkey meat[J]. LWT-Food science and technology, 2006, 39(3): 191-198.
[2] 王玮,王联珠,沈建,等.水产品保鲜技术及其标准的现状与分析[J\].渔业现代化,2009,36(6):66-70.
[3] Thiansilakul Y, Benjakul S, Richards M P. The effect of different atmospheric conditions on the changes in myoglobin and colour of refrigerated Eastern little tuna (Euthynnus affinis) muscle [J]. Journal of the Science of Food andAgriculture, 2011, 91(6): 1103-1110.
[4]李萌, 由高铭, 蒋晶华, 等. 冷冻和冰鲜处理对新疆高白鲑鱼片理化指標和腐败菌的影响[J]. 大连海洋大学学报, 2017, 32(5): 584-589.
[5] 李秀秀, 曾维伟, 陆兆新, 等. 鲫鱼贮藏过程中微生物菌相 PCR-DGGE 分析及其防腐保鲜[J]. 食品科学, 2017, 38(5): 274-280.
[6] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M\]. 北京: 科学出版社,2001.
[7] Liu C L,Shao Z Z.Alcanivorax dieselolei sp.nov,a novel alkane-degrading bacterium isolated from sea water and deep-sea sediment [J].International Journal of Systematic and Evolutionary Microbiology,2005(55): 1181-1186.
[8] 蓝蔚青,谢晶,周会,张琛杰. 不同时期鲳鱼冷藏期间优势腐败菌的多样性变化[J]. 食品科学, 2015,36(2):226-231.
[9] 毛盘线, 姬华, 周红, 等. 白斑狗鱼中特定优势腐败菌的鉴定与特征[J]. 中国食物与营养, 2014, 20(6): 32-34.
[10]王庆丽. 养殖大黄鱼和海水鲈鱼冷藏过程中特定腐败菌的鉴别[D]. 浙江工商大学, 2012.
[11] 焦维桢, 陈思璐, 章志超, 等. 真空包装冷藏鲟鱼中优势腐败菌的分离, 鉴定及生长预测[J]. 肉类研究, 2014, 28(6): 18-21.
[12] 李军, 李平兰, 高亮, 等. 萝卜籽蛋白提取物对托盘包装鲟鱼片冷藏品质的影响[J]. 食品科学, 2018, 39(9): 224-231.
[13] 唐文静, 王楚文, 柳云龙, 等. 冷藏海鲈鱼优势腐败菌的筛选和鉴定[J]. 食品科学, 2016, 37(3): 170-174.
[14] 刘爱芳, 谢晶, 钱韻芳. 冷藏金枪鱼优势腐败菌致腐败能力[J]. 食品科学, 2018, 39(03): 7-14.
[15] Stackebrandt E, Keddie R M, Jones D. The genus Kurthia[M\]. New York, NY, 2006: 519-529.
[16] 李除夕, 董明盛, 陈晓红, 等. 豆腐中库特氏菌生长动力学模型和货架期预测[J]. 农业工程学报, 2009 (01): 82-86.
[17] 黄佳奇. 小黄鱼优势腐败菌的分离鉴定及其与品质的相关性研究[D]. 浙江大学, 2018.
[18] 黄佳奇, 向迎春, 邵颖, 等. 分析包装条件对小黄鱼优势腐败菌的影响[J]. 食品研究与开发, 2018, 39(8): 176-181.
[19] 张旭东, 闫超杰, 孙剑, 等. 冷鲜牛肉中蜂房哈夫尼亚菌 (Hafnia alvei) 的分离与鉴定[J]. 微生物學雜誌, 2010, 30(3): 106-108.

