改良SDS法提取书虱总RNA的效果评估
卢莹 黄文雨 黄梦蕊 王波 陈潜 刘啸 汪书然 孙恩涛
书虱(book lice)体长约1 mm,隶属于啮目、虱啮科,是一类广泛存在于多种储藏物中的害虫,呈世界性分布[1]。该属昆虫已知种类近110种,我国现已报道该属昆虫16种,其中最常见和最具经济意义的是嗜卷书虱[2]。书虱高质量RNA提取是进行下游分子生物学研究的关键环节,然而目前的RNA提取方法存在着完整性差、产率低、操作繁杂、试剂价格昂贵等问题,如异硫氰酸胍苯酚法[3]、酚-SDS法[4]、CTAB法[5]和试剂盒法等[6]难以提出高质量的RNA。本实验对传统SDS法[7]进行优化,并与传统SDS和TRIzol法的提取效果进行比较,以建立一种适用于书虱总RNA的提取方法。
材料和方法
一、书虱
书虱采集于学生宿舍、校园图书馆、面粉厂的脏面粉和户外地表的枯枝落叶。
二、主要试剂
TRIzol试剂盒(Invitrogen)、RT-PCR试剂盒(TIANGEN)、β-巯基乙醇(Solarbio)、SDS(Solarbio)、醋酸钾、水饱和酚(TIANGEN)、三氯甲烷、异丙醇、乙二醇丁醚、无水乙醇、2×Taq Master Mix(TIANGEN)。
三、三种方法提取书虱RNA效果比较
取300只书虱成虫随机分为三组,每组100只,分别采用改良SDS法、传统SDS法和TRIzol法进行书虱总RNA提取。3种方法各重复进行15次。
1.TRIzol法 参照TRIzol试剂盒说明方法进行。
2.传统SDS法 根据参考文献[8]中步骤方法进行。
3.改良SDS法
(1)配置实验试剂:①核酸萃取液Ⅰ:200μL DEPC水、500 μL水饱和酚、100 μL 10% SDS;②β-巯基乙醇;③核酸萃取液Ⅱ:水饱和酚/氯仿/异戊醇=125/24/1;④乙二醇丁醚;⑤75%乙醇
(2)实验步骤:① 取100只书虱样本于1.5 mL 离心管中,向其加入15 μL核酸萃取液Ⅰ和5 μL β-巯基乙醇;② 由于书虱个体较小,易于离心管中悬浮影响研磨效果,将RNase-Free枪头在酒精灯上烧软轻轻按压使管口闭合,直接于RNase-Free离心管中研磨,于冰盒上小心研磨直至研磨充分,再将180 μL核酸萃取液Ⅰ加入到RNase-Free离心管中,充分混匀得到匀浆液。室温孵育3 min;③ 向匀浆液中加入200 μL 2 mol/L KAc缓冲液,轻轻吹打混匀。根据KAc缓冲液的最适pH值探究试验得出最佳的pH值。室温孵育5 min;④ 4℃ 12000 r/min离心15 min;⑤ 取上层水相,加入等体积的核酸萃取液Ⅱ吹打混匀,振荡30 s后室温孵育5 min;⑥ 4℃ 12 000 r/min离心15 min;⑦ 取上层清夜,加入等体积的乙二醇丁醚,吹打混匀,-20℃静置40 min;⑧ 4℃ 12 000 r/min离心15 min;⑨ 吸取上清,保留沉淀,加入500 μL 75%乙醇洗涤沉淀;⑩ 去除乙醇,将沉淀室温自然晾干后加入20 μL RNase-Free水,充分溶解沉淀。
四、改良SDS法KAc缓冲液最适pH值
设计pH梯度试验:实验设计3.3~3.9不同pH值的KAc缓冲液,浓度均为2 mol/L。每个梯度书虱数量100只,根据实验结果确定最适的pH值。
五、改良SDS法书虱最低适宜数量
分别取1、10、20、30、50、100只书虱成虫,随机分为六组,采用改良SDS法进行实验。
六、RNA提取效果鉴定
1.RNA电泳检测:用1%的琼脂糖凝胶电泳(110 V、180 m A电泳35 min)跑胶,然后用紫外凝胶成像系统拍照观察以检测RNA的完整性。
2.RNA浓度与纯度测定:用核酸蛋白分析仪(Eppendorf Mastercycler nexus GSX1)测定RNA溶液的浓度和纯度,每组样品重复3次,求平均值。根据A260/A280、A260/A280比值结果做纯度分析。
3.RT-PCR扩增β-actin基因:参照RT-PCR试剂盒(TIANGEN)说明书合成cDNA模板并进行PCR反应。PCR 反应体系:cDNA模板1.0 μL;上游引物0.5 μL;下游引物0.5 μL;无酶水4.25 μL、6.25 μL 2×TaqMaster Mix。PCR反应条件:95℃预变性4 min;94℃变性30 s;56℃退火30 s;72℃延伸1 min,循环34次;72℃终末延伸10 min;4℃保存。引物参照文献[9]的β-actin基因引物序列:上游引物5′-ATGATGGGCTCAGCGATGTCC-3′;下游引物5′-CTCCATCTAAGCTGCAGTCATGAT-3′。基因片段长度为457 bp。
结 果
一、三种方法提取书虱总RNA比较
1.琼脂糖凝胶电泳分析
对改良SDS法、传统SDS法、和TRIzol法提取的RNA产物进行1%的琼脂糖凝胶电泳,如图1所示。改良SDS法提取的书虱RNA完整性较好,电泳结果显示28s rRNA、18s rRNA和5s rRNA条带完整,条带之间无明显弥散现象;而传统SDS法提取结果可见有明显的gDNA污染;TRIzol法提取书虱RNA未见28s rRNA条带。
2.RNA浓度与纯度分析
改良SDS法、传统SDS法、TRIzol法提取书虱总RNA的浓度值差异有统计学意义(F=17.874,P<0.001)。经SNK法每组互比,改良SDS法浓度较高,其次为TRIzol法,传统SDS法较低(表1)。
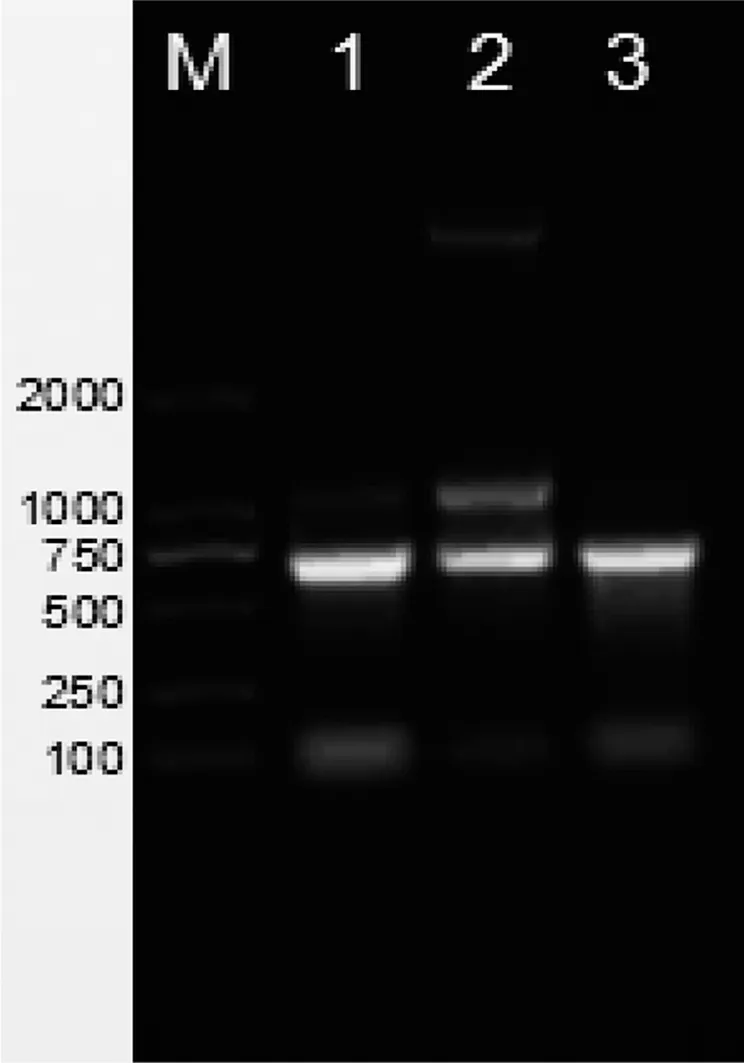
M:DNA marker;泳道1-3:改良SDS法、传统SDS法、TRIzol法
改良SDS法及传统SDS法提取RNA的A260/A280均在理想值范围1.8~2.0内,说明存在蛋白质污染;TRIzol法的A260/A280高于2.0。改良SDS法提取RNA 的A260/A230在理想值范围2.0~2.2内,说明该方法可去除脂类、多糖等成分。TRIzol 法的A260/A230低于2.0,说明存在有机物质等污染。
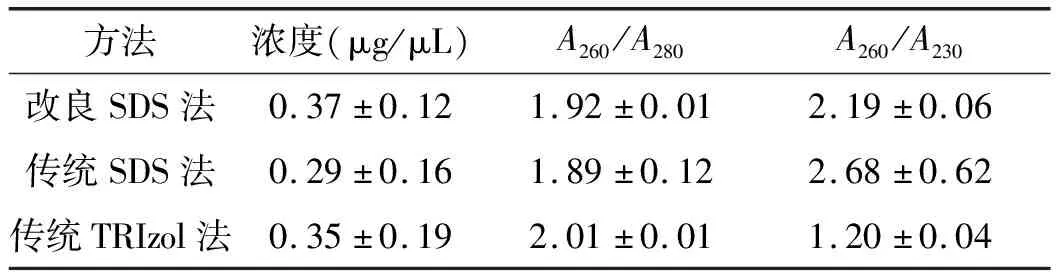
表1 三种方法提取书虱RNA的浓度和纯度
二、改良SDS法KAc缓冲液最适pH值
KAc缓冲液最适pH值探究实验结果表明:当pH值在3.5~3.8范围内,提取的RNA质量较高,无gDNA污染,无弥散带。最后根据书虱总RNA浓度和完整性(表2、图2)建议改良SDS法采用pH3.7的KAc缓冲液。
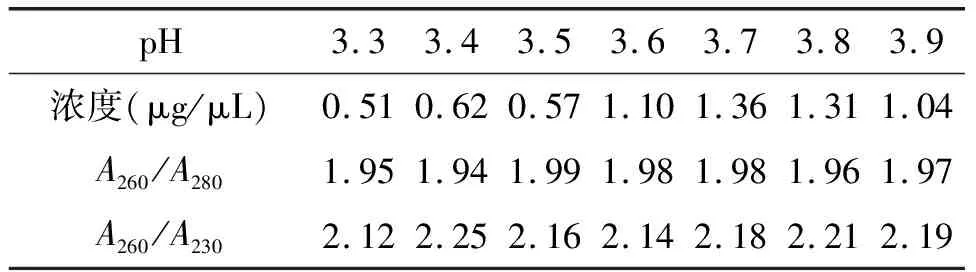
表2 不同pH值的KAc缓冲液提取的书虱总RNA浓度和纯度
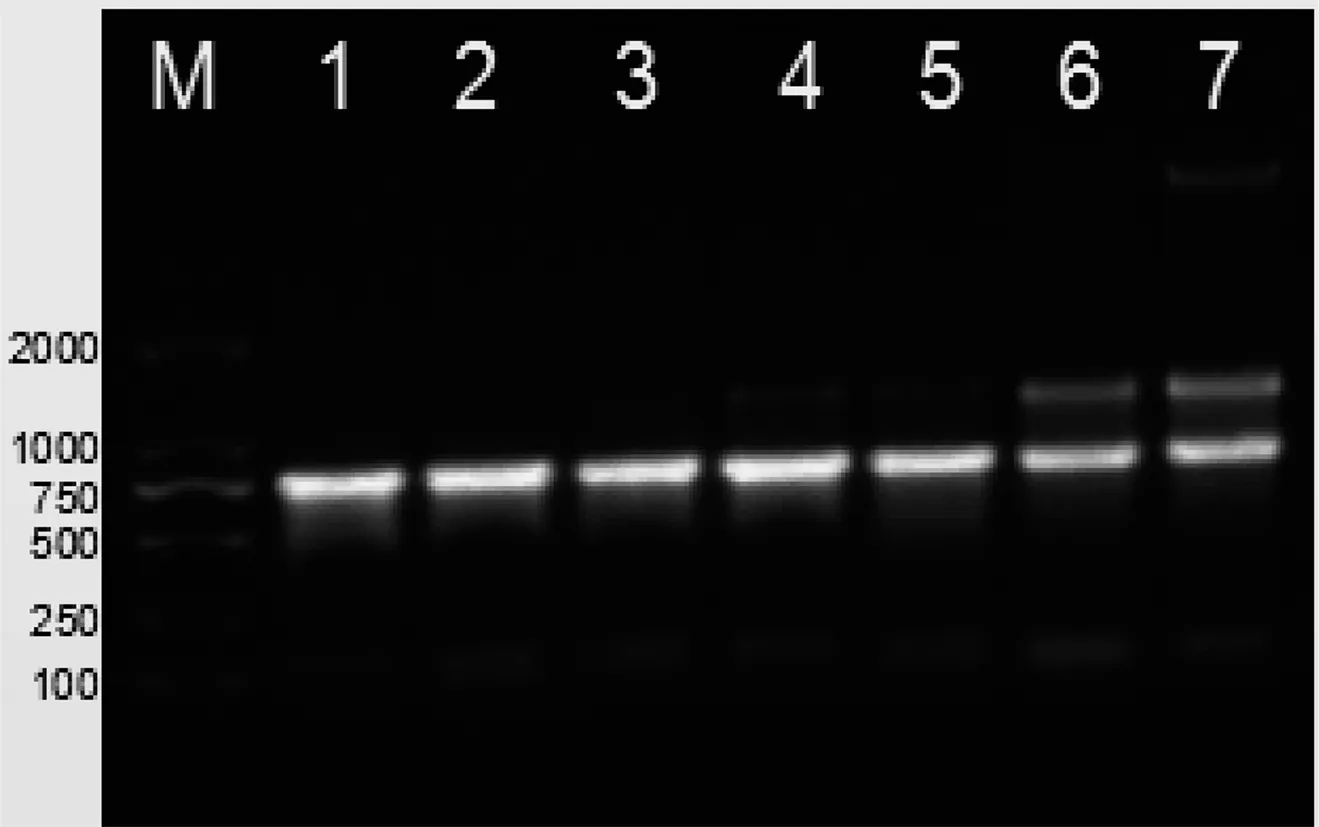
M:DNA marker;泳道1~7 pH值:3.3、3.4、3.5、3.6、3.7、3.8、3.9
三、改良SDS法书虱最低适宜数量
改良SDS法提取书虱样本,当书虱的样本量低至30只时,琼脂糖凝胶电泳出现微弱条带(表3、图3)。
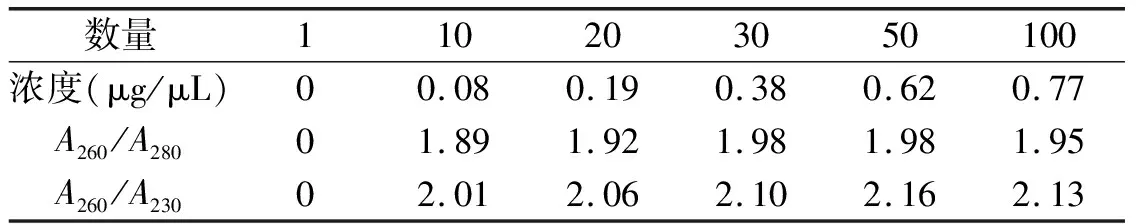
表3 不同书虱数量提取的总RNA浓度和纯度
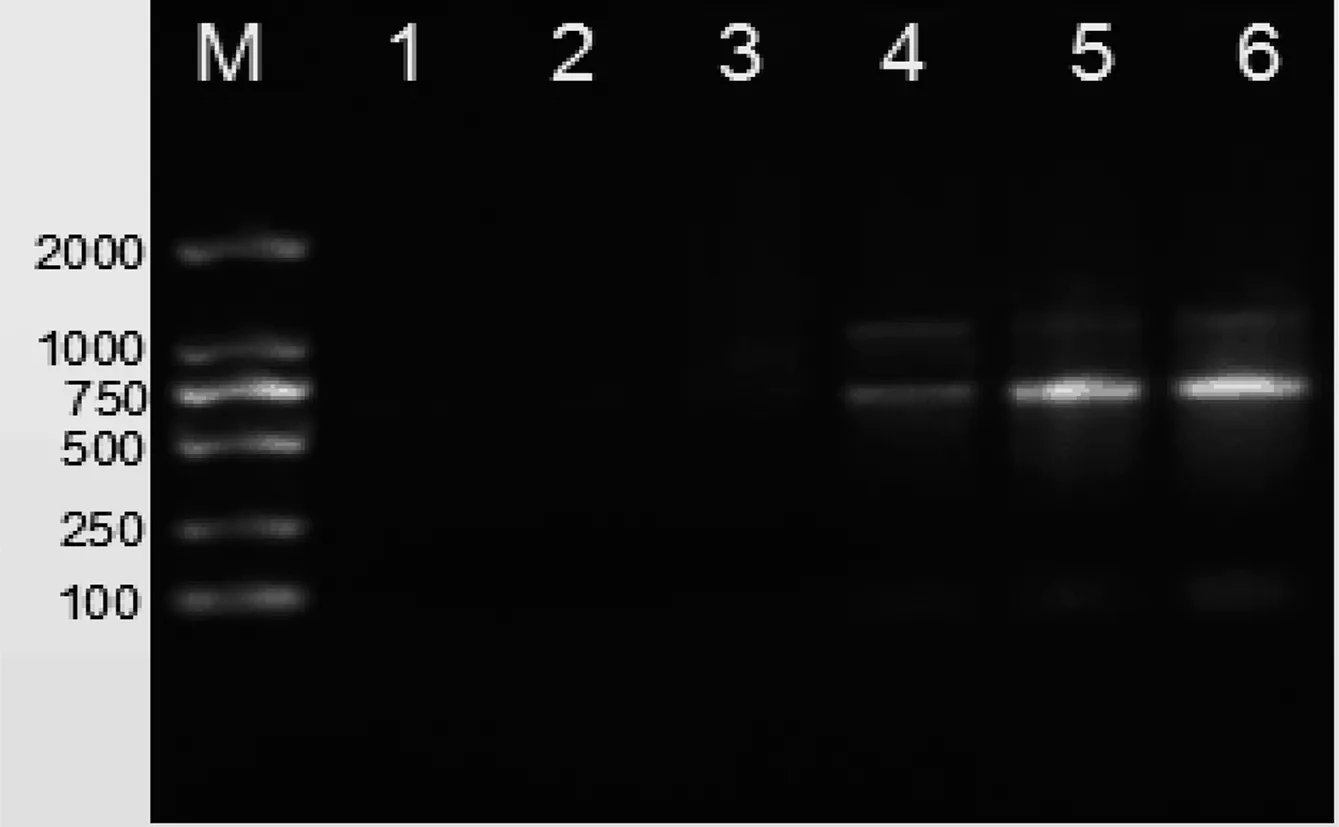
M:DNA marker;泳道1-6书虱数量(只):1、10、20、30、50、100
四、RT-PCR扩增β-actin基因
改良SDS法(pH=3.7,书虱数量为30只)提取的书虱RNA 经RT-PCR后扩增出的β-actin基因片段长度约457 bp,与预期结果一致,且条带单一整齐,没有拖带(图4)。
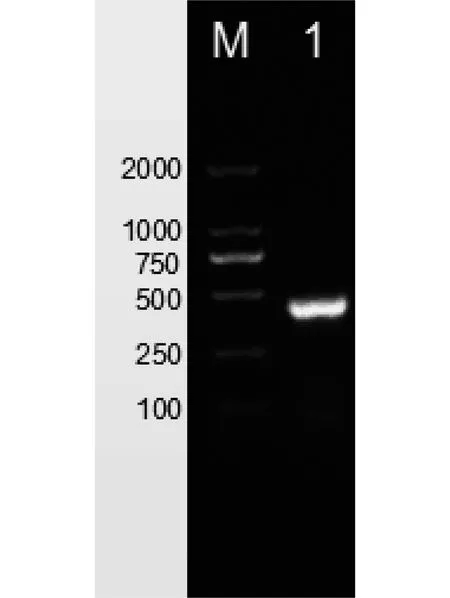
M:DNA marker
讨 论
随着Northern blot、RT-PCR、qPCR等[10]生物技术的发展,下游分子生物学实验广泛应用,实验成功的关键在于高质量 RNA 的获取。采用传统SDS法提取书虱的RNA中往往存在严重的gDNA污染[11],本实验用pH值更低的KAc缓冲液代替传统方法中的酸性NaAc缓冲液,KAc缓冲液中的K+可与 SDS结合成不溶性PDS(十二烷基硫酸钾)沉淀,同时沉淀了绝大多数的gDNA及蛋白质[12];水相pH值较低时,大量核酸会分配到酚相中;反之,水相pH值过高,gDNA会被抽提出来。降低KAc缓冲液的pH使偏酸性的KAc缓冲液可以创造酸性的水相环境,使部分核酸被酚抽提液吸附。同时,使gDNA在加入酚/氯仿离心分层时更易进入酚相,从而与RNA分离[13]。在提取书虱RNA过程中,RNA酶无处不在且状态不稳定,因此,防止RNA降解是成功提取RNA的前提。实验研磨过程中,将内源RNA酶抑制剂β-巯基乙醇与SDS联合使用可有效抑制内源性RNase及酚类氧化酶,防止RNA的降解,保证高质量RNA的提取[14]。另外,本实验还将传统方法中49∶1的酚/氯仿改为125∶24∶1的酚/氯仿/异戊醇,避免因苯酚过量难以洗涤而造成RNA污染。用乙二醇丁醚代替异丙醇沉淀RNA,使所得RNA沉淀提取效果更佳[15]。

