99Tcm-MDP SPECT/CT诊断宫颈癌放疗后骨盆不全骨折
张汝森,张林启,何 巧,李 伟,李 雯,任志刚,张书旭
(1.广州医科大学附属肿瘤医院核医学科,3.放疗中心,广东 广州 510095;2.中山大学附属第一医院核医学科,广东 广州 510055)
骨盆不全骨折(pelvic insufficiency fracture, PIF)属于应力性骨折,主要为病理性因素造成骨弹性抵抗力减弱,使骨盆不能承受正常或生理性作用力而引起,常发生于绝经后骨质疏松及宫颈癌骨盆放疗后女性患者[1-3]。MRI是诊断宫颈癌放疗后PIF最常用的方法,可清晰显示PIF病变区脂肪变性、骨髓出血及水肿,但对显示骨折线不敏感,极易误诊为骨转移瘤[4]。全身显像(whole body scan, WBS)可用于诊断PIF,灵敏度高,但特异度低[5]。SPECT/CT可全面显示解剖结构和功能图像,常用于肿瘤性疾病的诊断,但其对宫颈癌放疗后PIF的诊断价值鲜见大宗病例报道[5-6]。本研究探讨99Tcm-MDP SPECT/CT对宫颈癌放疗后PIF的诊断价值。
1 资料与方法
1.1 一般资料 回顾性分析2014年7月—2016年10月于广州医科大学附属肿瘤医院接受诊疗的37例宫颈癌放疗后疑似PIF患者的资料,年龄36~73岁,平均(55.9±8.8)岁;主要临床表现为下腰部及臀部剧烈疼痛,行走时加重。纳入标准:明确诊断为宫颈癌,接受宫颈癌盆腔放疗;随访至少12个月。排除标准:放疗前已诊断骨转移;既往骨盆骨折病史。
1.2 仪器与方法 采用Philips Precedence SPECT/CT扫描仪,低能高分辨型准直器及6排螺旋CT机。扫描前2~4 h于静脉注射99Tcm-MDP 20 mCi。嘱患者排空膀胱后仰卧,先行WBS,以双探头行前、后位同时采集,能峰140 keV,窗宽20%,矩阵256×1 024,速度20 cm/min。若发现核素浓聚灶且无法定性,则对该部位进行SPECT/CT断层扫描。SPECT/CT扫描前先行CT定位扫描,管电压120 keV,管电流130 mA,FOV 220 mm×220 mm,层厚5 mm,层间距2.5 mm;然后行SPECT扫描,矩阵128×128,连续采集360°,双探头各旋转180°,步进6°,每帧30 s。
1.3 图像分析 由2名核医学科主治医师和1名放射科主治医师以独立、盲法阅读所有图像;意见不一致时经共同讨论给出最终诊断。采用Philips Jet Steam Workspace软件进行SPECT/CT图像融合。WBS诊断标准:①PIF,伴骶骨“H”征或半“H”征;②不确定,可能PIF或骨转移瘤;③骨转移瘤,全身骨骼见≥3个不对称核素浓聚灶,不伴骨盆“H”征或半“H”征。SPECT/CT诊断标准:①PIF,核素浓聚部位的CT图像存在骨折线和/或骨质硬化;②不明确,核素浓聚部位的CT图像无特征性改变,可能PIF或骨转移瘤;③骨转移瘤,核素浓聚部位的CT图像存在成骨性或溶骨性改变等骨质破坏征象。
1.4 统计学分析 采用SPSS 19.0统计分析软件。以影像学、临床资料及随访(>12个月)情况等综合结果作为诊断PIF的金标准,采用四格表法计算WBS、SPECT/CT诊断宫颈癌放疗后PIF的灵敏度、特异度及准确率。采用χ2检验比较WBS与SPECT/CT对宫颈癌放疗后PIF诊断效能的差异。P<0.05为差异有统计学意义。
2 结果
37例患者共发现50个骨盆病灶,最终诊断PIF 42个(30例,图1),骨转移瘤8个(7例,图2)。42个PIF病灶中,位于骶骨23个、耻骨支5个、髋臼5个、坐骨4个、下腰椎3个、股骨颈及髂骨各1个;CT示骨质硬化33个(33/42,78.57%),骨折线19个(19/42,45.24%),溶骨性改变4个(4/42,9.52%)。
WBS共发现44个骨盆病灶,诊断PIF 23个(最终诊断为PIF 19个、骨转移瘤4个)、骨转移瘤4个(最终均诊断为骨转移瘤)、不确定17个(最终均诊断为PIF),漏诊6个(最终均诊断为PIF)。SPECT/CT共发现50个骨盆病灶、无漏诊,诊断PIF 41个(最终诊断为PIF 39个、骨转移瘤2个)、骨转移瘤6个(最终均诊断为骨转移瘤)、不确定3个(最终均诊断为PIF)。SPECT/CT诊断宫颈癌放疗后PIF的灵敏度及准确率均高于WBS(χ2=22.28、22.24,P均<0.01),但二者特异度比较差异无统计学意义(χ2=1.07,P=0.31);见表1。
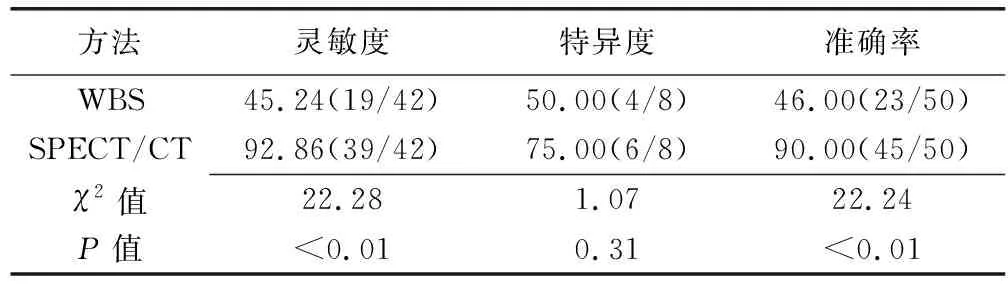
表1 WBS、SPECT/CT诊断宫颈癌放疗后PIF的效能比较[%(个)]
3 讨论
宫颈癌放疗后PIF易发生在绝经后骨质疏松妇女,其中骨质疏松是骨折的根本原因,放疗是其重要诱发因素,可在骨质疏松的基础上促进PIF发生。骶骨是身体的主要承重骨,承受脊柱传导来的大部分压力,是PIF最常见发生部位[1,7-8]。PIF常发生于宫颈癌放疗后3个月至3年,且为新出现病灶,故常被误诊为骨转移,明确诊断PIF对确定治疗方案非常重要。临床实践发现,宫颈癌放疗后PIF诊断应尽量避免穿刺活检,因为活检可减少放疗区域骨盆血液供应,加剧骨营养缺失,导致局部继发性感染或坏死[9],故目前主要采用综合多种影像学检查结果并紧密结合临床表现诊断PIF。本研究纳入37例宫颈癌放疗后出现下腰部及臀部剧烈疼痛、疑似PIF患者,根据影像学资料(CT、MRI及SPECT/CT等)、临床资料及随访(>12个月)观察,最终明确诊断PIF 30例(骨盆病灶42个),其中54.76%(23/42)的病灶位于骶骨,其次为耻骨支及髋臼,与既往报道[10-11]结果一致。
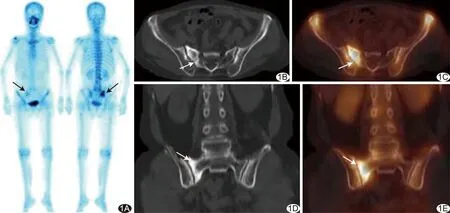
图1 患者64岁,宫颈癌放疗后PIF A.WBS示骶骨半“H”征(箭); B.CT轴位图像示骶骨右侧骨折线(箭); C.SPECT/CT融合图像示骶骨右侧局部核素浓聚(箭); D.CT冠状位图像示骶骨右侧骨质硬化(箭); E.SPECT/CT融合图像示骶骨右侧核素浓聚(箭)
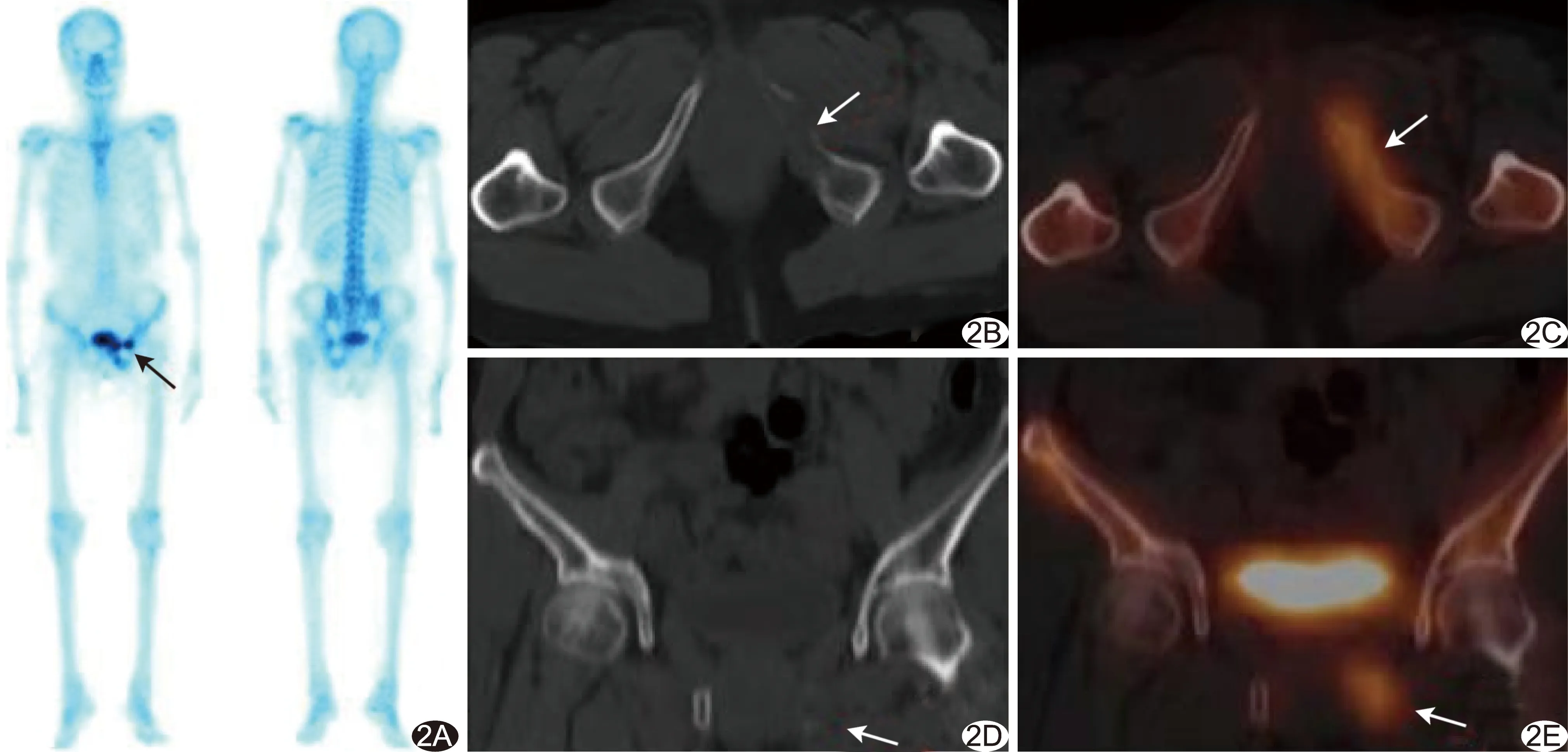
图2 患者62岁,宫颈癌放疗后骨转移瘤 A.WBS示左耻骨核素浓聚(箭); B.CT轴位图像示左耻骨溶骨性骨质破坏(箭); C.SPECT/CT融合图像示左耻骨局部核素浓聚(箭); D.CT冠状位图像示左耻骨溶骨性骨质破坏(箭); E.SPECT/CT融合图像示左耻骨核素浓聚(箭)
WBS显示“H”征或半“H”征,是PIF具有一定特异性的表现,指WBS示双侧骶骨翼及骶骨体对称性核素浓聚呈类似字母H形,但其出现概率并不高,约占所有PIF病灶的20%~40%[5-6,10]。本组42个PIF病灶中,19个(19/42,45.24%)WBS显示“H”征或半“H”征,高于既往研究[5-6,10]报道,主要原因在于本研究将半“H”征也作为PIF的定性诊断依据。在骶髂关节炎、关节退行性变及骨转移等病变中也可见“H”征或半“H”征,致WBS诊断PIF时出现假阳性[10]。本组8个骨转移瘤病灶中,4个(4/8,50.00%)因在WBS上显示“H”征或半“H”征而被误诊为PIF。另外,WBS是平面显像,当骨盆骨与膀胱重叠或病灶核素浓聚程度与周围正常骨相似时,均可能造成假阴性结果而致漏诊。本研究中WBS漏诊6个骨盆病灶,1个原因为膀胱影与耻骨病灶重叠,5个为核素浓聚程度与周围正常骨相似。
既往研究[12]报道,CT对于显示PIF病灶内骨折线、骨质增生硬化、骨质破坏及软组织肿块等非常敏感,对诊断及鉴别诊断PIF有较高应用价值,但CT诊断PIF早期改变的敏感度不高。本研究中78.57%(33/42)PIF病灶伴骨质硬化,45.24%(19/42)病灶见骨折线,少数病灶(9.52%,4/42)有溶骨性改变而易被误诊为骨转移瘤。SPECT/CT通过融合显像技术将SPECT功能显像与CT解剖显像有效结合,可对全身骨显像发现的阳性病灶进行精确定位,并清晰显示病灶精细结构,有助于提高诊断效能,已广泛应用于诊断WBS不确定病灶[13-15]。本研究37例宫颈癌放疗后50个疑似PIF病灶中,WBS诊断准确率仅为46.00%(23/50),加行SPECT/CT融合显像后诊断准确率提高至90.00%(45/50),显著高于单纯WBS(P<0.01),且SPECT/CT诊断宫颈癌放疗后PIF的灵敏度亦高于WBS(P<0.01),提示SPECT/CT对宫颈癌放疗后PIF的诊断效能高于WBS。本组3个单发PIF病灶伴溶骨性改变被SPECT/CT诊断为不确定。既往研究[16]认为宫颈癌骨转移瘤以溶骨性改变为主,提示临床发现宫颈癌放疗后疑似PIF患者出现溶骨性改变时,需与骨转移瘤鉴别。
综上所述,99Tcm-MDP SPECT/CT可用于诊断宫颈癌放疗后PIF,其诊断灵敏度及准确率均高于WBS。但本研究样本量小,且为回顾性研究,有待扩大样本量、结合多模态影像技术等进行前瞻性分析以进一步观察。

