L-2-氨基丁酸大肠杆菌生产菌株的构建
王婷,韩超,毛倩,张德志,蔡柠匀,刘宏亮,李燕军,2,3,陈宁,2,3*
1(天津科技大学 生物工程学院,天津,300457) 2(代谢控制发酵技术国家地方联合工程实验室(天津科技大学),天津,300457)3(教育部工业发酵微生物重点实验室(天津科技大学),天津,300457)
L-2-氨基丁酸是一种非天然的手性α-氨基酸,并不参与蛋白质的合成。L-2-氨基丁酸具有增强6-磷酸葡萄糖酯酶活性、抑制人体神经信息传递和提高神经元与神经胶质细胞新陈代谢速度的功能。它常被用作化工材料和手性化合物,同时也是多种药物合成的中间体。利用L-2-氨基丁酸合成的新型药物有抑制结核杆菌、治疗疥病的盐酸乙胺丁醇、治疗癫痫的利维西坦、内皮素及其受体拮抗剂,以及连氮丝菌素(Azinothricin)类抗菌药物等[1-3]。
L-2-氨基丁酸的合成方法有化学合成法[4]、酶催化法、细胞转化法和发酵法。利用微生物进行细胞转化或直接发酵生产L-2-氨基丁酸是特异性强、条件温和、绿色无污染的方式。李国龙[5]在大肠杆菌中过表达苏氨酸脱氨酶与ω-转氨酶,用来转化底物L-苏氨酸和异丙胺合成L-2-氨基丁酸。目前通过微生物发酵法合成L-2-氨基丁酸鲜有报道,构建遗传稳定的L-2-氨基丁酸高产菌株具有重要的现实意义。
通过基因工程手段延伸已有产品的代谢途径,来生产人们所需的产品已经有许多成功的报道。CHOI等[6]在大肠杆菌中引入欧文氏菌crtEXYIB操纵子,延伸1-脱氧-5-磷酸代谢途径来生产番茄红素。SHEN等[7]引入乳酸菌2-酮酸脱羧酶(Kivd)和酵母菌乙醇脱氢酶(ADH2),延伸L-苏氨酸途径将L-2-酮基丁酸生成1-丙醇和1-丁醇等。另外,引入L-2-羟基丁酸脱氢酶还可以还原L-2-酮基丁酸为L-2-羟基丁酸,进而聚合成生物材料聚羟基丁酸(polyhydroxyalkanoates, PHA)等。
从生物合成途径来看,L-2-氨基丁酸是L-苏氨酸的下游产物,L-苏氨酸在苏氨酸脱水酶的作用下生成L-2-酮丁酸,L-2-酮丁酸在不同氨基酸转氨酶、氨基酸脱氢酶作用下生成L-2-氨基酸丁酸(图1)。
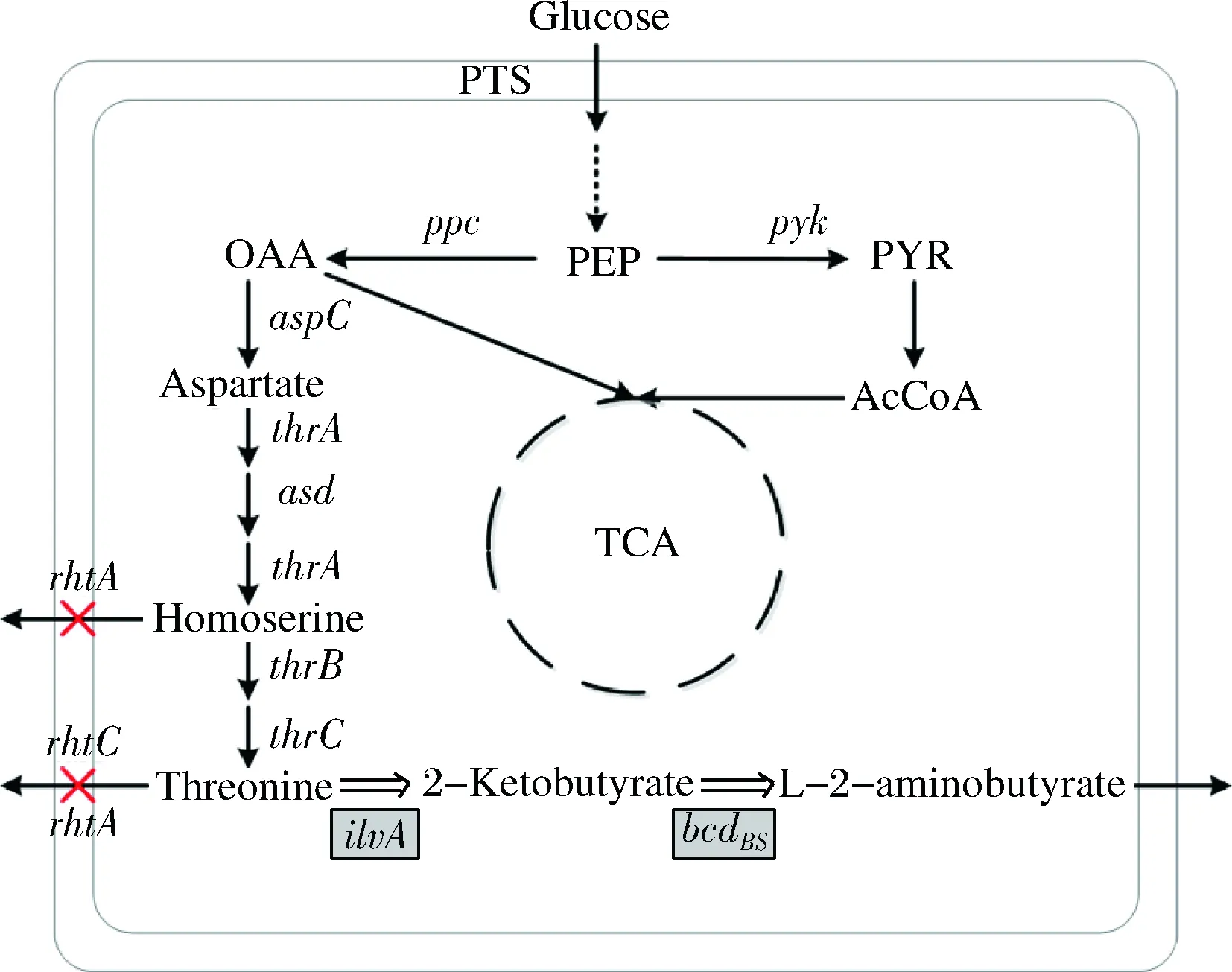
图1 大肠杆菌L-2-氨基丁酸合成途径
Fig.1 The biosynthesis pathway ofL-2-aminobutyrate inE.coli
注:黑色线条表示内源途径,双线条表示重构途径。
叉号表示基因敲除,阴影方框表示延伸途径中关键基因。
BS代表基因来源枯草芽孢杆菌
因此,通过延伸L-苏氨酸的代谢途径合成L-2-氨基酸丁酸是比较理想的选择。本研究以L-苏氨酸生产菌E.coliTHRD出发,通过不同酶的选择延伸代谢途径合成L-2-氨基酸丁酸,同时考察了阻断L-苏氨酸输出途径对L-2-氨基丁酸合成的影响。
1 材料与方法
1.1 实验材料
1.1.1 菌种与质粒
L-苏氨酸生产菌E.coliTHRD保藏于天津科技大学菌种保藏中心,编号为TCCC11825。菌株E.coliW3110、E.colidh5α、Bacillussubtilis168和Methanococcusjannaschii为本研究室保藏,THRDΔrhtA、THRLΔrhtC和THRLΔrhtAΔrhtC为本实验构建。质粒pTrc99a、pKD3、pKD46、pCP20为本研究室保藏,其他质粒为本实验构建。
1.1.2 酶与试剂盒
HS DNA聚合酶、QuickCut限制性内切酶和Solution I连接酶购自宝生物工程(Takara)有限公司(大连),Taq PCR MasterMix购自诺维赞(Vazyme)生物工程有限公司(南京),PCR产物纯化试剂盒、胶回收试剂盒和质粒提取试剂盒购自Omega Bio-tek公司。
1.1.3 仪器与设备
Universal 320冷冻离心机,德国Hettich公司;MiniSpin台式高速离心机,德国Eppendorf公司;LRH-250A培养箱,广东医疗器械厂;ZWYR-P2403叠式摇床,上海智诚分析仪器制造有限公司;Mastercycler nexus PCR仪,德国Eppendorf公司;电击转化仪,德国Eppendorf公司;移液器,德国Eppendorf公司;德国Eppendorf公司;DYY-6C电泳仪,北京六一仪器厂;WD-9403C紫外分析仪,北京六一仪器厂;752紫外分光光度计,上海精密科学仪器有限公司;Thermo U3000高效液相色谱仪,美国Thermo公司;5 L发酵罐,上海保兴生物设备有限公司。
1.1.4 培养基
斜面活化培养基(g/L):葡萄糖1.0,蛋白胨10.0,牛肉膏5.0,酵母粉5.0,NaCl 2.5,琼脂20.0,pH调至7.0~7.2,0.1 MPa、121 ℃灭菌20 min。
种子培养基:葡萄糖25.0 g/L,酵母粉10.0 g/L,蛋白胨6.0 g/L,(NH4)2SO42.0 g/L,KH2PO41.2 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 10.0 mg/L,MnSO4·H2O 10.0 mg/L,维生素(VB1、VB3、VB5、VB7、VB12)1.0 mg/L,VH0.3 mg/L,pH调至7.0~7.2,0.1 MPa、115 ℃灭菌20 min。
发酵培养基:葡萄糖40.0 g/L,酵母粉2.0 g/L,蛋白胨4.0 g/L,柠檬酸钠1.0 g/L,KH2PO42.0 g/L,MgSO4·7H2O 0.7 g/L,FeSO4·7H2O 50.0 mg/L,MnSO4·H2O 50.0 mg/L,维生素VB1、VB3、VB5、VB7、VB12浓度均为0.8 mg/L,VH0.2 mg/L,pH调至7.0~7.2,0.1 MPa、115℃灭菌20 min。
1.2 实验方法
1.2.1 质粒、菌株构建
1.2.1.1 引物设计
本研究所用引物采用Primer Premier 5软件进行设计,所有引物见表1。

表1 本研究所用引物Table 1 Primers used in the study
续表1

引物序列(5′-3′)rhtC-3GGTGGGCGGTTGTGTAGGCTGGAGCTGCTTCrhtC-4CTGAAGACGCGCCATGGTCCATATGAATATCCTCCTrhtC-5GACCATGGCGCGTCTTCAGAGTAAGTCGGATAAGrhtC-6CAATCGCGTCGACATTTGTTC
注:下划线代表酶切位点,斜体代表引物间重叠区域。
1.2.1.2 质粒构建与转化
以实验室已有的抗L-异亮氨酸反馈抑制的突变基因ilvA2[8]和ilvA4[9]为模板,分别以引物对ilvA2-S、ilvA2-A,和ilvA4-S、ilvA4-A扩增这2个突变基因。以限制性内切酶PstI、Hind III切割ilvA2、ilvA4和质粒pTrc99a。用Solution I连接酶分别连接pTrc99a和ilvA2,pTrc99a和ilvA4,获得质粒pTrc99a-ilvA2和pTrc99a-ilvA4。
以引物tyrB-S、tyrB-A扩增大肠杆菌酪氨酸转氨酶基因tyrB。以KpnI和XbaI双酶切质粒pTrc99a-ilvA2和片段tyrB。用Solution I将二者连接起来,获得质粒pTrc99a-tyrB-ilvA2。采用类似的方法构建来源于枯草芽孢杆菌亮氨酸脱氢酶基因bcdBS、大肠杆菌谷氨酸脱氢酶基因gdh,和ilvA2串联表达的质粒pTrc99a-bcdBS-ilvA2和pTrc99a-gdh-ilvA2。
质粒转化采用CaCl2介导的方法,具体为将质粒加入冰浴20 min的E.coliTHRD感受态细胞,42 ℃热激1 min、冰浴2 min,复苏1 h后涂布添加相应抗生素的LB固体培养基培养皿,37 ℃过夜培养,采用菌落PCR鉴定阳性转化子。
1.2.1.3 基因敲除菌株构建
基因敲除采用Red同源重组方法进行。
分别以引物对rhtA-1/rhtA-2和rhtA-5/rhtA-6扩增待敲除基因rhtA的上、下游同源臂序列,以引物rhtA-3、rhtA-4扩增氯霉素抗性基因cat。以rhtA-1、rhtA-6引物进行重叠PCR反应获得敲除rhtA的DNA片段(两端为rhtA基因同源臂、中间为抗性基因序列)。采用同样方法获得敲除rhtC的DNA片段。
将纯化的DNA片段采用电转化方法转入携带pKD46的E.coli感受态细胞。涂布含有氯霉素的固体培养基,菌落PCR鉴定获得正确的转化子,即为片段重组到基因组的菌株。丢失温敏质粒pKD46后,制备感受态细胞,转化pCP20质粒,涂布含有氨苄青霉素的固体培养基,鉴定获得阳性转化子。通过对点含有抗性的固体培养基,获得在氯霉素不生长、在氨苄青霉素生长的菌落,即为基因组上氯霉素抗性消除的菌株。最后,在42 ℃下培养丢失pCP20质粒。
利用上述方法敲除L-高丝氨酸和L-苏氨酸输出蛋白编码基因rhtA和rhtC,获得E.coliTHRDΔrhtA、THRDΔrhtC和THRDΔrhtAΔrhtC菌株。
1.2.2 发酵方法
摇瓶发酵:从新鲜活化斜面上挑取2环菌体接种于种子培养基中(500 mL三角瓶装液量30 mL,添加相应抗生素)。置于摇床中200 r/min、36 ℃培养至OD600值约为12时,按10%接种量接入发酵培养基中,添加相应抗生素和IPTG(终浓度0.1 mmol/L),当葡萄糖耗尽时发酵结束。
5 L发酵罐发酵:吸取适量无菌水于3支新鲜的活化斜面,将菌悬液接入5 L发酵罐中进行种子培养,种子培养基装液量为1.5 L。通过自动流加氨水控制pH在7.0左右,培养温度36 ℃。培养至OD600值为12~14时,按13%接种量弃掉多余的种子培养基,接入新鲜的发酵培养基。发酵过程通过自动流加氨水控制pH在7.0左右,培养温度36 ℃。菌体OD600=20时,添加终浓度为0.04 mmol/L的IPTG。以一定脉冲速度流加80%葡萄糖溶液,维持发酵液中葡萄糖浓度在菌体所需范围。
1.2.3 检测方法
菌体生物量测定:菌体生物量以菌体干重表示。取10 mL发酵液,13 000 r/min离心20 min,弃上清,菌体用去离子水洗涤2次,置于55 ℃恒温干燥箱中至恒重,用分析天平称重。发酵液稀释适当倍数后,测定600 nm波长下的OD值。绘制OD600值与干重对应的标准曲线。
葡萄糖浓度测定:采用SBA-40C生物传感仪测定。取发酵液1 mL离心2 min,取上清液10 μL,稀释100倍后,取25 μL稀释液直接进样读数。
L-苏氨酸浓度测定:采用高效液相色谱法测定发酵液中苏氨酸的含量。取1 mL发酵液于1.5 mL离心管中,12 000 r/min离心2 min,上清液过φ0.22 μm膜。用2,4-二硝基氟苯(DNFB)进行柱前衍生。色谱分离条件:色谱柱为Agilent ZORBAX Eclipse AAA(4.6 mm × 150 mm,5 μm),流动相A为乙酸钠缓冲液,流动相B为乙腈,采用二元梯度混合,流速1.0 mL/min,柱温33 ℃,检测波长360 nm。
有机酸浓度测定:采用高效液相色谱法测定发酵液中L-2-氨基丁酸和L-2-酮基丁酸的含量。取1 mL发酵液于1.5 mL离心管中,12 000 r/min离心2 min,上清液过0.22 μm膜。色谱分离条件:色谱柱为Bio-Rad Aminex HPX-87H,300 mm×7.8 mm),流动相为5 mmol/L H2SO4,柱温30 ℃,流速0.5 mL/min,检测波长215 nm。
2 结果与讨论
2.1 表达苏氨酸脱水酶将L-苏氨酸转化为L-2-酮基丁酸
2.1.1 过表达ilvA基因菌株的摇瓶发酵
L-苏氨酸首先在苏氨酸脱水酶催化下生成L-2-酮基丁酸,然后L-2-酮基丁酸再通过转氨基作用生成L-2-氨基丁酸。我们采取逐步延伸L-苏氨酸代谢途径的策略,首先过表达苏氨酸脱水酶(由ilvA基因编码),该酶受到L-异亮氨酸的反馈抑制。前期工作中,我们实验室保存了2个ilvA突变体ilvA2[8]和ilvA4[9],本研究将这2个突变体在pTrc99a中过表达,导入E.coliTHRD中。对菌株THRD/pTrc99a、THRD/pTrc99a-ilvA2和THRD/pTrc99a-ilvA4进行摇瓶发酵,测定菌体生物量、L-苏氨酸和L-2-酮基丁酸积累量,结果如表2。

表2 过表达ilvA菌株摇瓶发酵结果Table 2 The fermentation profiles of ilvA overexpressionstrains
注:a-菌生物量以菌体干重表示。
由表2可知,与对照THRD/pTrc99a相比,THRD/pTrc99a-ilvA2和THRD/pTrc99a-ilvA4的细胞干重大幅减少,但二者之间无明显差别。对照菌株产生23.4 g/LL-苏氨酸,并不积累L-2-酮基丁酸。携带重组质粒菌株在苏氨酸脱氨酶的作用下,L-苏氨酸积累量下降90%左右,生成较高浓度的L-2-酮基丁酸。THRD/pTrc99a-ilvA2和THRD/pTrc99a-ilvA4的L-2-酮基丁酸积累量分别为9.2 g/L和8.3 g/L,葡萄糖到L-2-酮基丁酸的转换率分别为15.4%和13.8%。由此可知,ilvA2比ilvA4具有更强的L-苏氨酸转化能力。
2.1.2 菌株THRD/pTrc99a-ilvA2的5 L发酵罐分批补料发酵
以THRD/pTrc99a为对照,对菌株THRD/pTrc99a-ilvA2进行了5 L发酵罐分批补料发酵,菌体生物量、L-苏氨酸和L-2-酮基丁酸积累量结果如图2。
由图2可见,在发酵前期,菌株THRD/pTrc99a-ilvA2与对照THRD/pTrc99a的生长速率无显著差异,但是在稳定期,THRD/pTrc99a-ilvA2的生物量仅为对照的一半左右。发酵4~16 h是THRD/pTrc99a的快速产酸期,L-苏氨酸的最终积累量为118 g/L。同样,菌株THRD/pTrc99a-ilvA2在4~16 h时快速合成L-2-酮基丁酸,最终可积累18 g/L;而发酵过程中并没有出现L-苏氨酸的过量积累,发酵液中始终维持约2 g/LL-苏氨酸,说明苏氨酸脱水酶的表达有效的将细胞合成的L-苏氨酸转化为L-2-酮基丁酸。然而,L-2-酮基丁酸的最高产量只有18 g/L,原因可能是当其积累到一定浓度时对细胞具有较强的抑制作用[10],导致菌体生长变慢和苏氨酸合成受阻。
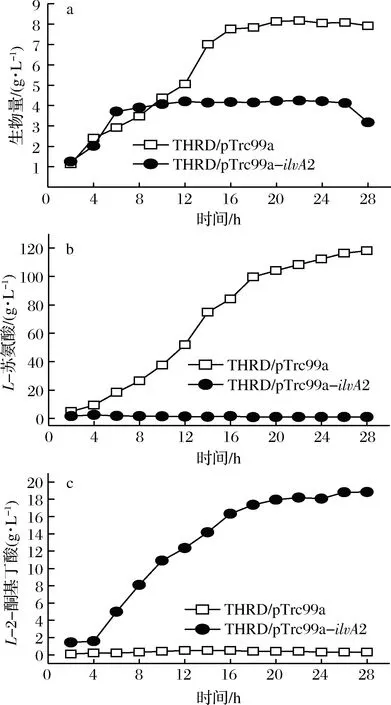
a-生物量;b-L-苏氨酸;c-L-2-酮基丁酸图2 E. coli THRD/pTrc99a和THRD/pTrc99a-ilvA25 L发酵罐发酵过程曲线Fig.2 The fed-batch fermentation process of E. coliTHRD/pTrc99a and THRD/pTrc99a-ilvA2 in a 5 L fermenter
2.2 延伸代谢途径将L-2-酮基丁酸转化为L-2-氨基丁酸
2.2.1 串联表达tyrB、gdh和bcdBS菌株摇瓶发酵
酪氨酸转氨酶、谷氨酸脱氢酶和亮氨酸脱氢酶均可以催化L-2-酮基丁酸合成L-2-氨基丁酸。本研究在pTrc99a-ilvA2质粒中串联表达来源于大肠杆菌的酪氨酸转氨酶编码基因tyrB、谷氨酸脱氢酶基因gdh和来源于枯草芽孢杆菌的亮氨酸脱氢酶基因bcdBS,将重组质粒导入E.coliTHRD。对3株菌进行了摇瓶培养,定时取样测定了菌体生物量、L-苏氨酸、L-2-酮基丁酸和L-2-氨基丁酸积累量(图3)。

图3E.coliTHRD/pTrc99a-tyrB-ilvA2、THRD/pTrc99a-
gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2摇瓶发酵结果
Fig.3 Shake flask fermentation of strainsE.coliTHRD/
pTrc99a-tyrB-ilvA2, THRD/pTrc99a-gdh-ilvA2 and
THRD/pTrc99a-bcdBS-ilvA2
由图3可知,发酵结束时菌株THRD/pTrc99a-tyrB-ilvA2、THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2的生物量比THRD/pTrc99a要显著降低,但是比THRD/pTrc99a-ilvA2(2.6 g DCW/L,
表1)略高一些。串联表达tyrB基因之后,L-2-酮基丁酸仍有9.3 g/L的积累,但是同时也产出4.1 g/LL-2-氨基丁酸。串联表达gdh和枯草芽胞杆菌的bcd基因之后,菌株的L-2-酮基丁酸积累量显著降低至仅约1.0 g/L,同时二者均产生较高质量浓度的L-2-氨基丁酸,分别为9.0 g/L和7.9 g/L。由此可见,在过表达ilvA2的基础上,再串联表达谷氨酸脱氢酶和亮氨酸脱氢酶基因,均能高效地将细胞内积累的L-2-酮基丁酸转化为L-2-氨基丁酸。因此,我们对菌株THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2进行了5 L发酵罐发酵测试。
2.2.2E.coliTHRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2的5 L发酵罐分批补料发酵
在5 L罐发酵过程中对两株菌进行定时取样,测定了生物量L-苏氨酸、L-2-酮基丁酸和L-2-氨基丁酸积累量,发酵过程曲线如图4所示。菌株THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2发酵前期生物量迅速积累,在8 h左右时达到最高值。之后THRD/pTrc99a-bcdBS-ilvA2的生物量保持缓慢下降的状态,而THRD/pTrc99a-gdh-ilvA2的生物量则快速下降。分析原因可能是从发酵8 h开始,菌株THRD/pTrc99a-gdh-ilvA2开始快速合成L-2-酮基丁酸(终积累量达到17.8 g/L),造成了菌体的衰亡;与此同时,也有部分L-2-酮基丁酸转化为L-2-氨基丁酸(终积累量为8.3 g/L)。而菌株THRD/pTrc99a-bcdBS-ilvA2
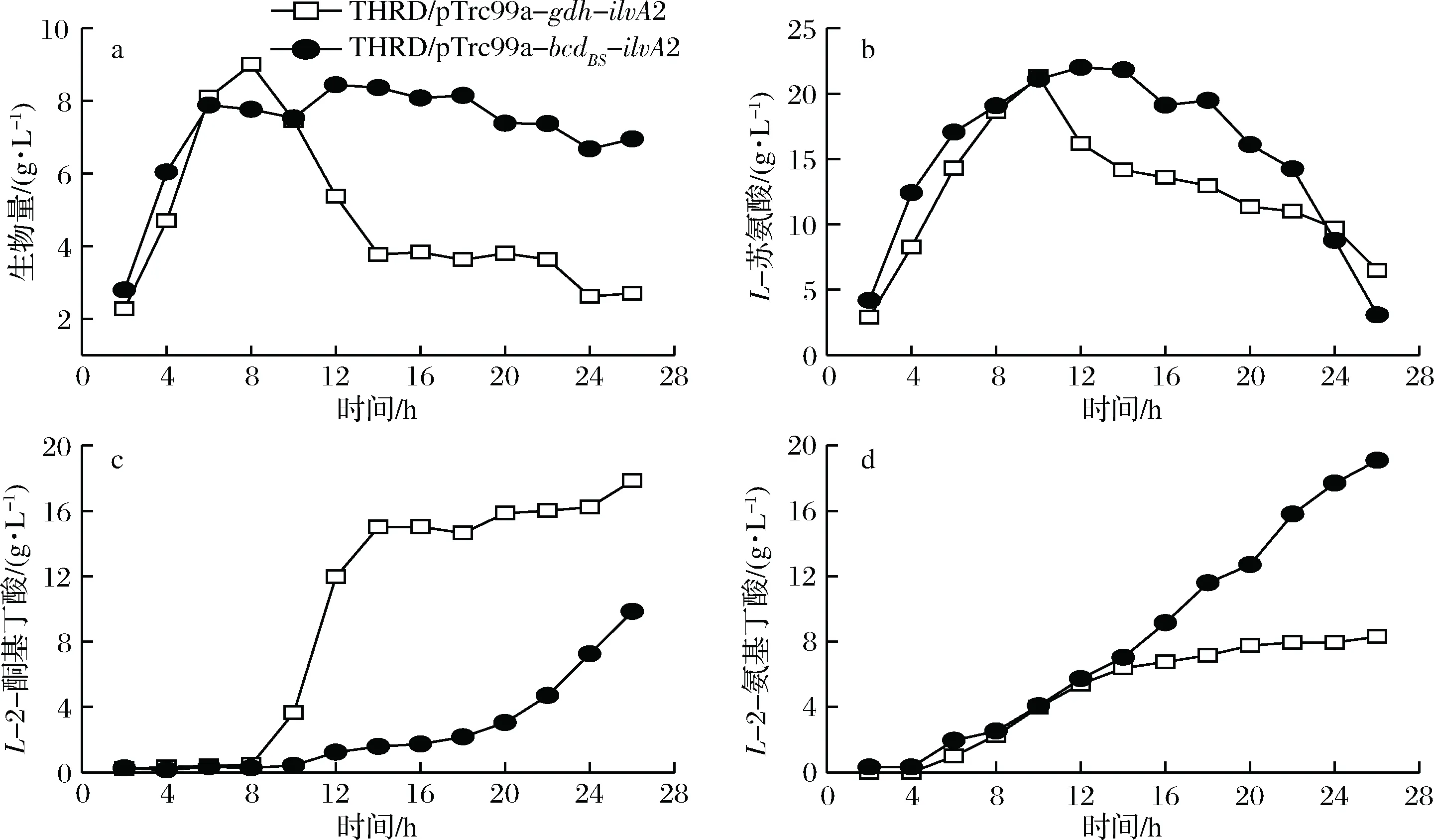
a-生物量;b-L-苏氨酸;c-L-2-酮基丁酸;d-L-2-氨基丁酸图4 E. coli THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2分批补料发酵过程曲线Fig.4 The fed-batch fermentation processes of E. coli THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2
在发酵过程中L-2-酮基丁酸和L-2-氨基丁酸均缓慢积累,终质量浓度分别达到8.3 g/L和19.1 g/L。我们之前的研究发现L-2-酮基丁酸对大肠杆菌细胞的生长具有抑制作用。DANCHIN等[11]研究发现,L-2-酮基丁酸的添加会造成糖酵解反应中6-磷酸葡萄糖、6-磷酸果糖、1,6-二磷酸果糖,以及乙酰辅酶A的浓度下降。此外,L-2-酮基丁酸还会影响AMP的循环以及mRNA的翻译,从而造成细胞生物量的下降。
5 L发酵罐发酵实验结果与摇瓶发酵结果相差较大,也说明了在构建大肠杆菌工程菌株的过程中,在摇瓶发酵初步优化结果的基础上,有必要及时进行发酵罐的测试。在摇瓶发酵中,菌株THRD/pTrc99a-gdh-ilvA2和THRD/pTrc99a-bcdBS-ilvA2发酵过程参数相当,二者均积累少量的L-2-酮基丁酸,THRD/pTrc99a-gdh-ilvA2的L-2-氨基丁酸产量甚至超过THRD/pTrc99a-bcdBS-ilvA2(图3)。在5 L发酵罐发酵过程中,2株菌L-2-酮基丁酸和L-2-氨基丁酸的总浓度相当,然而THRD/pTrc99a-gdh-ilvA2的L-2-酮基丁酸积累量显著高于L-2-氨基丁酸,而THRD/pTrc99a-bcdBS-ilvA2则恰好相反(图4)。因此,我们选择THRD/pTrc99a-bcdBS-ilvA2进行后续研究。
在5 L罐发酵过程中,培养基L-苏氨酸呈现先积累(超过20 g/L)后消耗的趋势(图4),说明在发酵前期,L-苏氨酸不能完全被转化而排出细胞,在发酵后期随着胞内L-苏氨酸的消耗,胞外的L-苏氨酸逐渐进入细胞。由于L-苏氨酸的跨膜运输需要消耗能量,因此我们探索了阻断L-苏氨酸的运输途径对L-2-氨基丁酸发酵的影响。
2.3 阻断L-苏氨酸输出途径对L-2-氨基丁酸发酵的影响
2.3.1 敲除L-苏氨酸分泌蛋白基因各菌株摇瓶发酵
大肠杆菌L-苏氨酸分泌蛋白有RhtA、RhtB和RhtC,其中RhtA同时可以输出L-高丝氨酸[12-13]。为了研究阻断L-苏氨酸输出途径对发酵的影响,本研究借助RED重组基因编辑方法[14],单独和组合敲除了E.coliTHRD中rhtA和rhtC基因,获得菌株THRDΔrhtA、THRDΔrhtC和THRDΔrhtAΔrhtC。将质粒pTrc99a-bcdBS-ilvA2转化入这3株菌中进行摇瓶发酵实验,结果如图5所示。

图5E.coliTHRD/pTrc99a-bcdBS-ilvA2、THRDΔrhtC/
pTrc99a-bcdBS-ilvA2、THRDΔrhtA/pTrc99a-bcdBS-ilvA2和
THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2摇瓶发酵结果
Fig.5 Shake flask fermentation of strainsE.coliTHRD/
pTrc99a-bcdBS-ilvA2, THRDΔrhtC/pTrc99a-bcdBS-ilvA2,
THRDΔrhtA/pTrc99a-bcdBS-ilvA2 and THRDΔrhtAΔrhtC/
pTrc99a-bcdBS-ilvA2
由图5可见,与对照菌株THRD/pTrc99a-bcdBS-ilvA2相比,菌株THRDΔrhtA/pTrc99a-bcdBS-ilvA2、THRDΔrhtC/pTrc99a-bcdBS-ilvA2和THRDΔrhtAΔrhtC/ pTrc99a-bcdBS-ilvA2的生物量无明显差异,说明敲除rhtA和rhtC基因对菌体生长影响不大。对照菌株L-苏氨酸积累量为9.25 g/L,而3株敲除菌株的L-苏氨酸积累量分别为4.9、5.1和1.1 g/L,降幅明显,说明rhtA和rhtC基因的敲除对副产物L-苏氨酸的减少具有显著作用。4菌株的L-2-酮基丁酸积累量没有太大差异,分别为1.0、2.5、1.4和1.1 g/L。而L-2-氨基丁酸的产量具有较大差异,对照菌株为7.9 g/L,其他3株菌分别达到13.5、11.2和4.5 g/L。分析以上结果可知,单敲除菌株THRDΔrhtA/pTrc99a-bcdBS-ilvA2和THRDΔrhtC/pTrc99a-bcdBS-ilvA2的L-苏氨酸积累量下降,使得L-2-氨基丁酸的产量提高;双敲除菌株THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2的L-苏氨酸积累量最低,然而并没有转化为产物L-2-氨基丁酸,其产量却下降了42.4%。双基因敲除菌株虽然L-苏氨酸积累量大幅降低,但仍有1.1 g/L的质量浓度,说明大肠杆菌还存在其他特异或非特异的L-苏氨酸输出途径。另外,双敲除菌株由于胞内L-苏氨酸的快速积累,可能强化了其他代谢途径,导致碳源流向其他副产物。
2.3.2 四菌株5 L发酵罐分批补料发酵
从摇瓶发酵结果可见,单独敲除rhtA和rhtC后,较为显著地提高了L-2-氨基丁酸的生产能力。为了进一步表征L-苏氨酸/L-高丝氨酸输出途径缺失对L-2-氨基丁酸发酵的影响,以THRD/pTrc99a-bcdBS-ilvA2相比为对照,对菌株THRDΔrhtA/pTrc99a-bcdBS-ilvA2、THRDΔrhtC/pTrc99a-bcdBS-ilvA2和THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2进行了5 L发酵罐分批补料发酵,结果如图6所示。
由图6可知,对照菌株THRD/pTrc99a-bcdBS-ilvA2在发酵过程中先积累L-苏氨酸,在12 h后L-苏氨酸逐渐转化为L-2-酮基丁酸和L-2-氨基丁酸,二者质量浓度分别达到9.9 g/L和19.1 g/L。菌株THRDΔrhtA/pTrc99a-bcdBS-ilvA2在发酵2 h后,开始快速积累L-2-酮基丁酸,导致菌体生长受阻,在发酵过程中L-苏氨酸没有明显积累;然而,在12 h后,L-2-酮基丁酸逐步转化为L-2-氨基丁酸,最终产量达到13.7 g/L。菌株THRDΔrhtC/pTrc99a-bcdBS-ilvA2发酵过程曲线与对照菌株类似,不同的是生成更多L-苏氨酸,且后期L-苏氨酸更多的转化为L-2-氨基丁酸,生成L-2-酮基丁酸的量相对较少。比较奇怪的是,双敲除菌株THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2菌体生长最好,而生成L-苏氨酸、L-2-酮基丁酸和L-2-氨基丁酸的量都很低,可能是阻断L-苏氨酸/L-高丝氨酸的分泌对产物合成途径产生了调节作用,导致碳源流向菌体生长和其他副产物的合成。由此可见,改造L-苏氨酸/L-高丝氨酸的输出途径对L-2-氨基丁酸的发酵产生了多样化影响,与对照相比,敲除rhtC基因的菌株效果较好,但是仍积累了较高浓度的L-2-酮基丁酸。此外,可能由于L-苏氨酸/L-高丝氨酸输出途径的阻断对菌体特性影响较大,导致5 L发酵罐的发酵结果与摇瓶发酵相差较大,提示我们在今后研究中有必要对代谢工程改造的过程菌株也进行发酵罐测试。

a-生物量;b-L-苏氨酸;c-L-2-酮基丁酸;d-L-2-氨基丁酸图6 E. coli THRD/pTrc99a-bcdBS-ilvA2、THRDΔrhtA/pTrc99a-bcdBS-ilvA2、THRDΔrhtC/pTrc99a-bcdBS-ilvA2和THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2分批补料发酵过程曲线Fig.6 The fed-batch fermentation processes of E. coli THRD/pTrc99a-bcdBS-ilvA2, THRDΔrhtA/pTrc99a-bcdBS-ilvA2,THRDΔrhtC/pTrc99a-bcdBS-ilvA2 and THRDΔrhtAΔrhtC/pTrc99a-bcdBS-ilvA2
3 结论
L-2-氨基丁酸是一种非蛋白质氨基酸,在化工和制药领域具有广泛的应用前景。目前还没有直接发酵法生产L-2-氨基丁酸的报道。本研究以1株L-苏氨酸大肠杆菌生产菌株出发,通过延伸代谢途径构建了L-2-氨基丁酸高产菌株。L-2-氨基丁酸最高产量达到22 g/L,但培养基中仍然存在一定浓度的L-苏氨酸和L-2-酮基丁酸。本研究结果表明延伸代谢途径合成下游产品的策略具有可行性,然而,如何将中间代谢物最大程度上转化为目标产物具有一定的挑战。本研究同时表明,对某些产品的合成而言,摇瓶发酵和发酵罐水平的发酵结果可能相差很大,在今后研究中应该重视这一现象。

