NADPH氧化酶Nox2和Nox4在小鼠肠炎中的表达及意义
肖中岳, 轩青霞, 高 强
炎症性肠病 (inflammatory bowel disease, IBD) 包括克罗恩病和溃疡性结肠炎两种疾病,患者多反复出现腹痛、腹泻、黏液脓血便等症状[1]。其病因不明,研究[2]显示,肠道黏膜屏障损伤可能是该病发病的关键环节。这种损伤是多种因素相互作用的结果。杯状细胞在肠道组织中起重要的保护作用[3]。而氧化应激反应则是炎症引起肠道损伤的重要机制,机体发生炎症时可产生大量的活性氧类 (reactive oxygen species, ROS),当ROS超出机体的清除能力,便会导致组织损伤[4]。研究[5]表明,无论在IBD患者还是在肠炎动物模型中,ROS均会增高,而且与肠道炎症的程度相关,炎症越重ROS增高越明显。烟酰胺腺嘌呤二核苷酸磷酸 (nicotinamide adenine dinucleotide phosphate, NADPH)氧化酶(NADPH oxidases, NOX) 是ROS的重要来源[5]。Nox2和Nox4均能产生ROS[4]。但有关Nox2和Nox4在炎症性肠病进程中的作用及机制仍不十分清楚。该研究使用不同浓度的葡聚糖硫酸钠 (dextran sulfate sodium, DSS) 建立不同程度的小鼠肠炎模型,通过检测Nox2和Nox4在这些肠炎组织中的表达情况,从而探讨Nox2和Nox4在小鼠肠炎发病过程中的作用。
1 材料与方法
1.1材料
1.1.1实验动物 所选健康清洁级129S/SV雄性小鼠30只购自北京维通利华公司,在河南科技大学第一附属医院动物实验中心饲养:室温20~22 ℃,湿度50%左右,每12 h交替明暗,Co60辐照灭菌饲料喂养(北京华阜康生物科技股份有限公司)。入组标准:雄性,6~8周龄,体质量20~25 g。
1.1.2主要试剂 DSS试剂购自美国MP Biomedicals公司;PAS染色试剂盒购自美国Sigma-Aldrich公司;丙二醛(malondialdehyde,MDA)检测试剂盒购自江苏碧云天生物技术研究所;总RNA提取试剂TRIzol Reagent购自美国Invitrogen公司;逆转录和实时定量PCR试剂盒购自日本TaKaRa公司;引物由上海生工生物工程有限公司合成;一抗Nox2和Nox4分别购自美国Santa Cruz公司和Gene Tex公司;SABC试剂盒购自武汉博士德生物;DAB显色试剂盒购自北京索莱宝公司。
1.2方法
1.2.1设计与取材 将小鼠以个体为单位采用掷骰子的方法(1~2点、3~4点、5~6点分别代表对照组、1.5% DSS组和3.0% DSS组)随机分配到对照组和实验组(DSS组),每组10只,适应性喂养1周,然后对照组给予高压灭菌饮用水,1.5% DSS组给予浓度为1.5%的DSS灭菌饮用水,3.0% DSS组则给予浓度为3%的DSS灭菌饮用水,自由饮用6 d,不另予饮水。足量饲料喂养,每日定时检查小鼠体质量,同时观察小鼠的体质量、摄食、饮水、活动等情况。疾病活动指数 (disease activity index, DAI) 评分参照Jackson et al[6]的实验方法进行,即体质量下降(%)、大便性状与便血分数这3项评分的总和。于造模第6天结束脱颈椎处死所有小鼠,打开胸腔,立即用1 ml注射器抽取小鼠心脏全血,室温放置10 min,3 000 r/min、 4 ℃离心10 min,取上清液于-80 ℃冻存以备使用。剖开小鼠腹腔,完整取出小鼠结肠自然状态下测量小鼠结肠长度。肉眼观察结并记录肠内容物情况,同时进行便血评分,评定方法按照张静 等[7]等实验进行:无出血为0分;结肠1/3出血为1分;结肠2/3出血为2分;全结肠出血为3分。观察结束使用预冷的PBS漂洗,自远端起始部位取0.5 cm长度结肠组织,40 g/L甲醛溶液固定,石蜡包埋,4 μm切片,备糖原染色(也称过碘酸雪夫氏染色, PAS)、苏木精-伊红 (HE) 染色及免疫组织化学等使用;接着取1.0 cm结肠组织放入RNA Later液中,-80 ℃保存,提取RNA使用;再取1.0 cm结肠组织,放入-196 ℃液氮中速冻,-80 ℃冻存待用。
1.2.2病理组织学观察 切片HE染色,每张切片400倍光镜下随机选择10个视野,观察其中100个细胞,评分标准参照Esworthy et al[8]实验进行:中性粒细胞和淋巴细胞浸润:0~3分;杯状细胞和潘氏细胞脱颗粒:0~2分;上皮细胞反应:0~3分;炎症病灶:0~3分。取6~7分为急性炎症的临界值。
1.2.3杯状细胞计数 采用PAS染色法对结肠组织中杯状细胞进行染色。每张切片在400倍光镜下随机选择10个视野(均在黏膜层选择),观察每个视野中的杯状细胞数目并记录。
1.2.4检测血清MDA含量 将血清加入硫代巴比妥酸 (TBA)在较高温度或酸性环境中反应15 min,酶标仪535 nm处测量混合物吸光度,间接测定血清中MDA含量。
1.2.5实时定量PCR检测促炎因子白介素-1β (interleukin-1β, IL-1β)、白介素-6 (interleukin-6, IL-6) 和肿瘤坏死因子-α (tumor necrosis factor α, TNF-α) 及Nox2和Nox4 mRNA表达水平 采用TRIzol法提取结肠组织中总RNA,所有操作按美国Invitrogen公司试剂盒进行。总RNA的纯度和含量使用核酸定量仪测量。使用TaKaRa试剂盒将总RNA逆转录为cDNA,-30 ℃冻存备用。冰上制备PCR反应体系(引物序列见表1),应用BIO-RAD Real-time PCR仪进行PCR反应,扩增程序:95 ℃、30 s,95 ℃、5 s,59 ℃、30 s,95 ℃、15 s,反复循环40次。以β-actin基因为内参,每样本3个复孔,采用Log10(2-ΔΔCt)法分析各指标mRNA的相对表达水平。

表1 引物序列
1.2.6免疫组化方法检测Nox2和Nox4蛋白的表达 Nox2和Nox4一抗工作浓度分别为1 ∶200和1 ∶350,阴性对照组均使用PBS溶液代替一抗。400倍光镜下随机选择10个视野,每视野观察100个细胞。染色细胞比率评分:<5%计0分,5%~25%计1分,26%~50%计2分,51%~75%计3分,76%~100%计4分;染色强度评分:无染色计0分,淡黄色计1分,棕色计2分,棕褐色计3分,最终评分为两项分值的乘积。

2 结果
2.1小鼠一般情况及DAI评分小鼠一般情况:对照组小鼠全程摄食、饮水正常,反应机警,毛皮有光泽,生长发育良好,体质量增加;1.5% DSS组小鼠造模第4天开始出现摄食、饮水减少,反应下降,并有稀便及肛周潮湿等现象,第6天数只小鼠出现血水样便,平均体质量下降,但并未超过10%;3.0% DSS组小鼠造模第3天开始出现摄食、饮水减少,之后陆续出现精神萎靡、体毛凌乱等现象,第6天近乎全部小鼠出现重度肉眼血便,平均体质量下降约23%,但无小鼠死亡。见图1A。DAI评分: 与对照组比较,1.5% DSS组和3.0% DSS组DAI评分均显著增高,其中3.0% DSS组升高最为明显(F=746.3,P<0.001)。见图1B。
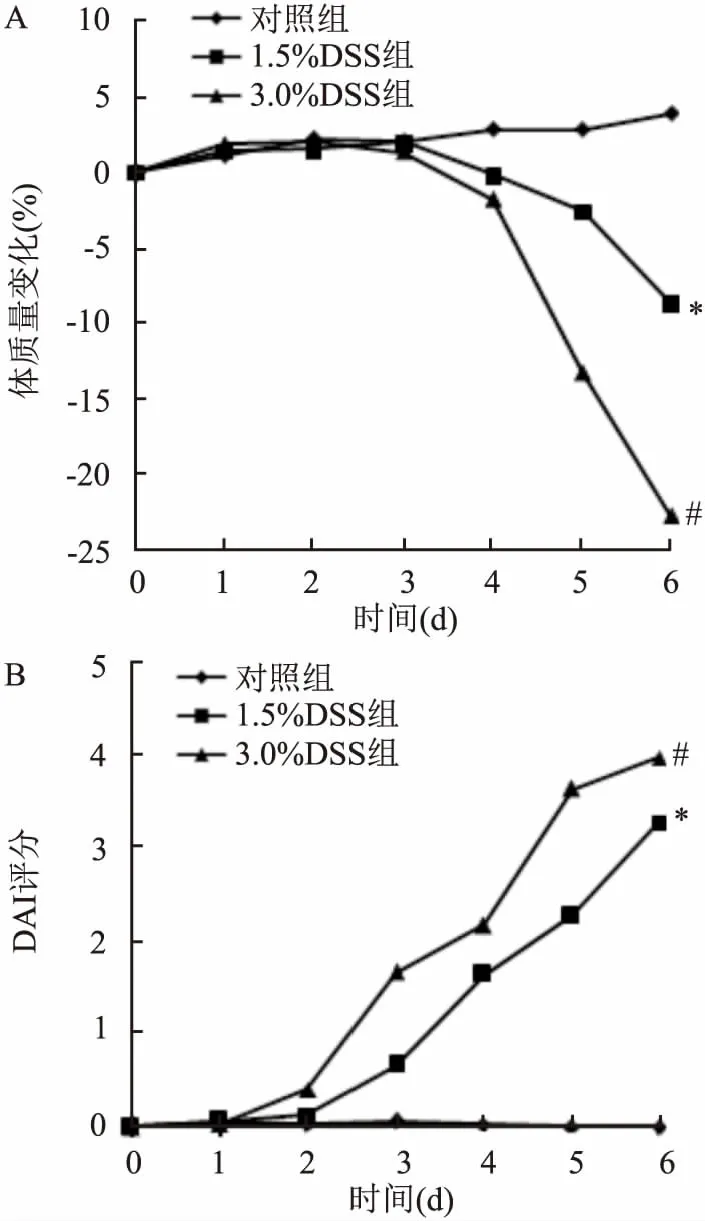
图1 各组小鼠体质量变化及DAI评分
A:体质量变化;B:DAI评分;与对照组比较:*P<0.05;与1.5% DSS组比较:#P<0.05
2.2结肠长度及血便评分造模第6天结束后处死小鼠,取全结肠测量长度,观察结肠内血便情况。结果显示:对照组所有小鼠无血便现象;1.5% DSS组小鼠结肠长度缩短,部分小鼠有血便现象;3.0% DSS组的结肠长缩短更明显,且血便现象也更加严重。各组间结肠缩短程度及血便等级结果差异均有统计学意义。见表2。

表2 各组小鼠结肠长度和血便评分
与对照组比较:*P<0.05;与1.5% DSS组比较:#P<0.05
2.3组织病理学评分及杯状细胞计数400倍光镜下观察:对照组小鼠结肠黏膜结构完整,无病理性改变;1.5% DSS组小鼠结肠黏膜结构紊乱,杯状细胞大而不规则,胞质内有少量分泌颗粒填充,杯状细胞数量减少,局部炎细胞浸润,呈轻度炎症改变;3.0% DSS组小鼠肠黏膜结构破坏严重,细胞结构排列紊乱,杯状细胞等上皮细胞大量减少甚至消失,炎细胞广泛浸润,呈严重炎症改变。与对照组比较,1.5% DSS组小鼠和3.0% DSS组小鼠炎症程度逐渐加重(F=354.0,P<0.001),而杯状细胞数量明显减少(F=385.3,P<0.001),见图2~4。

图2 小鼠结肠组织染色 ×400
A:对照组无炎症改变; B:1.5% DSS组呈轻度炎症改变;C:3.0% DSS组呈重度炎症改变;D:对照组PAS染色; E:1.5% DSS组杯状细胞减少;F:3.0% DSS组杯状细胞基本消失;A、B、C:HE染色;D、E、F:PAS染色

图3 小鼠组织病理学评分
与对照组比较:*P<0.05;与1.5%DSS组比较:#P<0.05

图4 杯状细胞计数
与对照组比较:*P<0.05;与1.5% DSS组比较:#P<0.05
2.4血清MDA含量为量化脂质过氧化程度,使用酶标仪间接测量小鼠血清中的MDA含量,与对照组比较,1.5% DSS组和3.0% DSS组MDA含量均有呈不同程度升高;其中3.0% DSS组升高更明显(F=399.1,P<0.001)。见图5。

图5 各组小鼠血清中MDA含量
与对照组比较:*P<0.05;与1.5% DSS组比较:#P<0.05
2.5结肠组织中IL-1β、IL-6和TNF-αmRNA的表达促炎因子IL-1β、IL-6和TNF-α mRNA在对照组小鼠结肠组织中均表达,且随炎症程度增加,三者表达明显升高,尤其是IL-6在1.5% DSS组升高181倍,在3.0% DSS组中升高70 000多倍。见表3。

表3 结肠组织中促炎因子mRNA相对表达倍数
与对照组比较:*P<0.05;与1.5% DSS组比较:#P<0.05
2.6小鼠肠炎组织中NADPH氧化酶Nox2和Nox4mRNA的表达增加检测Nox2和Nox4 mRNA在结肠组织中的表达,Nox2和Nox4 mRNA 随着炎症程度的增加而增加,且增加的幅度有差异(Nox2:F=56.0,P<0.001;Nox4:F=23.2,P<0.001)。见图6。
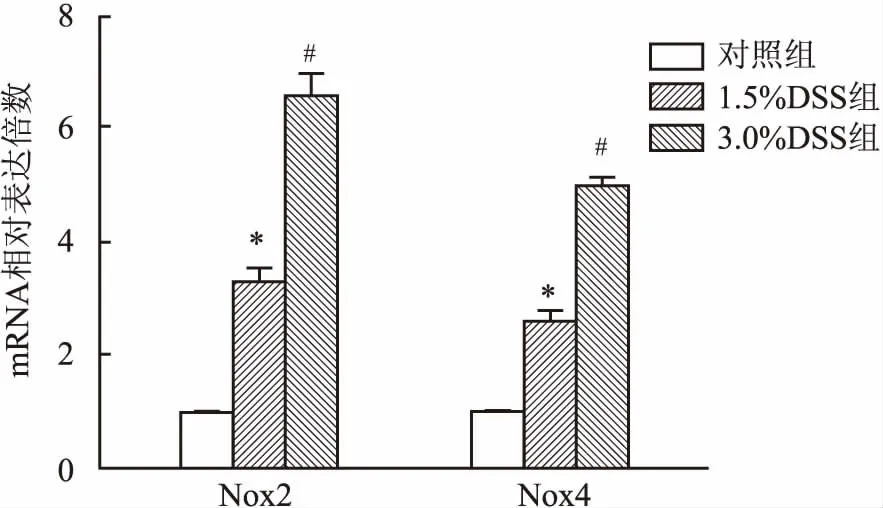
图6 结肠组织中Nox2和Nox4氧化酶表达情况
与对照组比较:*P<0.05;与1.5% DSS组比较:#P<0.05
2.7小鼠肠炎组织中Nox2和Nox4蛋白的表达增加Nox2蛋白主要表达炎细胞,如浸润的吞噬细胞和中性粒细胞中;Nox4蛋白主要表达在部分炎细胞中。Nox2和Nox4蛋白在对照组结肠组织中均无差别,在DSS组结肠组织的表达随炎症程度的增加而表达增加(均P<0.05)。见图7、表4。

表4 结肠组织中Nox2和Nox4蛋白表达
与对照组比较:*P<0.05;与1.5% DSS组比较:#P<0.05
3 讨论
IBD在西方国家是一种常见病,近年来由于环境和饮食习惯的变化及医疗水平的提高,我国IBD就诊人数明显增加[9]。IBD目前尚无特别有效的治疗方法,患者往往病程较长且容易反复,生活质量低下,更严重的是部分患者有可能发展为结肠癌[10]。本实验通过应用不同浓度的DSS诱导出不同程度的小鼠肠炎模型。该模型无论从临床表现还是病理改变等方面,都与人类溃疡性结肠炎极其相似。实验结果显示,1.5% DSS诱出呈轻度肠炎改变的小鼠模型,而3.0% DSS诱导的小鼠模型则呈重度急性肠炎改变。
杯状细胞是存在于肠道黏膜上皮中的一类分泌细胞,是肠道黏膜屏障的重要组成部分。杯状细胞只有一个分泌期,炎症初期杯状细胞分泌增多,使肠道黏膜屏障功能加强,但随着炎症加重,杯状细胞数量逐渐下降,分泌能力也下降,从而使肠道黏膜屏障的功能受到影响[11]。本研究中1.5% DSS组小鼠与对照组小鼠相比结肠组织中杯状细胞分泌黏液量增加,细胞数量下降,在3.0% DSS组小鼠结肠中很少见到杯状细胞。这一研究结果与国外的诸多研究[12]结果一致,即静止期的炎症性肠病患者的杯状细胞增多,该病活跃期时杯状细胞减少。
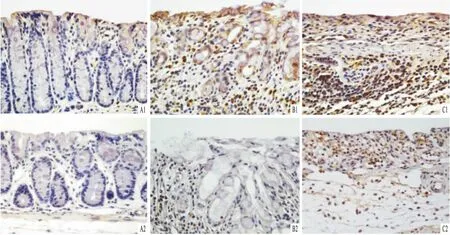
图7 结肠组织中Nox2和Nox4蛋白的表达 免疫组化染色×400 A:对照组;B:1.5% DSS组;C:3.0% DSS组;1:Nox2;2:Nox4
ROS是一类机体产生的小分子物质,可以通过激活核因子kappaB等方式介导机体产生促炎因子如IL-6、IL-1β、IL-8和TNF-α等,促进炎症反应。MDA是体内脂质过氧化的产物,可以从侧面反应机体发生氧化应激的程度。本实验结果表明,小鼠肠炎组织中IL-1β、IL-6和TNF-α mRNA水平均明显升高,且均与疾病的炎症程度呈正相关性,其中IL-6升高最为明显。另外,小鼠血清中MDA的含量也会随着炎症程度加重而增加,提示炎症可以促使机体出现氧化应激反应,且炎症越重,氧化应激的损伤就越重。
正常情况下,机体内的Nox2处于静息状态,当机体受到外界因素侵袭时体内的Nox2被激活,介导机体产生大量ROS,促进炎症的发生,提高机体对外界侵袭的抵抗能力;但当体内的ROS产生过多,超过机体的清除能力,便会引起肠上皮细胞结构与功能受损,严重时导致细胞坏死;而且ROS本身也可以通过细胞内的信号通路激活Nox2[13]。Nox2不仅可以通过调节机体氧化反应来控制机体抗菌剂的活性,也可以通过激活蛋白酶颗粒和促进中性粒细胞胞外杀菌网络的产生来抵抗细菌的侵袭[14]。Nox4在肾脏组织中有较高表达,在炎症和结肠癌中发挥重要作用[15]。本研究结果显示Nox2和Nox4 mRNA和蛋白表达趋势均一致,即在小鼠肠炎组织中的表达量较对照组增高,且随炎症程度加重表达进一步增加。Nox2只在一些特定的炎症细胞,如中性粒细胞和单核细胞中表达,Nox2 mRNA的表达增高提示炎症细胞的增加;Nox4表达于中性粒细胞和淋巴细胞,但其mRNA是由于炎症刺激导致其表达增高还是由于免疫细胞增多导致其表达增高无法确定。

