JAK2/STAT3信号对二氢杨梅素诱导骨肉瘤 MG-63细胞凋亡及其迁移的影响
吴倩,江波
(襄阳市中心医院,湖北文理学院附属医院,湖北 襄阳 441021)
骨肉瘤是一种起源于间叶组织的骨恶性肿瘤,在儿童和青少年中具有较高的发病率,一旦发病进展较快,死亡率较高。骨肉瘤的发病率约为(6~8)/100万,且近年来发病率有所上升[1-2]。临床治疗骨肉瘤的方式常见的主要是手术以及放化疗等,但由于其侵袭性强,部分患者经过治疗后病情可得到有效缓解,但仍有不少患者随后因肿瘤的转移和复发而致治疗无效[3]。目前已有的辅助化疗药物虽可抑制骨肉瘤病灶转移,但临床效果不尽人意,并常伴发各种毒副作用[4]。
二氢杨梅素(dihydromyricetin,DMY)广泛存在于植物性食物中,以药用植物龙涎香中含量较多,属于黄酮类化合物,研究证实其具有很好的控制血糖、抗凋亡、抗癌、抗动脉粥样硬化等药理活性[5]。而DMY这些活性的机制分别与促进肝糖原和胰岛素的合成[6]、上调Bcl-2和下调Bax[7]、上调Caveolin-1的表达[8]、以及抑制巨噬细胞凋亡[9]等有关。此外还发现DMY可增加CL-PARP、Bax和CL-casp3等凋亡标志物的含量,抑制Bcl-2的表达而参与STAT3/Bcl-2信号通路的调控,从而促进HNSCC凋亡[10];以及参与影响E-cadherin、MMP-9和VEGF蛋白含量的变化而降低癌细胞黏附和转移的能力[11]。这些实验结果为本研究打下基础。本文研究DMY体外对骨肉瘤MG-63细胞生长、凋亡、侵袭和迁移,以及凋亡信号通路的影响,以期为临床选用DMY治疗骨肉瘤奠定基础。
1 材料
1.1 药物与细胞
DMY购于国家标准物质网,批号MUST-13013108,HPLC测得其质量分数>99%。骨肉瘤MG-63细胞购于中国科学院上海细胞研究所,培养于本院细胞实验室。
1.2 试剂与仪器
顺铂(齐鲁制药有限公司,批号:8090162DB);胎牛血清(德国PAA公司,批号:A15108-1479);DMEM培养液(美国GIBCO公司,批号:8117050);溴化二甲噻唑二苯四氮(MTT,美国Sigma公司,批号:M2128);蛋白裂解液(Roche公司);PVDF膜(Amersham Pharmacia公司);Transwell小室(美国康宁公司);鼠抗人p-JAK2、p-STAT3、Cyclin D1(1∶500)、Bcl-xL、Bax、Bak及GAPDH 抗体(Abcam公司);Annexin V-FITC/PI凋亡检测试剂盒(美国Yeasen公司);SW-CJ-2F超净工作台(中国吴江市伟峰净化设备有限公司);2406-2型CO2培养箱(美国SHEL-LAB公司);MK3型酶联免疫检测仪(Thermo Labsystems公司)。
2 方法
2.1 细胞培养
将液氮中保存的骨肉瘤MG-63细胞取出,以最快速度放入预热至37 ℃的水浴锅中,待冻存的MG-63细胞完全融化后,加入DMEM培养液(含10%胎牛血清),接种于培养瓶,置于5%(φ)CO2、37 ℃培养箱中进行孵育,0.25%胰酶进行消化和传代,待细胞培养至对数生长期时取出进行以下实验。
2.2 MTT法检测细胞活性
将方法“2.1”中培养至对数生长期的MG-63细胞,用DMEM培养液调整密度,按每孔200 μL培养液、5×103个细胞接种于96孔培养板中,置于培养箱中继续培养24 h,将培养液吸出,随机分组,药物组分别加入10、20、40、60、80、100 μmol/L的DMY溶液进行培养,每个浓度设6个复孔,另外设空白对照组。将各板放入培养箱,继续培养至24 h、48 h和72 h后分别取出一块板,将各孔均加入2 mg/mL的MTT溶液20 μL,再次培养4 h后,将上清液移弃,加入DMSO溶液150 μL,遮光条件下充分振荡使溶解均匀,最后将酶标仪调整至492 nm,检测96孔板各孔吸光度(A)值,根据吸光度值计算细胞生长抑制率。细胞生长抑制率(%)=(A对照-A实验/(A对照-A空白)。
2.3 Annexin V-FITC/PI双染流式细胞仪检测细胞凋亡
同“2.2”取对数生长期的MG-63细胞用DMEM培养液稀释为1×106/mL的细胞悬液,接种于培养瓶中,培养24 h后随机分组,药物组加入DMY(终浓度分别为10、20、40 μmol/L),空白对照组加入等体积的DMEM培养液,将培养瓶继续培养48 h,用0.25%胰酶消化细胞,加入Binding缓冲液300 μL悬浮细胞,加入Annexin V-FITC 5 μL混匀,并于20 ℃条件下避光孵育15 min;再加入5 μL PI染色液混匀,用流式细胞仪对细胞凋亡率进行检测。
2.4 Transwell小室法检测细胞侵袭能力
在Transwell培养皿上室面的底部铺好Matrigel(预先用DMEM培养液稀释,体积比1∶8)50 μL,37 ℃下放置6 h。将对数生长期、不含血清的DMEM处理24 h的MG-63细胞接种于Transwell小室的上室中,加入DMY(浓度分别为10、20 μmol/L),空白对照孔加入相等容积的DMEM培养液,培养24 h后,取出滤膜,将表面上未侵袭的细胞用棉签除去,小室置于浓度为4%(φ)多聚甲醛中固定15 min,0.5%结晶紫溶液室温染色20 min,再用PBS缓冲液漂洗3次,风干后于光学显微镜下(放大倍数为100倍)随机选取5个视野,对膜背面的细胞数(N)进行计数,并计算平均数值,该数值大小即反映细胞的侵袭能力。侵袭抑制率=(1-N实验组/N对照组)×100%。
2.5 Transwell小室法检测细胞迁移能力
MG-63细胞的迁移实验方法是在Transwell培养皿上室的底部铺好基质胶,剩余流程同“2.4”细胞侵袭实验。计算迁移抑制率=(1-N实验组/N对照组)×100%。
2.6 Western blot法检测Cyclin D1、 p-JAK2、 p-STAT3、Bcl-xL、Bax和Bak的表达
将骨肉瘤MG-63细胞随机分组,各组分别加入不同浓度的DMY(0,10、20、40 μmol/L),培养48 h,用预冷的PBS冲洗MG-63细胞3次后加入蛋白裂解液进行裂解细胞,抽取蛋白,置于冰上30 min。并于4 ℃环境下12 000 r/min离心10 min,取上清液,每管取15 μg总蛋白加入上样缓冲液煮沸5 min,行PVDF膜(100 V 90 min)凝胶电泳,5%脱脂牛奶进行封闭1~2 h。加入一抗溶液(鼠抗人p-JAK2、p-STAT3、Bcl-xL、Cyclin D1(1∶500)、Bax、Bak及GAPDH抗体),4 ℃环境下过夜,然后用TBST洗10 min,重复3次,加入兔抗羊、羊抗兔及羊抗鼠二抗,室温下旋转孵育1 h,TBST洗涤。进行化学发光,X光片压片、显影和定影,并对数据进行分析。
2.7 统计学方法

3 结果
3.1 DMY对MG-63细胞活性的影响
MTT法检测结果表明,各浓度的DMY体外均能明显抑制人骨肉瘤MG-63细胞的增殖,与空白对照组相比,差异均具有统计学意义(P<0.01),并随着DMY浓度的增加和培养时间的延长,其抑制MG-63细胞增殖的能力逐渐增强。具体结果见表1。
3.2 DMY对MG-63细胞凋亡的影响
采用Annexin V-FITC/PI双染流式细胞仪检测发现,各浓度的DMY作用于MG-63细胞,各组凋亡率均较空白对照组明显升高(P<0.05或P<0.01)。随着DMY浓度的增大,细胞凋亡率也逐渐增大,具有浓度依赖性,见表2。
3.3 DMY对MG-63细胞体外侵袭能力的影响
结果显示,10、20 μmol/L DMY作用MG-63细胞侵袭数均明显较空白对照组低(P<0.01),提示DMY体外可抑制MG-63细胞的侵袭,该抑制能力具有浓度依赖性,与低浓度组(10 μmol/L)相比,高浓度(20 μmol/L)的DMY侵袭细胞数显著减少(P<0.05),见表3。
3.4 DMY对MG-63细胞体外迁移能力的影响
10、20 μmol/L的DMY迁移细胞数均显著低于空白对照组(P<0.01),并随浓度的增大,迁移细胞数减少,提示DMY能浓度依赖性抑制MG-63细胞的体外迁移,与低浓度组(10 μmol/L)相比,高浓度(20 μmol/L)的DMY迁移细胞数显著减少(P<0.01),见表4。

表1 DMY对MG-63细胞活性的影响Table 1 Effect of dihydrocarbamide on the activity of MG-63 cells
与空白对照组比较:**P<0.01。
表2 DMY对MG-63细胞凋亡的影响
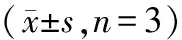

组别c/(μmol·L-1)凋亡率/%空白对照组-4.89±0.53DMY组108.11±1.75∗2020.52±1.59∗∗4027.63±2.21∗∗
与空白对照组比较:*P<0.05,**P<0.01。
表3 DMY对MG-63细胞侵袭能力的影响


组别c/(μmol·L-1)细胞数(个/视野)抑制率/%空白对照组-192.34±9.47-DMY组10119.69±11.14∗∗37.7720101.94±9.59∗∗△47.01
与空白对照组比较:**P<0.01;与DMY(10 μmol/L)组比较:△P<0.05。
表4 DMY对MG-63细胞迁移能力的影响


组别c/(μmol·L-1)细胞数(个/视野)抑制率/%空白对照组-420.18±17.11-DMY组10 289.45±23.95∗∗31.1120235.90±19.83∗∗△△43.86
与空白对照组比较:**P<0.01;与DMY(10 μmol·L-1)组比较:△△P<0.01。
3.5 DMY对MG-63细胞相关蛋白表达的影响
Western blot法检测结果显示,DMY各组Cyclin D1、p-JAK2、p-STAT3、Bcl-xL表达均减少,并且各蛋白水平随药物浓度的增加而降低;而Bax和Bak表达上调,并随浓度的增加而升高。见图1和表5。

CyclinD1p-JAK2p-STAT3BaxBakBcl-xlGAPPH1234
1.空白对照;2.10 μmol/L DMY;3.20 μmol/L DMY;4.40 μmol/L DMY。
图1DMY对MG-63细胞JAK2/STAT3通路相关蛋白的影响
Figure1Effect of dihydrocarbamide on the expression of proteins related to the JAK2/STAT3 pathway in MG-63 cells
4 讨论
龙涎香是中国南方广泛种植的药用植物,其作为中草药常用于医疗目的,包括抗肿瘤。DMY是龙涎香中发挥药理作用的主要有效成分,作为一种药食同源的天然化合物,药理作用广泛。然而其是否存在抗骨肉瘤的作用及机制尚无研究。本研究采用MTT法检测发现,随着DMY剂量的逐渐增加和培养时间的延长,其对骨肉瘤MG-63细胞体外生长的抑制能力也逐渐增强;还可浓度依赖性地诱导MG-63细胞凋亡、抑制MG-63细胞的侵袭和迁移能力。以上结果可初步证明DMY具有诱导MG-63细胞凋亡及抑制其转移的活性。细胞是在机体精密的调控下进行正常的增殖和凋亡,而肿瘤细胞由于凋亡受到抑制,增殖和凋亡水平失衡,才导致无限增殖[12]。肿瘤细胞向周围其他组织进行侵袭和迁移是引起肿瘤转移的重要原因, 也是导致肿瘤患者治疗无效和死亡的重要因素之一。通过各种机制降低细胞向远处侵袭和迁移的能力,是治疗恶性肿瘤的有效措施,也是相关凋亡因子发挥作用的结果。
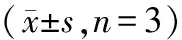
表5 DMY对MG-63细胞JAK2/STAT3通路相关蛋白的影响Table 5 Effect of dihydrocarbamide on the expression of proteins related to the JAK2/STAT3 pathway in MG-63 cells
与空白对照组比较:*P<0.05,**P<0.01。
肿瘤细胞受到各种死亡因子的刺激时,在机体调控下会激活或失活一系列的信号通路来调节其生存。JAK2/STAT3信号通路广泛存在于生物体内,是一种由多种细胞因子共同作用的信号转导通路,参与并调控细胞的生长、凋亡、免疫调节以及侵袭和迁移等多种生理变化,在肿瘤发展过程中起着举足轻重的作用[13-14]。已发现在多种肿瘤组织包括口腔癌、胃癌、膀胱癌等的侵袭转移中,均发现有JAK2/STAT3信号通路的异常活化[15-17]。JAK/STAT信号通路的组成包括酪氨酸激酶JAK家族和转录因子STAT家族[18],在该通路中,许多细胞外信号与靶细胞膜上的细胞因子受体结合并将胞质内JAK激活,活化的JAK通过与细胞膜上的细胞因子受体偶联而使其酪氨酸残基磷酸化,而磷酸化位点又与STAT 蛋白上SH2相结合,并在JAK的催化下磷酸化STAT。磷酸化的STAT与其受体亲和力降低,离开受体,2个STAT分子形成二聚体转移到细胞核与DNA结合,促进相应基因的表达,从而产生抗凋亡、促细胞生存等作用。姬颖华等[19]研究显示,白藜芦醇通过抑制IL-6的表达来调节JAK2/STAT3信号通路,促进伯基特淋巴瘤细胞凋亡。
本研究探讨了JAK2/STAT3信号通路在DMY抑制骨肉瘤MG-63细胞生长中所发挥的影响,结果表明DMY可明显抑制Cyclin D1的表达、JAK2酪氨酸1007和STAT3的磷酸化,抑制抗凋亡基因Bcl-xL而促进Bax及Bak的表达。由此可推断DMY通过调控JAK2/STAT3信号通路中有关蛋白水平的表达,从而降低骨肉瘤细胞的侵袭和迁移的能力,并诱导其凋亡。
综上所述,DMY可通过影响MG-63细胞JAK2/STAT3信号通路而抑制其生长,并诱导其凋亡,还降低其向其他组织中进行侵袭和迁移的能力,为其抗骨肉瘤的作用机制奠定了一定的基础。同时提示JAK2/STAT3通路可能是骨肉瘤治疗的新靶点,为骨肉瘤的临床治疗提供了新的出发点。

