HBx过表达对肝癌HepG2细胞AKT、PI3K表达的影响
张 斌,丁慎华,徐春江,许智玲,朱薇珊
复旦大学附属中山医院青浦分院 1. 肝病科; 2.高压氧科,上海 201700
原发性肝癌是发病率较高的恶性肿瘤,其全球发病率和死亡率分别居所有肿瘤的第7位和第4位[1],因其恶性程度高、病情进展快,患者早期一般无不适,常在局部播散或发生远处转移后才被诊断,故治疗难度大,疗效及预后差,目前对其机制还不清楚[2-4],因而积极探索肝癌发病机制是肝癌防治的关键。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)信号通路在细胞的生长、分化、增殖、迁移和存活上扮演了重要的角色,与肝癌的发生、发展密切相关[5-6]。同时,乙型肝炎病毒(hepatitis B virus,HBV)慢性感染是肝细胞癌发病的独立高危因素,整合的HBV DNA基因组编码的乙型肝炎病毒X蛋白(HBx)是一种重要的反式作用因子,能广泛激活多种原癌基因的转录表达,是肝细胞恶性转化的重要原因,被认为在肝癌发生过程中发挥直接促癌作用[7-9]。为此,本研究构建过表达HBx的真核表达载体,并转染HepG2肝癌,探索肝癌增殖的情况,同时研究其与PI3K/AKT表达的相关性,为肝癌防治提供理论依据。
1 材料与方法
1.1材料
1.1.1 细胞株:人肝癌细胞HepG2由中国科学院上海细胞库提供。细胞置于质量浓度为100 g/L胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的RPMI 1640培养液中,在37 ℃、体积分数为5% CO2充分湿度的培养箱中培养,3~4 d传代1次,取对数生长期的细胞用于实验。
1.1.2 主要试剂:RPMI 1640培养液、胎牛血清、青霉素-链霉素(100×)、质量浓度为2.5 g/L胰酶-EDTA和Pierce BCA蛋白浓度测定试剂盒均购自Thermo Fisher Scientific公司;小牛血清购自四季青公司,批号090325;四甲基偶氮哇蓝(MTT)、二甲基亚砜(DMSO)均购自Sigma公司;Trizol RNA提取试剂购自Invitrogen公司;鼠抗人SEPP1单克隆抗体购自Abcam公司,兔抗人GAPDH单克隆抗体购自上海碧云天生物技术有限公司。
1.1.3 主要仪器:多功能倒置相差显微镜(Olympus CK40),日本OLYMPUS公司产品;CO2培养箱(APT. Line CB CO2-Incubators),Binder公司产品;CKX41荧光倒置相差显微镜(OLYMPUS);超净工作台,上海净化设备厂产品;ELX-800全自动酶标仪(BioTek Synerge 2,BioTek Instruments);96孔培养板,Nunc公司;PB602-SA电子天平,MettlerToledo公司产品。
1.2方法
1.2.1 细胞培养:将冻存于液氮中的HepG2肝癌细胞接种于质量浓度为100 g/L胎牛血清的DMEM培养液中,37 ℃、体积分数为5% CO2饱和湿度的培养箱中培养,细胞处于对数生长期时进行传代,每2~3 d换液1次,长满后常规胰蛋白酶消化法传代培养。48 h后收集细胞进行实验。
1.2.2 重组表达载体的构建及鉴定:用限制性内切酶Xho Ⅰ和EcoR Ⅰ对Plvx-ires-zsgreen1表达载体和目的片段分别进行双酶切,酶切产物采用DNA凝胶回收试剂盒回收,取4 μl回收后的目的片段与2 μl载体,用1 μl T4 DNA连接酶于16 ℃过夜连接,连接产物转化大肠杆菌DH5α感受态细菌,接种于含氨苄的LB平板上培养,37 ℃过夜培养,次日挑单克隆扩大培养并小量提取质粒,对提取的重组质粒进行EcoR Ⅰ单酶切鉴定,同时进行PCR扩增并用琼脂糖凝胶电泳检测。将鉴定结果正确的质粒和阳性菌送到上海华大基因生物公司进行测序。
1.2.3 萤光素酶活性的检测:培养24 h后弃去孔中的培养基,加入足量的PBS洗涤肝癌细胞2次,每孔中加入200 μl 1×CCLR(Cell Culture Lysis Reagent),室温摇动孵育15 min,充分溶解细胞,吸取细胞裂解液转移至1.5 ml离心管中,涡旋15 s,室温,12 000×g离心15 s,吸取上清液备用。按照E1500荧光检测试剂盒说明书,以每孔取20 μl细胞裂解上清液混合20 μl Luciferase Assay Reagent的比例进行操作,使用Glomex萤光素酶检测仪分别检测得到各组细胞的萤光素酶荧光值,每组实验重复3次,取平均值。
1.2.4 MTT法检测细胞增殖:将处于对数生长期细胞以1×104浓度接种于96孔培养板,每孔200 μl,实验分组如下:(1)肝癌细胞空白组;(2)pcDNA3.1组:将空质粒pcDNA3.1转染肝癌细胞后进行培养;(3)pcDNA3.1-HBx组:将HBx转染肝癌细胞后进行培养;(4)LY294002组(50 μmol/L):采用PI3K通路抑制剂LY294002干预肝癌细胞。各组肝癌细胞培养箱孵育24 h后弃培养液,加入各组温育液,每组设10 个复孔,每孔200 μl,继续培养于24 h、48 h 后加入5 g/L MTT 液,20 μl/孔,置孵箱中再培养,4 h后吸去各孔上清,用PBS轻轻地清洗2次,加入DMSO 150 μl/孔,振荡器上振荡10 min,于酶标仪490 nm波长处测各孔吸光度(OD值)。抑制率(%)=(1-用药组平均OD值/对照组平均OD值)×100%。
1.2.5 Western blotting检测PI3K、AKT蛋白水平:以RIPR裂解液[50 mmol/L Tris(pH 7.4),150 mmol/L NaCl,质量浓度为10 g/L的NP-40,质量浓度为5 g/L的脱氧胆酸钠,质量浓度为1 g/L的SDS]收获细胞,4 ℃条件下12 000×g离心15 min,取上清液并测定蛋白浓度;蛋白上样量为20 μg,SDS PAGE胶浓度为8%,蛋白被转移至0.45 μm PVDF膜上,孵一抗(PI3K、AKT、GAPDH抗体均为1∶1 000)4 ℃过夜,TBST洗涤3次,孵二抗1∶2 000,室温孵育2 h;TBST洗涤6次;ECL发光试剂盒暗室发光、显影、定影。Bio-Rad凝胶成像系统获取图像、采用Image J图像软件进行灰度值计算。
1.3统计学分析采用SPSS 17.0软件进行统计学分析,计量资料以均数±标准差表示,采用单因素方差分析,两组间均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1真核表达载体pcDNA3.1(+)-HBx的构建及鉴定将pcDNA3.1(+)酶切片段与HBx片段连接,阳性克隆通过Xho Ⅰ和Xba Ⅰ进行双酶切,用于连接和转化至大肠杆菌DH5α感受态细胞中,挑单克隆,提取质粒,再用限制性内切酶Xho Ⅰ对重组质粒进行单酶切鉴定,电泳结果显示有235 bp的HBx条带和4 128 bp的载体条带,与预期片段大小相符,经测序进一步证明插入基因正确,获得pcDNA3.1(+)-HBx载体,表明HBx表达载体构建成功(见图1~2)。
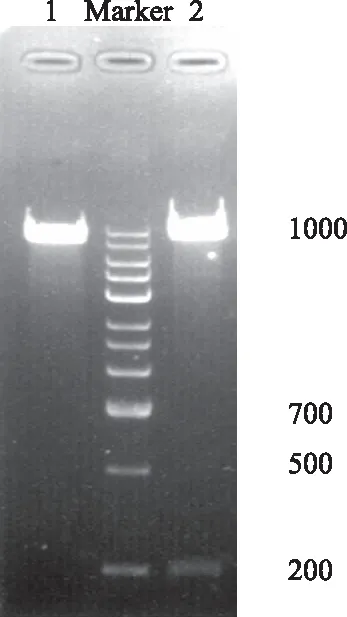
注:Marker: DLTM 1000;1: 空的pcDNA3.1(+)质粒;2: pcDNA3.1(+)-HBx质粒。
2.2荧光素酶相对活性检测经双荧光素酶表达水平检测,发现HBx转染组较pcDNA3.1(+)空载体组在HBx表达活性上差异有统计学意义(P<0.01,见图3),为进一步深入研究HBx在肝癌发病中的机制提供条件。
2.3肝癌细胞增殖比较通过各组细胞抑制率比较发现,HBx转染组有促进肝癌细胞增殖的作用,而LY294002对肝癌细胞有抑制作用,而空质粒转染组作用不明显(见表1)。
2.4HBx过表达对肝癌细胞PI3K、AKT蛋白表达的影响通过各组肝癌细胞蛋白表达水平比较,发现HBx克隆组有促进肝癌细胞AKT及PI3K蛋白表达的作用,而LY294002有显著抑制肝癌细胞AKT蛋白表达的作用,对PI3K蛋白表达作用不显著(见图4~6)。
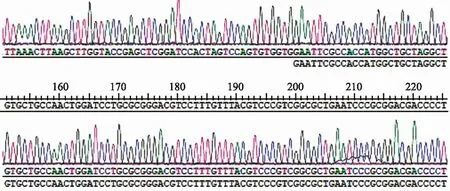
图2 重组pcDNA3.1(+)-HBx进行基因扩增后HBx部分测序Fig 2 Partial sequencing of HBx gene amplification by recombinant vector pcDNA3.1(+)-HBx

注:与pcDNA 3.1(+)比较,**P<0.01。
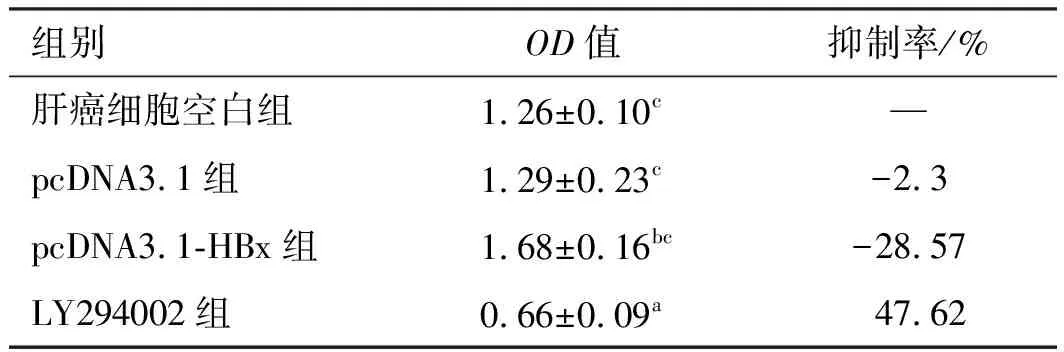
组别OD值抑制率/%肝癌细胞空白组1.26±0.10c—pcDNA3.1组1.29±0.23c-2.3pcDNA3.1-HBx组1.68±0.16bc-28.57LY294002组0.66±0.09a47.62
注:与肝癌细胞空白组比较,aP<0.01,bP<0.05;与LY294002组比较,cP<0.01,dP<0.05。

注:与肝癌细胞空白组比较,**P<0.01;*P<0.05。

注:与肝癌细胞空白组比较,**P<0.01。
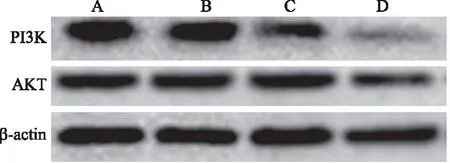
注:A:肝癌细胞空白组;B:pcDNA3.1组;C:pcDNA3.1-HBx组;D:LY294002组。
3 讨论
HBV慢性感染是肝细胞癌发病的独立高危因素。整合的HBV DNA基因组编码的HBx是一种重要的反式作用因子,能广泛激活多种原癌基因的转录表达,是肝细胞恶性转化的重要原因,被认为在肝癌发生过程中发挥直接促癌作用[7]。HBx蛋白可干扰癌细胞间的黏附连接,促进细胞外基质降解,诱导肝癌细胞发生上皮间叶表型转化(epithelial-mensenchymal transition,EMT),促进肝细胞癌侵袭转移。HBx在肝癌发病中与多种信号通路的参与密切相关,其中WANG等[8]将HBx基因转染HepG2肝癌细胞后发现有促进肿瘤增殖的作用,其机制与PI3K信号通路的激活有关。LIU等[9]采用转染HBx基因的肝癌细胞接种裸鼠后发现有促进肿瘤转移的作用,其机制与PI3K信号通路的激活也有关。本研究成功构建了过表达HBx的真核表达载体,通过转染癌细胞HepG2后,发现HBx的过表达有显著促进肝癌细胞增殖的作用,表明HBx与肝癌的发生、发展密切相关。
PI3K是一种脂类激酶,可以催化磷脂酰肌醇D3磷酸化。AKT是一种丝/苏氨酸蛋白激酶,是存在于上述两种信号传导通路的重要因子,同时也是激活PI3K下游最主要的信号分子。AKT基因控制细胞内mRNA的翻译,参与膜蛋白转运、蛋白质降解及核糖体合成等一系列生理生化过程[5]。PI3K/AKT信号通路是一条广泛存在于细胞中的信号传导通路。在细胞增殖调控中起重要作用,其主要信号分子包括PI3K、PDK1和AKT。活化的PI3K可将磷脂酰肌醇-4,5-二磷酸(PIP2)转化为磷脂酰肌醇-3,4,5-三磷酸(PIP3);PIP3可使其主要下游底物AKT准确定位到近膜区并发生构象变化,同时活化的AKT转位到细胞质和细胞核内,作用于下游底物,调控细胞代谢、蛋白合成、细胞增殖与凋亡等重要生理过程[10-13],是一种参与细胞生长、增殖、分化调节的信号传导通路。PI3K和AKT表达异常存在多种癌细胞中,与肝癌关系也很密切[14-15]。本研究中也发现,过表达HBx促进肝癌细胞增殖的同时,有上调PI3K及AKT表达的作用,表明HBx的过表达有促进肝癌细胞增殖的作用,其机制部分与上调AKT/PI3K的表达有关,值得进一步深入研究。
——一道江苏高考题的奥秘解读和拓展

