基质金属蛋白酶在稽留流产发生中的作用和调控机制研究
施林领 陆秀芳 单海燕 伯乐 李海燕 奚星澍 滕云 茅彩萍
稽留流产(missed abortion)又称过期流产,指胚胎或胎儿死亡后滞留宫内未及时自然排出[1],是产科常见的一种病理妊娠。近年来,稽留流产发病率逐渐上升,引起稽留流产的原因极其复杂[2-3],主要包括染色体因素、免疫因素、生殖道感染、内分泌紊乱、环境污染、氧化应激、社会因素等。虽然关于稽留流产的文献报道并不少,但其发病机制仍未完全明了。因此,明确其病因寻找有效的干预措施对遗传咨询及再次妊娠有重要的临床指导意义。本研究拟通过检测稽留流产与正常人工流产者绒毛组织中核转录因子NF-κB(nuclear transcription factor-κB, NF-κB)、转化生长因子TGF-β1(transforming growth factor-beta 1,TGF-β1)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)和基质金属蛋白酶组织抑制因子1(tissueinhibitor of metalloproteinase,TIMP-1)之间的相关性,探讨导致稽留流产的可能病因及发病机制,为临床诊疗提供科学理论依据。
资料与方法
一、一般资料
选择2015年11月至2016年5月期间就诊于苏州大学附属第一医院计划生育门诊和苏州市立医院北区妇产科的30例稽留流产患者作为实验组,患者既往月经规律,经人绒毛膜促性腺激素及B超动态监测证实为稽留流产,患者平均年龄(28.0±5.1)岁,孕龄(58.4±13.7) d;同时选择30例自愿要求终止妊娠的有正常生育史的同期早孕健康妇女作为对照组,平均年龄(29.2±4.8)岁,孕龄(60.8±12.4) d。
所有纳入对象满足的入选标准为(1)既往均无高血压、滋养细胞疾病、恶性肿瘤、内分泌及免疫性疾病等,且所有稽留流产均排除染色体因素所致;(2)妇科检查均排除阴道炎、宫颈炎;(3)超声提示无子宫内膜息肉、子宫黏膜下肌瘤、卵巢囊肿等;(4)孕前3个月及孕期均未服用药物,均未接触毒物及放射线。本研究经苏州大学附属第一医院和苏州市立医院北区的医学伦理委员会批准,患者及家属均知情同意并签订知情同意书。两组患者的一般资料比较,差异均无统计学意义,有可比性。
二、方法
于清宫术时获取两组患者的绒毛组织,在无菌及灭活RNA酶条件下,采集稽留流产和正常早孕妇女的流产绒毛标本,通过焦磷酸二乙酯处理过的生理盐水洗净去除粘液和血液,滤纸去除表面水分,将剔除蜕膜组织后所得的组织置于灭活 RNA 酶的冻存管中,置-80℃冷冻保存。
1.提取组织标本RNA:取冻存的待测绒毛组织约100 mg置于研钵中,加入适量液氮研磨至粉状,RNA提取操作严格按照RNeasy Mini Kit(50)(Qiagen公司,批号:74104,生产时间:2016年4月)说明书要求进行,完成后用Qubit荧光定量(Thermo Fisher公司,型号:Q33226)测定RNA浓度,RNA浓度= A260×稀释倍数×40÷1000(ug/μl)。
2.RNA的逆转录:采用PrimeScript RT reagent反转录试剂盒(TaKaRa公司,批号:RR047A,生产时间:2016年6月),将RNA逆转录为cDNA,严格按照说明书要求,根据不同样本浓度进行相应换算,然后向体系中加入相应RNA(加入量<500 ng/10 ml),操作均在冰上进行。37℃ 15 min,85℃ 5s,产物置4℃保存。反应结束后进行PCR反应。
3.mRNA表达的检测:采用RT-PCR检测两组患者绒毛组织中NFκB (NFκB p50亚基的调控基因NFκB1和NFκB p65亚基的调控基因RelA)、TGF-β1、TIMP-1、MMP-9等相关基因表达。采用ABI7500(Thermo Fisher公司,型号:4351105)对目的基因进行扩增,且在完成后对相应数据进行分析。进行的PCR反应均采用Premix ExTaq PCR反应液(TaKaRa公司,批号:RR820L,生产时间:2016年6月),反应体系及参数严格参照说明书。反应条件为 95℃ 30 s、95℃ 5 s、60℃ 34 s、95℃ 15 s; 60℃ 1min 共40个循环。均用标准品对RT-PCR的产物量进行校正,按比例稀释标准品后与待测样本同时上机,且均采用不同批次的标本重复实验3次。采用相对定量法计算mRNA的表达量,ΔC表示目的基因mRNA的相对表达量,ΔC=C(目的基因)-C(内参基因),ΔC’=ΔC(目的基因)-ΔC(标准值),目的基因的相对总量为2-ΔC’。引物由上海生工生物公司设计及合成,见表1。

表1 RT-PCR引物序列
4.蛋白表达的检测:采用Western Blot法检测患者绒毛组织中NFκB(p50亚基和p65亚基)、TGF-β1、TIMP-1、MMP-9的蛋白表达。绒毛组织蛋白质的提取,按照Trizol试剂盒(Gibco BRL公司,批号:15596026,生产时间:2016年7月)要求操作,所获蛋白质经SDS-PAGE电泳,PVDF转膜,再用5%小牛血清白蛋白室温封闭2 h,加一抗(抗体稀释度为1:1 000,内参抗体稀释度为1:2 000),于4℃保存过夜,次日取膜弃一抗,加入适量TBST洗涤PVDF膜,重复3次,每次10 min,加二抗(稀释度为1:2000)室温下1 h后,弃二抗,再更换TBST洗涤3次,每次10 min,而后行曝光等处理并用imageJ软件对灰度值进行分析。
5.血清TGF-β1的检测:嘱纳入对象术前禁食12 h,采集清晨空腹状态下外周静脉血5 ml于EATD管内,静置后离心并分离血清,于-80℃冰箱保存待测。采用酶联免疫吸附试验(ELISA)检测血清TGF-β1,试剂盒购自R&D Systems公司(批号:DY010,生产时间:2016年8月)。
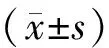
结 果
一、两组患者一般资料分析
两组患者的月经周期均规律,均排除因染色体异常导致的流产。两组患者的年龄、停经时间等比较,差异均无统计学意义,所有患者均无器质性疾病。肉眼辨认所有标本并选出典型的绒毛组织。
二、两组患者血浆TGF-β1水平检测
实验组血液中TGF-β1的平均水平为(119.34±17.81) pg/L,低于对照组的(180.75±26.28) pg/L,两组间差异有统计学意义。见表2。

表2 血浆TGF-β1检测结果
Note:Compared with the control group,*P<0.05
三、MMPs通路中关键因子mRNA表达情况
实验组绒毛组织NFκB1、TGF-β1和TIMP-1的mRNA表达量均低于对照组,差异均有统计学意义;而RelA的mRNA表达水平,两组间差异无统计学意义;实验组绒毛组织MMP-9的mRNA表达量高于对照组,差异有统计学意义。见图1。
四、MMPs通路中相关蛋白的表达
实验组绒毛组织MMP-9蛋白表达水平高于对照组,两组差异有统计学意义;实验组绒毛组织TGF-β1和NFκB p50亚基(NFκB1基因调控)、TIMP-1的蛋白表达水平均低于对照组,两组差异有统计学意义。见图2、图3。
讨 论
相对于自然流产而言,稽留流产中胚胎停育或死亡后不能及时从机体排出,易使患者发生凝血功能障碍,稽留流产的致病因素至今尚不甚明确,这些未明确的危险因素可能导致稽留流产的再次发生,具有更大的危害性[4]。因此,稽留流产病因和发病机制的探讨对其预防和治疗具有重要的临床意义。
基质金属蛋白酶(matrix metalloproteinases,MMPs)是存在于基质中降解细胞外基质(extracellular matrix,ECM)的重要水解蛋白酶,在绒毛外滋养细胞(extravillous trophoblast cell,EVT)入侵内膜基质中起关键作用,其天然的组织型抑制分子基质金属蛋白酶抑制剂(matrix metalloproteinase inhibitors,TIMPs)是有序降解和重塑ECM的关键分子[5]。既往研究报道[6-8],胚胎植入过程中MMPs的作用主要包括:(1)参与子宫内膜生长和血管生成,促进胚胎着床的同时供给着床后所需要的营养物质;(2)参与胚胎着床过程,通过对蜕膜ECM的降解,防止因胚胎滋养层细胞的突然侵袭引发出血,从而使胎囊与蜕膜脱离导致流产。MMPs和TIMPs能由胚胎滋养层细胞与蜕膜分别合成,在正常生理状态下,两者互相制衡,但MMPs和TIMPs之间的平衡在某些病理状态下也会失调,从而影响胚胎着床与生长[9]。此外,蜕膜因为侵袭过度的胚胎滋养细胞可能发生过度降解,从而导致妊娠早期出血甚至流产。其中,MMP-9在形成胎盘与建立子宫胎儿循环方面的作用至关重要。通过RT-PCR检测到实验组和对照组的流产绒毛组织中均有MMP-9的表达。本研究中,实验组MMP-9的mRNA及其蛋白表达水平均高于对照组,而TIMP-1的表达低于对照组,且差异均有统计学意义(P<0.05)。本研究结果提示,稽留流产的发生可能与MMP-9/ TIMP-1的平衡被破坏有关,为了明确导致MMP-9表达升高及TIMP-1表达降低的原因,本研究进一步对其信号通路的调控机制进行了探究。
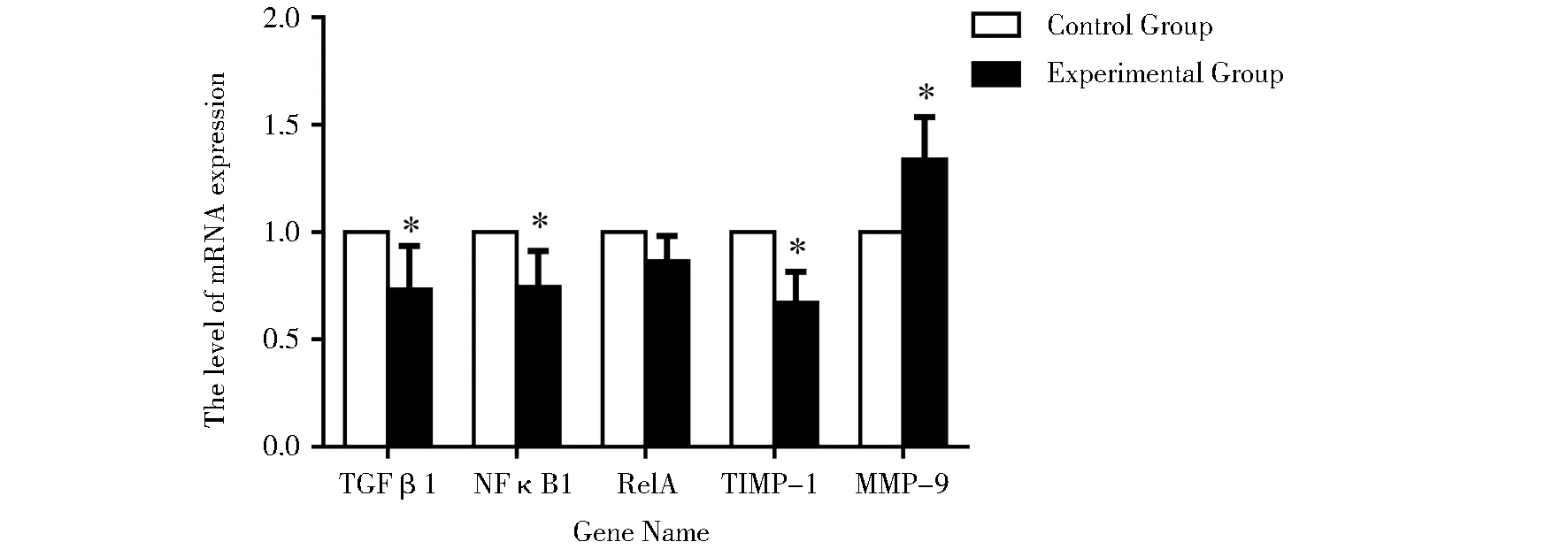
图1 MMPs通路中相关因子mRNA表达Figure 1 mRNA expression of related genes in MMPs pathway
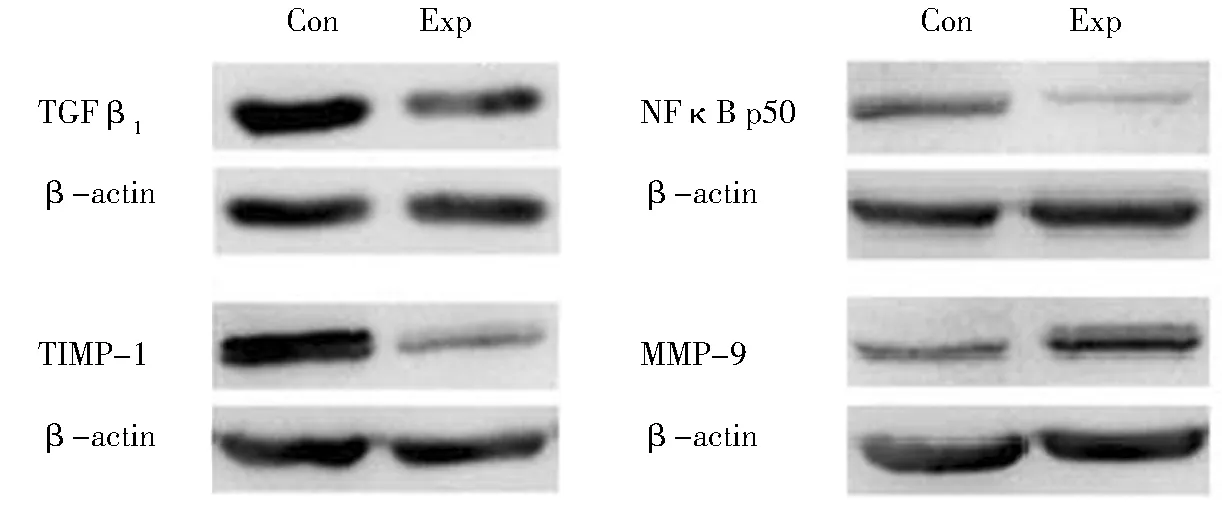
图2 蛋白印迹条带原图Figure 2 Original stripe map from Western blot

图3 MMPs通路中相关蛋白的表达Figure 3 Expression of related proteins in MMPs pathway
TGF-β1是一种多功能细胞因子,在胚胎着床、ECM产生、血管生成、细胞增殖分化及调节机体免疫系统等方面均起着重要的作用。文献报道[10-11],TGF-β1不仅可诱导TIMP-1的产生,还能调控MMP-9及其抑制物TIMP-1的侵袭力。研究发现,TGF-β1在妊娠合体滋养层细胞、绒毛及绒毛外滋养细胞以及各期胎盘组织等中均有表达[12]。本研究中,实验组TGF-β1的mRNA和蛋白表达明显低于对照组,差异有统计学意义,提示TGF-β1、TIMP-1与MMP-9可能具有一定相关性。妊娠早期,TGF-β1水平的异常降低可能引起TIMP-1的表达降低,从而打破MMP-9/TIMP-1的平衡;MMP-9表达的异常增加,使滋养细胞侵袭过深,蜕膜ECM过度降解,胚胎植入失败以及胎盘形成不良,最终导致稽留流产的发生。这表明TGF-β1对早期胚胎稳定着床可能有一定的调控作用。
NF-κB可调控TGF-β1的合成并促进其表达。TGF-β1的活化因子为组织转谷氨酰酶,其启动子中含有NF-κB的结合位点。NF-κB活化后由胞浆转移至胞核发生核转位,参与TGF-β1的合成。NF- κB 的活化由其抑制亚单位IκB的磷酸化所启动,IκB蛋白的降解激活NF-κB的p50亚单位(NFκB1基因)和p65亚单位(RelA基因),使其得以转位进入细胞核内调控基因的转录和表达。此外,MMP-9也为NF-κB 的靶基因。既往研究证实[13-14],MMP-9基因的启动子侧翼调控区存在NF-κB的结合位点,NF-κB与其结合后,能增强其启动子的活性,从而上调MMP-9 的表达,加速ECM 的降解。本研究中,实验组绒毛组织中NFκB1和RelA的mRNA水平,及对应的p50和p65蛋白的表达水平均低于对照组,而MMP-9的mRNA和蛋白的表达水平则高于对照组,差异均有统计学意义。根据以上结果推测,在NF-κB和TGF-β1均低表达时,NF-κB对MMP-9生成的促进作用大于TGF-β1对MMP-9生成的抑制作用,可能是由于过度表达的MMP-9消耗了大部分NF-κB的结合位点,余下小部分NF-κB与TGF-β1启动子结合,悬殊的作用效果导致MMP-9表达异常升高,打破了ECM合成与降解的平衡,使得滋养细胞侵袭过深引起蜕膜ECM过度降解。
综上所述,NF-κB表达水平的降低,引起TGF-β1水平的降低,可影响MMP-9 /TIMP-1平衡的调控,且MMP-9水平的异常升高,使蜕膜ECM过度降解,引起胚胎植入失败和不良胎盘形成,最终导致稽留流产的发生。本研究结果对进一步探讨稽留流产的发生发展机制提供了新的思路和诊疗策略。

