α-硫辛酸抗氧化作用机制及其在动物生殖细胞和早期胚胎中抗氧化作用的研究进展
黄自强,庞云渭,郝海生,王彦平,朱化彬*
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.北京奶牛中心,北京 100192)
人类体外受精(in vitroFertilization,IVF)在过去40年里取得了巨大进步,但仍存在许多尚待解决的问题和需要优化的程序[1]。影响IVF的因素较多,其中整个胚胎体外生产体系中的氧化应激是重要影响因素之一。体内生殖细胞和胚胎发育所处的氧气浓度较低,一般为2%~8%,但体外培养环境中氧气浓度较高,约为20%[2]。虽然体内存在酶类和非酶类抗氧化剂,但高氧环境中的抗氧化系统不足以及时清除过量的活性氧(Reactive Oxygen Species,ROS),进而对哺乳动物的生殖细胞和早期胚胎发育造成不利影响。因此,现在普遍认为ROS引起的氧化应激是精子[3]、卵母细胞[4]和早期胚胎[5]发育能力下降或发生凋亡的主要原因之一。
高氧环境条件下,精液品质降低、卵母细胞和早期胚胎的发育能力降低很可能是氧化应激造成的。有研究表明,在培养液中添加不同种类的抗氧化剂或还原剂后,精子中脂质过氧化和DNA损伤得到一定程度的缓解[6],卵母细胞成熟及其形成的早期胚胎发育能力得到明显改善[7]。α-硫辛酸(Alpha Lipoic Acid,LA)作为一种强抗氧化剂,不仅在预防和治疗氧化应激和自由基相关疾病(如糖尿病[8]、高血压[9]等)中具有重要作用,在削弱氧化应激造成的精子质量下降[10]和促进卵母细胞和早期胚胎发育能力[11]过程中也具有积极作用。因此,本文就LA发挥抗氧化作用的机制及其在动物生殖细胞和早期胚胎中发挥抗氧化作用进行综述,为进一步探明LA在生殖细胞中抗氧化作用的信号转导通路奠定理论基础。
1 ROS对生殖细胞和早期胚胎的危害
ROS是有机体氧化还原反应过程中O2转化为H2O的中间代谢产物,主要包括O2.-、过氧化氢(H2O2)、羟自由基(.OH)和过氧化亚硝基(ONOO.)[12]。当生物体暴露于不同来源的ROS时,其通过体内存在的抗氧化剂进行防御。虽然一定量的ROS是细胞发挥其正常功能所必需的,但ROS过度积累时会造成氧化应激,从而使机体内环境不利于正常的生理反应。
少量ROS有利于正常的精-卵受精过程,但高水平ROS对精子获能和顶体反应等重要生理过程具有抑制作用[13]。当ROS含量超过生理浓度时,ROS含量与精子活力呈负相关[14]。精子长期处于ROS过高环境中会导致脂质过氧化和DNA损伤,从而导致细胞膜流动性和功能的丧失,甚至产生突变效应和细胞毒性作用,最终使精子失去活力[15]。此外,冷冻精液中的畸形精子、死亡精子和白细胞自身代谢产生大量ROS,冷冻精液解冻和离心过程也会产生过量ROS,不仅改变精子活力和形态并降低其受精能力[16-18]。
体外培养环境中较高氧气浓度产生大量的ROS对卵母细胞成熟和发育具有抑制作用。卵母细胞体外培养体系中氧气浓度、葡萄糖、金属离子、紫外光照、血清等均能使卵母细胞内ROS含量升高[17]。卵母细胞中ROS产生的主要过氧化物来源包括黄嘌呤氧化酶和线粒体[19-20]。虽然线粒体是ATP和ROS产生的主要部位,但过量的ROS会影响卵母细胞线粒体的功能,使线粒体功能失调从而可能抑制细胞分裂[21]。Tripathi等[22]发现,印楝叶提取物能够通过诱导氧化应激造成卵丘细胞凋亡并降低雌激素水平和卵母细胞质量。在小鼠卵母细胞中,高水平ROS能够抑制减数细胞周期并诱导细胞凋亡[21]。此外,ROS引发的氧化应激还可诱导端粒缩短、染色体变性紊乱、卵母细胞破碎和受精失败[23]。
在早期胚胎发育所处的微环境中,ROS过量产生对早期胚胎发育具有抑制作用。大气氧浓度下培养的猪和牛胚胎中ROS含量显著升高[24-25],从而造成细胞膜和DNA损伤,并导致胚胎发育产生缺陷和延迟[26]。此外,大气中氧气浓度产生过量ROS抑制早期胚胎中基因表达[27],诱导胚胎DNA损伤[28],改变囊胚中蛋白组[29],干预胚胎发育各个阶段中碳水化合物和氨基酸代谢[30-31],使胚胎产生表观遗传学变化[32]。
过量的ROS会对动物生殖细胞和早期胚胎的结构和功能造成一定损伤,因此,研究者通过在体外培养系统中添加抗氧化剂来削弱ROS产生的氧化应激对生殖细胞和早期胚胎发育造成的影响。研究表明,褪黑素[7]、维生素C[33]、维生素E[34]、白藜芦醇[35]、茶多酚[36]等在降低ROS对动物生殖细胞和早期胚胎的损伤中发挥着重要作用。
2 LA的化学性质及其代谢
LA化学名称为1,2-二硫戊烷-3-戊酸,分子式为C8H14O2S2,相对分子质量为206.33。LA因其烷基链使之具有一定的脂溶性,羧基端极性使之具有良好的水溶性。因此,LA可以自由进出细胞并在细胞的各个部位发挥作用,这是LA作为抗氧化剂优于其他抗氧化剂的关键所在。如图1所示,LA在体内存在2种形式,即氧化型硫辛酸(LA)和还原型硫辛酸(DHLA),并且这2种形式的LA都具有抗氧化作用。
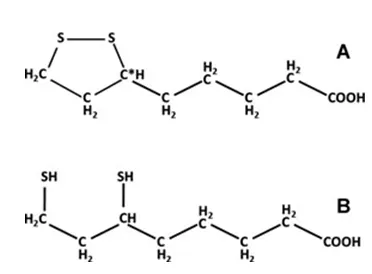
图1 LA(A)和DHLA(B)结构示意图
LA通过pH依赖途径穿过单层细胞膜,但苯甲酸和中链脂肪酸均能抑制其转运,从而表明单羧酸转运蛋白是小肠吸收LA的载体[37]。Balamurugan等[38]研究发现,LA可作为胃肠道吸收过程中钠依赖性维生素转运蛋白的作用底物,有助于胃肠道吸收。近年来研究表明,钠依赖性维生素转运蛋白是在维生素和其他重要的辅因子(如LA和生物素)迁移过程中发挥重要作用的跨膜蛋白[39]。
3 LA抗氧化作用机制
3.1 直接清除ROS LA因其具有双硫五元环的结构而具有显著的亲电能力和与自由基反应的能力。LA可以清除体内.OH、一氧化氮自由基(NO.)和ONOO.等自由基和过氧化氢、次氯酸等易于产生自由基的物质,其还原产物DHLA可以对体内常见的过氧化物自由基(ROO.)和O2.-发挥直接清除作用[40]。Ghibu等[41]发现,DHLA能够降低超氧化物驱动的对敏感自旋探针的氧化,其作用方式与超氧化物歧化酶类似。过氧硝酸盐(ONOO-)是一氧化氮(NO)和O2.-快速反应生成的一种高活性氧化剂,也是所有NO细胞毒素作用的主要介质。最近研究发现,LA和DHLA能与过氧硝酸盐反应,从而在削弱过氧硝酸盐对细胞的损伤中发挥重要作用[42]。
3.2 螯合金属阳离子 LA除了能够直接清除ROS外,还能够在体内外通过过渡态金属离子螯合作用发挥抗氧化作用。LA在体外是一种有效的二价离子螯合剂,它能够与Mn2+、Cu2+、Fe2+和Zn2+等过渡态金属离子形成稳定复合物。Ou等[43]已经证实,LA对Cu2+催化的维生素C的氧化作用具有严重的剂量依赖性抑制作用,LA也能够抑制Cu2+催化的脂质过氧化。Suh等[44]报道,LA对老年鼠脑铁含量具有保护作用,从而降低衰老相关的氧化应激。在大脑中,DHLA介导的铁和铜的螯合作用通过降低自由基损伤对阿尔茨海默症的病理过程发挥积极作用[45]。体外研究证明DHLA能够阻止Cu2+介导的低密度脂蛋白的氧化[46]。因此,体内外试验均表明螯合金属阳离子是LA发挥其抗氧化作用的重要途径。
3.3 亲电子作用 细胞在较高浓度的氧气中会产生过量ROS,ROS能够与膜磷脂反应生成与氧化应激相关的脂质亲电体。膜磷脂中多不饱和脂肪酸侧链在LA作用下产生多种氧化态磷脂产物,包括氢过氧化物和环过氧化物以及多不饱和脂肪酸在内的膜脂的过氧化作用会形成丙二醛、丙烯醛和4-羟基-2-壬烯醛(4-Hydroxy-2-Nonenal,HNE)等几类活性化合物[47]。这些醛类化合物的产生主要是细胞内微环境中促氧化作用高于自然抗氧化能力进而引起氧化应激的结果。细胞在消除活性醛过程中使用的第一道防御机制是与谷胱甘肽(Glutathione,GSH)结合。可扩散的膜磷脂氧化产物是生物活性化合物的一个重要来源,此类生物活性化合物能够对细胞蛋白质、DNA和大分子进行化学修饰。蛋白质中,半胱氨酸残基是HNE及其氧化产物4-氧烯醛(4-Oxononenal,4-ONE)的亲核目标[48]。

图2 LA和DHLA诱导细胞内基因表达的信号通路及其机制示意图[49]
3.4 LA诱导血红素加氧酶-1(HO-1)表达和细胞保护作用 如图2所示,HO-1属于细胞保护和解毒基因家族,此类基因在其调控区具有抗氧化反应元件(Antioxidant Response Element,ARE)(富含腺嘌呤(A)和尿嘧啶(U)的元件)[49]。HO-1是一种细胞保护分子,它具有强效的抗炎保护性能,此外,它的基本代谢物CO与血红蛋白(Hb)结合时具有毒性作用[50]。HO-1在血管细胞中通过抑制黏连分子和促炎细胞因子的分泌发挥抗炎作用;人内皮细胞中HO-1过表达抑制了血管细胞黏连分子-1的表达[51-53]。人单核细胞体外研究已经证实LA通过核因子E2相关因子2(Nuclear Transcription Factor-2 Related Factor,Nrf2)诱导HO-1表达[54]。最近,有研究正在探索LA预处理对暴露于As3+下的HepG2细胞中Nrf2敏感基因表达的影响,结果表明LA预处理降低了Nrf2介导的反应且对暴露于As3+下的HepG2细胞具有保护作用[55]。由此可见,LA可能通过Nrf2-ARE信号通路诱导HO-1和其他抗氧化酶的形成进而对细胞发挥保护作用。
3.5 激活生物体内其他抗氧化剂 LA的化学反应活性主要通过其二硫戊环实现。研究表明,LA/DHLA的氧化还原电势为-320 mV,而GSH/GSSG的氧化还原电势为-240 mV,这一差异表明,与GSH相比,DHLA能够更好地发挥抗氧化损伤的作用,因此LA/DHLA氧化还原反应被称为“万能抗氧化剂”[56]。如图3所示,在生物学系统中,LA在NAD(P)H驱动酶特别是硫氧还蛋白(TRx)还原酶或NADPH依赖TRx还原酶(NRT)的作用下形成DHLA。DHLA能够还原氧化型谷胱甘肽和二氢抗坏血酸使之生成GSH和维生素E。与此同时,此过程使氧气充足时不饱和脂肪酸(LH)上脂质自由基(L.)产生的过氧化氢自由基(LOO.)转变为脂质过氧化物。GSH是抗氧化系统中的关键物质,它在清除ROS和作为氧化还原缓冲剂方面具有重要的作用,可维持胞内氧化还原环境处于平衡状态。实际上,LA/DHLA氧化还原反应能够产生GSH、抗坏血酸(又称维生素C)、α-生育酚(又称维生素E)等,但不同的是,DHLA在清除自由基的过程中自身不被破坏,而且能够从LA循环产生[49]。
4 LA对动物生殖细胞和早期胚胎的抗氧化作用
4.1 LA与精子细胞 研究发现,LA主要通过降低精子脂质过氧化和提高抗氧化酶活性2个途径在提高精子质量和维护精子功能方面发挥保护作用。Ibrahim等[10]研究表明,0.02 mmol/mL LA能够提高雄鹿精子运动能力和活力并降低精子DNA损伤。Yeni等[57]发现,LA显著提高了油漆稀释剂处理的小鼠附睾精子密度、活力和质膜完整性,并显著降低了畸形精子率,进而证实LA在降低油漆稀释剂的副作用方面具有一定的保护作用,从而对人类生活产生重要意义。此外,LA能够促进抗氧化相关酶活性、降低细胞凋亡从而保护冷冻精液品质。Shen等[58]研究发现,在公猪精液冷冻膨胀剂中添加LA可显著提高解冻后精子的运动能力,精子中超氧化物歧化酶、乳酸脱氢酶、谷氨酸草酰转移酶和过氧化氢酶含量升高,人工授精结果表明6 mg/mL组妊娠率和窝产仔数显著高于对照组。因此,LA通过降低脂质过氧化反应和促进抗氧化酶的形成来提高精子总抗氧化能力,进而提高精子质量及其受精能力。
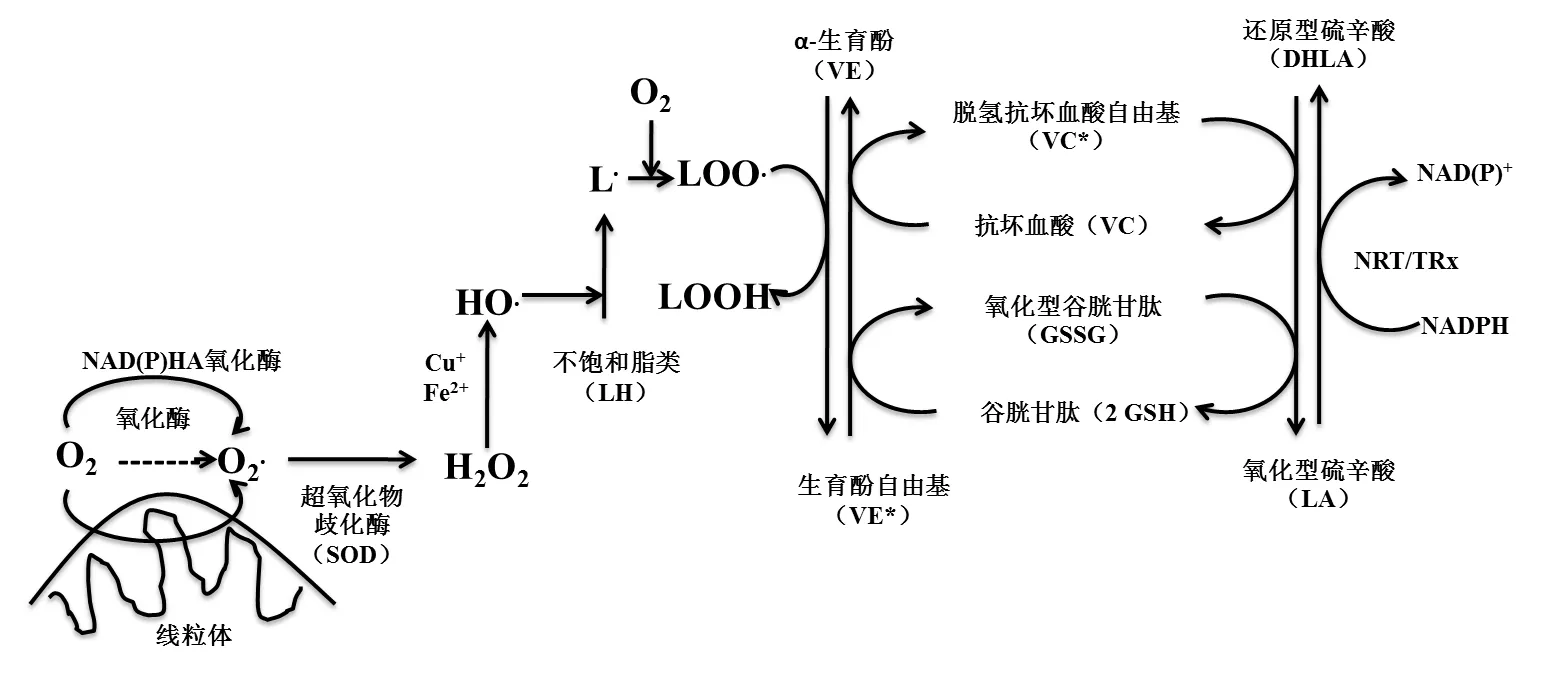
图3 抗氧化剂 LA和DHLA作用通路[49]
4.2 LA与卵母细胞成熟 卵母细胞中ROS过量升高导致的氧化应激是造成卵母细胞凋亡和发育潜能降低的主要原因。LA能够降低卵母细胞内ROS水平,从而提高其总抗氧化能力,最终提高卵母细胞发育潜能。Zhang等[11]研究表明,山羊卵母细胞体外成熟培养液中添加LA能够提高卵母细胞成熟率及其抗氧化能力。Zavareh等[59]指出,LA能够降低卵母细胞中ROS水平并提高其总抗氧化能力。以上研究表明,LA在提高山羊、小鼠等卵母细胞成熟过程中均发挥重要作用。除此之外,LA对提高玻璃化冷冻腔前卵泡的发育能力也具有重要作用。Hatami等[60]通过LA处理玻璃化冷冻腔前卵泡,显著提高了卵母细胞总抗氧化能力并显著降低其ROS水平,进而对玻璃化冷冻和新鲜卵泡的发育发挥保护作用。
4.3 LA与早期胚胎发育 LA在削弱过量ROS对早期胚胎造成的氧化损伤方面发挥着重要作用。Zhang等[11]在体外成熟培养液中添加LA可显著提高山羊体细胞核移植后的克隆胚胎发育能力。小鼠胚胎体外培养过程中添加10 μmol/L LA能够降低ROS水平并提高滋养层细胞数、总细胞数和内细胞团数[61]。老年雌鼠胚胎培养液中添加LA可显著提高早期胚胎中线粒体活性、氧化还原相关基因表达水平、ATP含量和囊胚形成率[62]。由此可见,LA可以通过提高线粒体活性、降低ROS水平、促进氧化应激相关基因表达等提高早期胚胎发育能力,但其发挥作用的信号通路仍需进一步探究。
5 展 望
LA通过清除自由基、螯合金属离子、促进其他抗氧化物质的形成等途径发挥抗氧化作用,能够降低脂质过氧化反应、DNA损伤,提高细胞总抗氧化能力和抗氧化酶活性,从而维持精子细胞、卵母细胞和早期胚胎内氧化还原状态,最终提高早期胚胎发育能力。目前,LA在生殖细胞和早期胚胎中抗氧化作用机制及其相关通路尚不清晰,因此进一步探讨生殖细胞和早期胚胎中LA的分子作用机制具有重要意义。

