熏蒸剂溴甲烷对农田土壤微生物的影响
李昌宁,李建宏,姚 拓,*,徐万里,冉 福,张建贵,李 琦
1 甘肃农业大学草业学院,兰州 730070 2 草业生态系统教育部重点实验室,兰州 730070 3 镇原县农业技术推广中心,庆阳 745000
在农业生产中,化学农药是防治植物土传病虫害的主力军,其作用不言而喻,虽然2016—2017年我国农药用量趋于下降,但总量仍很大[1]。大量农药使用后,大部分主要集中在土壤中进行生物降解和转化,这些农药不免污染土壤,影响土壤健康,甚至造成土壤退化。溴甲烷(Methyl bromide)广泛用于土壤消毒,对真菌、细菌、土传病毒、昆虫、螨类、线虫和啮齿动物以及杂草的防治有所向披靡的作用[2],但溴甲烷过量残留不仅消耗臭氧层,而且造成土壤质量恶化,影响生态平衡。根据《蒙特利尔议定书》哥本哈根修正案,发达国家于2005年淘汰,发展中国家于2015年淘汰,装运前检疫熏蒸和必要用途豁免除外[3]。
为淘汰溴甲烷,联合国环境规划署(United Nations Environment Program,UNEP)组织各国专家成立了“溴甲烷替代技术选择委员(Methyl Bromide Technical Options Committee,MBTOC)”,MBTOC对各种溴甲烷替代产品评估得出结论:目前在土壤消毒方面尚无一种物质能够完全替代溴甲烷,也没有一种物质能达到溴甲烷广谱的应用效果,因此溴甲烷仍在各国被广泛使用在一些必要用途[4- 5]。在此背景下,评估溴甲烷对土壤微生物之影响是一件非常重要的工作。土壤微生物是反映土壤健康状况最敏感的生物学指标[6],微生物在土壤发育、环境净化及维持生态平衡[7]等方面发挥着重要作用,且在农药降解和生物转化过程中发挥着核心作用[8]。其群落结构和功能的变化可以间接反映出土壤污染物的严重程度及可持续发展[9]。目前溴甲烷的研究主要集中在半衰期以及对大气、水体等影响方面,但对土壤健康以及土壤微生物影响机制(如真菌和细菌,革兰氏阴性菌和革兰氏阳性菌会如何响应溴甲烷的胁迫)尚缺乏研究[10-12]。
磷脂脂肪酸(PLFA)分析是一种快速测定土壤微生物群落结构常用的方法,根据不同类群的微生物含有指示性PLFA各异,通过提取、分离及检测这些不同指示性PLFA,可定量反映不同类群微生物的变化,能够可靠的评价微生物群落差异[13- 14]。本文选取农田土壤为实验材料,采用田间试验的方法,系统研究农田土壤真菌和细菌,革兰氏阳性菌和革兰氏阴性菌在溴甲烷胁迫下所产生的响应,为评价溴甲烷对土壤的生态风险提供微生物学诊断依据。
1 材料与方法
1.1 试验地概况与试验设计
本试验在甘肃省兰州市红古区(36°16′23″N,103°0′38″E)草莓种植地进行,该区年均气温7.6℃,全年7月份最热,1月份最冷,年均降水量327.7—349.9 mm,年蒸发量1507.8 mm,试验地土壤pH为6.8—7.4,试验地已连续种植草莓两年。熏蒸试验在事先搭建的密封小拱棚内进行,溴甲烷用量为65 g/m2(按产品说明书推荐使用量,溴甲烷纯度为98.5%,生产厂家为郑州星岛化工科技有限公司),于2016年3月14日开始进行熏蒸处理,熏蒸开始后,保持拱棚密封72 h,之后揭开棚膜通风,分别于施药第3天(揭棚膜当天)、7天、15天、30天、60天、90天采集土样(预实验表明90天时溴甲烷的影响完全消失),测定土壤微生物基础呼吸、诱导呼吸、微生物量碳、代谢熵(qCO2)、土壤微生物群落结构(PLFA)。对照地与实验地在同一地块,前茬、肥力均相同,中间设置5 m宽隔离带,对照和试验地均设三次重复,每一试验小区面积均为3 m×3 m。鉴于土壤中微生物数量的垂直分布一般是上层大于下层,本试验取0—10 cm土壤,用直径为3.5 cm的土钻按照5点法取样,去除表面植被,最后将土样混匀,剔除根系和土壤入侵物,运用“四分法”选取1 kg土样装入无菌样品采集袋中,冷藏带回实验室于-80℃超低温冰箱保存,用于土壤微生物的PLFA分析。
1.2 实验方法
1.2.1 土壤微生物呼吸测定
在实验室无菌操作台中将土样混匀、过2 mm筛,用于各项指标的测定。基础呼吸参照卢虎的方法[15- 16],具体为:称取20 g新鲜土样,调节土壤含水量至田间持水量的60%用透气性良好的纱布将土样包起来悬于培养瓶上方,然后吸取0.05 mol/L的NaOH溶液20 mL放入培养瓶中,迅速将培养瓶加盖密封,于25℃恒温培养24 h,测定CO2释放量,同时设一空白处理作为对照。诱导呼吸的测定先称取20.0 g新鲜土壤后往其内添加200 mg葡萄糖,其余步骤与基础呼吸测定方法相同。
1.2.2土壤微生物生物量碳的测定采用氯仿熏蒸浸提法[16]
土壤微生物量碳(Soil microbial biomas carbon,SMBC)SMBC测定计算公式为:
SMBC (mg/kg)=(EC-EC0)/0.38
式中,EC、EC0分别为熏蒸和未熏蒸土壤浸提液中有机碳含量,0.38为校正系数。
1.2.3 土壤微生物代谢熵
土壤微生物代谢熵(qCO2)为土壤微生物呼吸(MR)与土壤微生物生物量碳(MBC)的比值,其计算公式为:qCO2=MR/MBC[17]。
1.2.4 土壤微生物群落结构的测定(PLFA测定)
(1)土壤中脂肪酸的提取方法:土壤中脂肪酸的提取和检测主要分为4步,提取、分离、酯化、GC-MS分析[18]。
(2)分析条件:色谱柱:HP—5 MS (Agilent Technologies,Inc;60 m 0.250 mm)。升温程序为:140℃保留3 min,以4℃/min升温速率升到190℃,190℃保留1 min,3℃/min升温速率升到230℃,230℃保留1 min,以2℃/min升温速率升到250℃,250℃保留1 min,以10℃/min升温速率升到280℃,280℃保留5 min。以MS Scan模式全扫描,扫描范围50—500,离子源EI+。磷脂脂肪酸(PLFA)分类结果见表1。
1.3 数据处理
试验数据采用SPSS 20.0统计软件进行重复测量方差(ANOVA of repeated measurement date)分析,用Microsoft Excel 2010软件绘图。
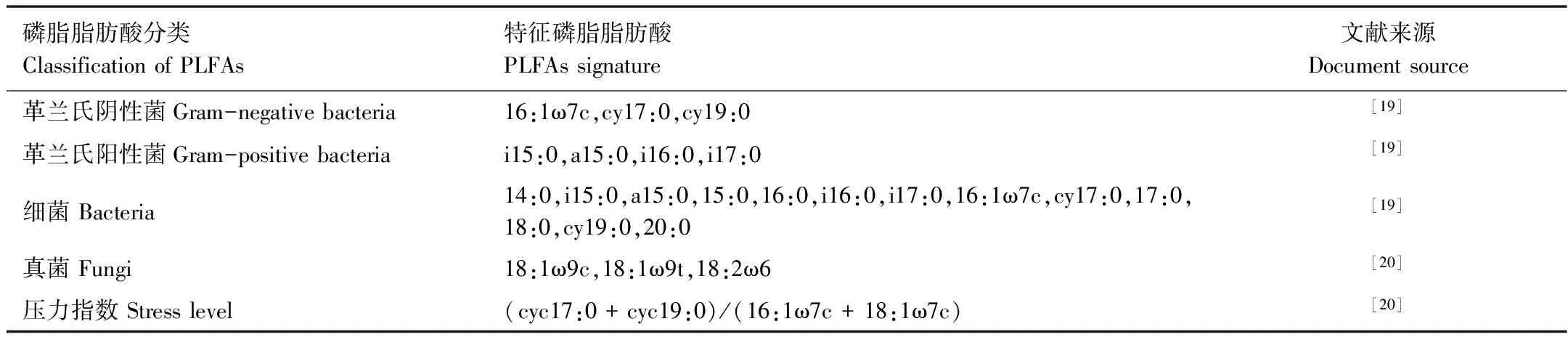
表1 特征磷脂脂肪酸(PLFA)分类
2 结果与分析
2.1 溴甲烷对土壤微生物呼吸的影响
溴甲烷的施用对土壤基础呼吸产生了明显的影响,熏蒸处理后,土壤基础呼吸强度迅速下降,第3天时(熏蒸完成当天),与对照相比,处理组土壤基础呼吸强度下降了28.5%,随培养时间延长,处理组土壤基础呼吸逐渐恢复,与对照组差值逐渐降低,但恢复过程较为缓慢,到第60天处理组与对照组相比仍相差1.67%,直到第90天,二者的差值为0.6%,并且差异显著(P<0.05)(图1)。诱导呼吸测定结果显示了相似的变化趋势,在溴甲烷处理后,土壤诱导呼吸被严重抑制,处理组在第7天、第30天,第60天差异不显著外(P>0.05),其余各天差异显著(P<0.05)。整个培养期内,处理组的土壤诱导呼吸强度都明显低于对照组,且其恢复过程比土壤基础呼吸的恢复过程更为缓慢,直到培养期结束(90天)时,处理组与对照组相比,土壤诱导呼吸的强度仍相差16.2%(图2)。
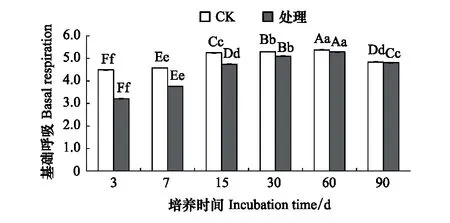
图1 溴甲烷对土壤基础呼吸的影响Fig.1 Effects of methyl bromide on soil basal respiration图中大写字母表示差异极显著(P < 0.01),小写字母表示差异显著(P < 0.05),数据为平均值加减标准误;CK:对照,control;T:处理,Treatment
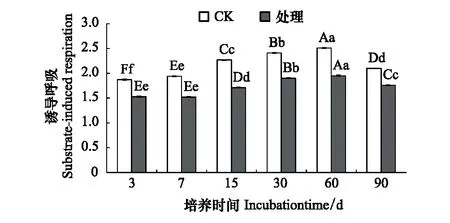
图2 溴甲烷对土壤诱导呼吸的影响Fig.2 Effects of methyl bromide on soil induced respiration图中大写字母表示差异极显著(P < 0.01)
2.2 溴甲烷对土壤微生物量碳的影响
与对照相比,溴甲烷对土壤微生物量碳存在抑制作用,且在整个培养期内,抑制作用始终存在,除第7天差异不显著外(P>0.05),其余各处理差异显著(P<0.05),在培养至第15天时,微生物量碳下降明显,之后缓慢回升,且处理时间越长,与对照组的差别越小,到第90天时达到了5.6%。这说明经过溴甲烷熏蒸处理,土壤中的微生物量碳会下降,随着时间延长,微生物量碳开始缓慢恢复,直至培养结束,仍未完全恢复(图3)。
2.3 溴甲烷对土壤微生物代谢熵的影响
微生物代谢熵是指示外界环境胁迫的指标。在培养的第3天和第7天,处理组土壤微生物代谢熵都低于对照组,其余各天处理组土壤微生物代谢熵都高于对照组,溴甲烷熏蒸处理显著增加了土壤微生物代谢熵。但随培养时间延长,处理组和对照组的差值逐渐降低,在培养结束时(第90天)任相差5.1%(图4)。
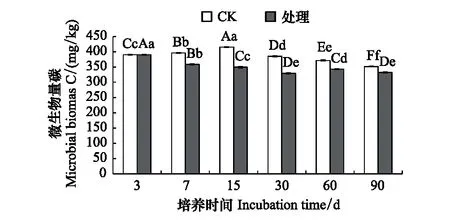
图3 溴甲烷对土壤微生物量碳的影响Fig.3 Effects of methyl bromide on soil microbial biomass carbon
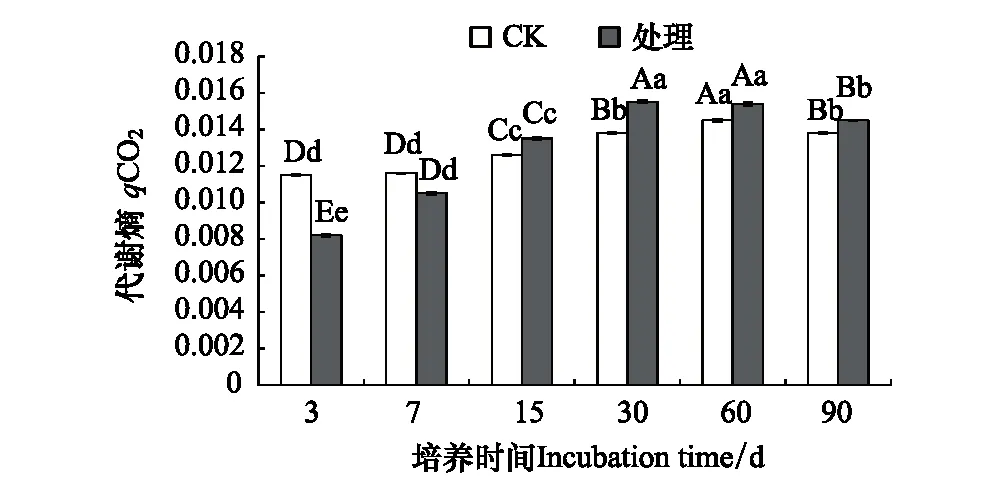
图4 溴甲烷对土壤微生物代谢熵的影响 Fig.4 Effects of methyl bromide on metabolic entropy of soil microorganism
2.4 溴甲烷对土壤细菌、真菌的影响
溴甲烷对土壤中细菌存在抑制作用,整个培养期内,溴甲烷处理土壤后处理组细菌含量较对照下降0.64%—8.72%,总体上随着培养时间的延长,细菌含量表现出逐渐增加趋势,但其含量一直低于对照组,直至培养结束没有恢复到对照水平(图5)。在整个培养阶段内,除第3天外,真菌显著被抑制,表明真菌对溴甲烷也同样敏感,第60天以后真菌含量出现下降趋势(图6)。
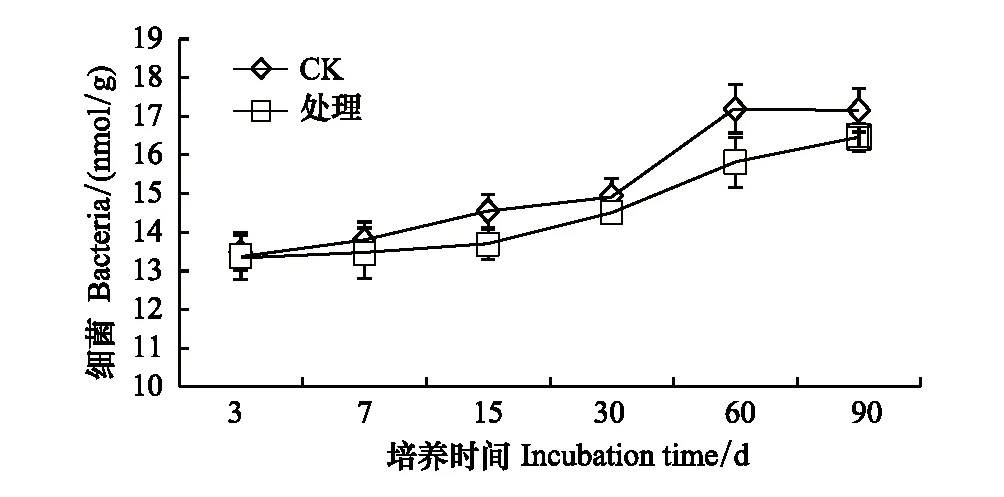
图5 溴甲烷对土壤细菌的影响Fig.5 Effects of methyl bromide on Soil Bacteria
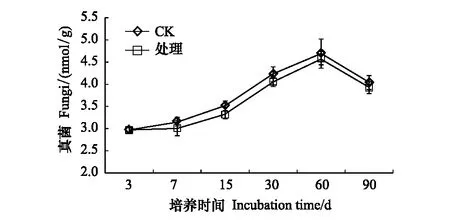
图6 溴甲烷对土壤真菌的影响Fig.6 Effects of methyl bromide on soil fungi
2.5 溴甲烷对土壤微生物群落结构的影响
GN整体呈现先下降后增加的趋势,第7天开始,处理组土壤中GN的数量低于对照,整个培养期内,其都被显著抑制,且没有恢复,在第15天时抑制作用最大,下降12.6%(图7)。GP从第7天到第60天都被显著抑制。到培养期结束,GP的量下降0.26%,GN下降10.42%,说明GN的变化具有滞后性(图8)。土壤中细菌/真菌(即Bacteria/Fungi,简称B/F)和革兰氏阴性菌/革兰氏阳性菌(GN/GP)值常用来评价不同处理间土壤微生物群落结构的差异。B/F在培养过程中呈现先降低后增加的趋势,在培养第60天时比值最低下降6.29%(图9)。溴甲烷处理也改变了土壤GN/GP,但对GN/GP的影响比对B/F的影响更为显著(图10)。
2.6 溴甲烷对土壤微生物压力指数的影响
溴甲烷处理下,土壤微生物压力指数显著提高。除第3天,第60天外,整个培养期内处理组压力指数始终高于对照,说明施用溴甲烷后,土壤微生物受到了持续的外源压力胁迫,使微生物群落结构的压力指数显著升高(图11)。
2.7 溴甲烷对土壤总PLFA的影响
在90天的培养过程中,处理组土壤微生物总PLFA含量较对照下降0.54%—6.86%,总体上随着培养时间的延长,PLFA表现出从低到高的增长趋势,但不同的培养时间段略有差异,在第60天时,PLFA的值最高,之后呈下降趋势。在整个培养时间内,溴甲烷显著抑制总体PLFA(图12)。
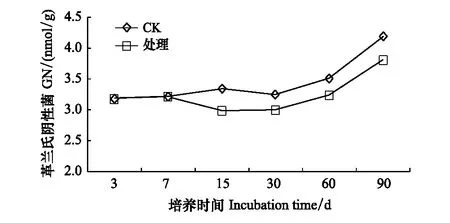
图7 溴甲烷对土壤革兰氏阴性细菌的影响Fig.7 Effect of methyl bromide on soil gram-negative bacteria
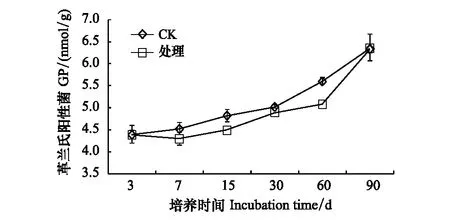
图8 溴甲烷对土壤革兰氏阳性细菌的影响Fig.8 Effects of methyl bromide on soil gram positive bacteria
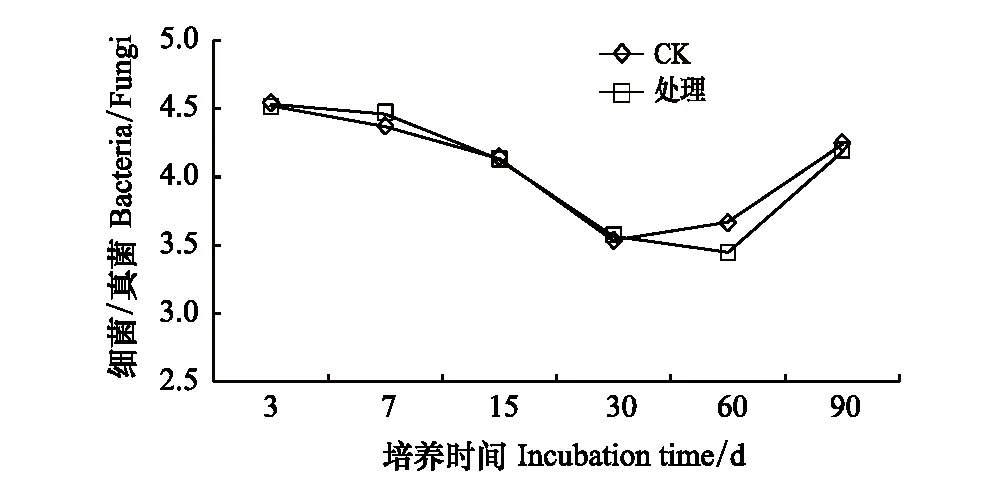
图9 溴甲烷对土壤B/F的影响Fig.9 Effect of methyl bromide on soil B/F
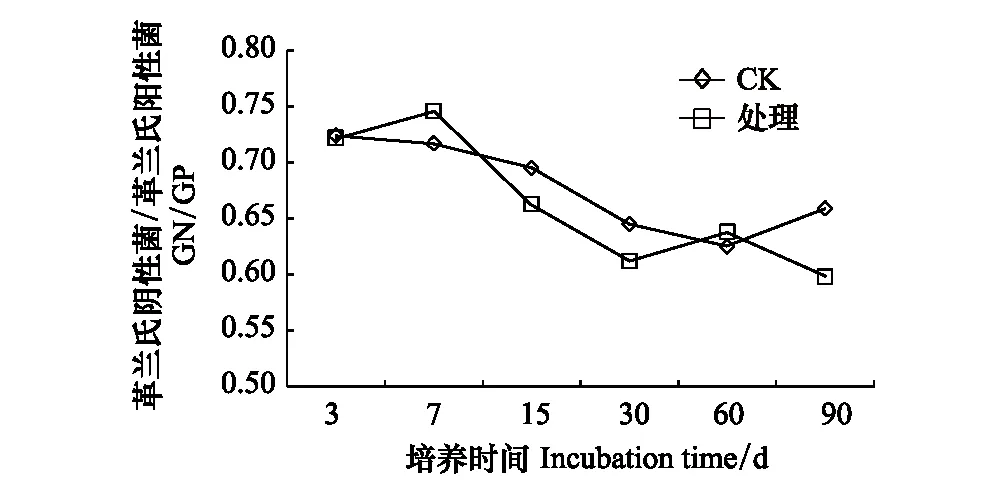
图10 溴甲烷对土壤GN/GP的影响Fig.10 Effects of methyl bromide on soil GN/GP

图11 溴甲烷对土壤微生物压力指数的影响Fig.11 Effects of methyl bromide on soil microbial pressure index
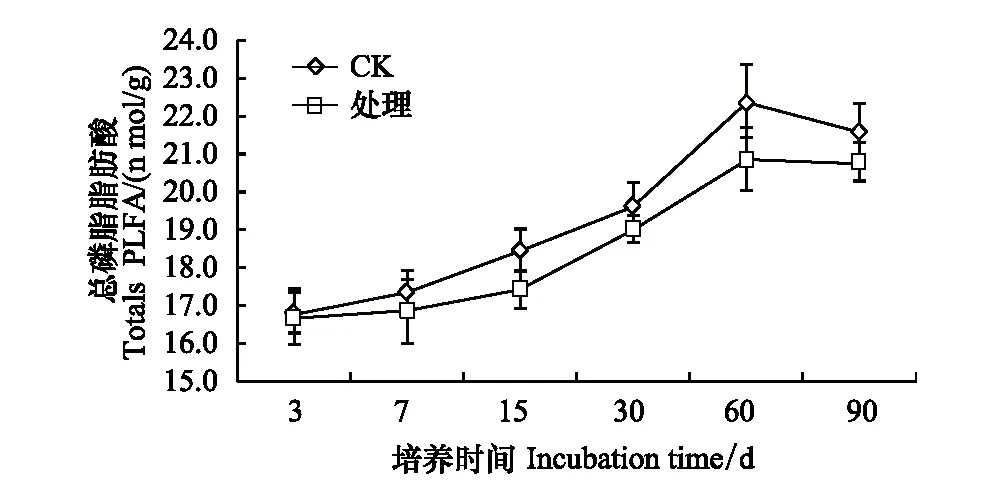
图12 溴甲烷对土壤总PLFA的影响Fig.12 Effect of methyl bromide on total PLFA in Soil
3 讨论
3.1 溴甲烷对土壤微生物生态过程的影响
试验发现溴甲烷对土壤微生物量碳存在抑制作用,在熏蒸处理第15天时,土壤微生物量碳下降至15.7%,此时微生物量碳下降值最大,且处理时间越长,与对照的差别越小。可能的原因是溴甲烷熏蒸产生的蒸汽能同微生物体内的巯基结合,使微生物内的多种酶类产生渐逆和不可逆的抑制作用,致使土壤微生物量碳的代谢过程减弱;截止第90天,仍与对照相差5.6%,可能是溴甲烷熏蒸产生的蒸汽生成强酸性物质,使细胞肿胀腐烂或脱水,细胞内蛋白质沉淀,细胞中毒死亡,微生物代谢过程减慢[21]。因此,溴甲烷熏蒸处理能够显著降低微生物量碳的含量,张成霞、南志标[22]发现土壤微生物量碳对环境变化敏感,能够较早地指示生态系统功能之变化,土壤微生物组成及活性改变会导致微生物固碳能力下降。此外,本研究发现,在90天的培养过程中,土壤细菌和真菌的数量都呈下降趋势,土壤微生物生存受到胁迫,微生物压力指数增大,细菌和真菌的变化范围分别为0.64%—8.72%和0.03%—5.61%,且细菌数量锐减具有滞后性。表明溴甲烷对某些敏感的细菌和真菌存在严重毒害作用,从而导致敏感菌群大量死亡,究其原因,可能是细菌对熏蒸剂溴甲烷的敏感性大于真菌,致使细菌的均匀度和丰富度降低的幅度大于真菌[23];吴小虎研究表明农药甲霜灵对土壤微生物总体活性具有抑制作用,但随着时间的延长,土壤微生物会逐渐适应胁迫环境[15]。Tanaka[24]和燕平梅[23]研究表明用熏蒸剂熏蒸土壤后不仅目标微生物被抑制,还使非目标微生物、尤其细菌类型受到强烈的抑制,这也与本研究溴甲烷处理后细菌和真菌都被显著抑制,其细菌丰度下降最为明显具有一定的相似性。本研究还发现从第15—90天,处理组土壤微生物代谢熵都高于对照组,在培养结束时(第90天)任相差5.1%,说明用溴甲烷熏蒸后,微生物呼吸所消耗碳的比例增大,而用于建造微生物细胞碳的比例相对减少,使土壤代谢效率和有机质活性较低,不利于土壤优良性状的保持[25]。故熏蒸剂溴甲烷不仅改变土壤中微生物群落结构,还使土壤呼吸作用减弱,其物质代谢减慢,降低了微生物碳代谢过程,影响到土壤生态系统进程[26- 27]。
3.2 溴甲烷对土壤微生物群落结构的影响
试验发现GN对溴甲烷的敏感性强于GP,并且GN的恢复时间比GP长,而GP从第7—60天都被显著抑制。到培养期结束时,GP下降0.26%,GN下降10.42%,说明GN的变化具有滞后性。可能的原因是GN细胞壁较为复杂,不仅含有肽聚糖,其细胞壁外还有由脂多糖、磷脂和脂蛋白等若干种蛋白质组成的外膜能够有效的阻止或减缓有害物质或恶劣环境对细胞的迫害,从而保护细胞的正常生长代谢,而GP细胞壁结构简单,只含有90%肽聚糖和10%磷壁酸,其对抗外界环境变化的缓冲能力较弱[27]。Li等研究表明,施用溴甲烷对GN的影响时间长于GP,而且可以影响土壤微生物的多样性[28],这也与本试验的结果相吻合。另外,本研究发现GN在第30天后较对照而言抑制作用逐渐减弱,这是由于是GN对外界环境有较强的耐性,在GN适应了溴甲烷的熏蒸胁迫后能利用外界的碳源促进自身的生长所致[29],罗玮等[27]分离的一株GN(铜绿假单胞菌Pseudomonasaeruginosa)能够以乙草胺为碳源对其降解率达到72%—80%,其他药物的实验也得出了相似的结论,说明GN会利用熏蒸剂溴甲烷为碳源进行分解作用,从而刺激GN的生长,此时表现出丰富度、均匀性和多样性都呈增长的趋势[30- 31]。
4 结论
熏蒸剂溴甲烷使土壤微生物基础呼吸和诱导呼吸受到抑制,土壤微生物量碳含量减少,代谢熵(qCO2)增加,且对诱导呼吸和微生物量碳的影响更大,具有滞后性。溴甲烷能够减少PLFA含量,显著抑制B和F丰度,降低GN和GP的多样性,使土壤微生物的压力指数增加,土壤微生物受到了长期的、持续的外源压力胁迫,但对GN/GP的影响比对B/F的影响更为显著。虽然土壤有自净能力,但这这一过程较为缓慢,因此,实际应用中应充分考虑溴甲烷对土壤微生物带来的负面影响。
——硫酰氟熏蒸应用技术

