干酪乳杆菌发酵液中的主要有机酸及其抑菌性
,,,,*
(1.西京学院医学院,陕西西安 710000; 2.昆明理工大学生命科学与技术学院,云南昆明 650000; 3.长春生物制品研究所有限公司,吉林长春 130000)
乳酸菌(lactic acid bacteria,LAB)是革兰氏阳性菌,无孢子,无鞭毛,不能运动,是发酵碳水化合物产生酸类物质的一类细菌的统称。乳酸菌通过其产生的次级代谢产物,如有机酸、细菌素、过氧化氢等物质,抑制病原菌和腐败菌的生长繁殖,从而达到防腐作用。乳酸、甲酸、乙酸、丙酸等是乳酸菌分泌产生的有机酸的主要成分,这些有机酸可以通过降低微生物生长环境体系的pH,达到抑制病原菌生长繁殖的目的,并由此发挥生物防腐作用[1-2]。在食品行业中,由于乳酸菌分泌的次级代谢产物具有提高食品口感、增强营养、延长保质期等优点,所以食品生物防腐方面具有至关重要的作用[3]。随着食品安全问题的日益激化,乳酸菌的研究和应用越来越受关注,希望尽快将乳酸菌应用于生物防腐领域,使其不但能解决因食源性病原菌污染食品导致的疾病爆发,同时也能提高食品的营养价值。
干酪乳杆菌(Lactobacilluscasei)属于乳杆菌属(Lactobacilluas),可发酵产生有机酸、细菌素等多种抑菌物质。干酪乳杆菌能够抑制和杀死食品中的许多腐败菌及致病菌,可以改善食品特性,不影响食物性状,且对食品储藏过程中的防腐保鲜也有积极作用[4]。目前,有关于干酪乳杆菌产细菌素的分离纯化和抑菌效果的研究[5-6],但缺乏对其发酵液中有机酸分离与抑菌活性的报道。本文旨在研究一种干酪乳杆菌发酵液中有机酸的有效分离方法,并研究其抑菌活性,为将干酪乳杆菌及其代谢产物开发为新型生物防腐剂提供依据。
1 材料与方法
1.1 材料与仪器
干酪乳杆菌AS02菌株 为本实验室从云南传统发酵豆豉中筛选得到;食源性病原菌大肠杆菌Escherichiacoli(E.coil)O157∶H7菌株、金黄色葡萄球菌Staphylococcusaureus(S.aureus)、单核细胞增生李斯特菌Listeriamonocytogenes(L.monocytogenes) 为实验室保藏菌株;胰蛋白胨(优级纯)、酵母膏(分析纯)、牛肉膏(99.5%)、吐温-80(100%) 英国OXOID;甲醇(99.9%)、乙腈(99%) 美国Merck;乳酸(99%)、苯乳酸(99%)、柠檬酸(99%)、乙酸(99%) 德国Sigma;其他化学试剂 均为国产分析纯。
MRS肉汤培养基、BHI液体培养基、LB液体培养基 根据文献[7-8]方法配制,MRS琼脂培养基添加1.5%琼脂,LB软琼脂培养基和BHI软琼脂培养基添加0.75%琼脂。
GHP-9160恒温培养箱 上海一恒科学仪器有限公司;SW-CJ-1B超净工作台 苏净安泰公司;ZWY-111C恒温摇床 上海智诚分析仪器有限公司;3-18K高速离心机 SIGMA;YP1002N电子天平 上海恒平科学仪器有限公司;SX700高压灭菌锅 日本TOMY;Ultrospec 2100 pro紫外分光光度计 Amersham Biosciences;AS-600微量pH计 日本株式会社。
1.2 实验方法
1.2.1 干酪乳杆菌AS02菌株生长曲线及pH动态监测 使用MRS液体培养基将干酪乳杆菌AS02活化后,按1×109CFU/mL接种于MRS培养基中,置于37 ℃静止培养72 h,每隔2 h取一次样,在2863×g[9]、4 ℃离心10 min,得到上清和菌体。随后用0.9%生理盐水对菌体进行适当稀释,用紫外分光光度计测定其在600 nm处的吸光度,用麦氏比浊法估算其菌落数,利用pH计测定并分析培养上清液的pH变化[9]。
1.2.2 干酪乳杆菌AS02菌株发酵液的制备 将活化好的干酪乳杆菌AS02菌株按1×109CFU/mL接种于MRS液体培养基,置于37 ℃静止培养,每隔2 h取1 mL菌液离心(2863×g,4 ℃,10 min),取样至72 h,2863×g,4 ℃离心10 min,取其上清,然后使用0.45 μm超滤膜将其过滤灭菌,并放置于4 ℃备用[10]。
1.2.3 干酪乳杆菌AS02发酵液抑菌活性的动态监测 采用agar well diffusion(打孔)法[11],将活化的E.coliO157∶H7菌株添加至20 mL LB软琼脂培养基中,S.aureus和L.monocytogenes分别添加至20 mL BHI软琼脂培养基中,病原指示菌的接种浓度均为106CFU/mL,用直径为7 mm的打孔器在凝固的培养基中打孔,随后分别取300 μL AS02菌株培养上清过滤液,添加至培养基孔内,对照组为等量的MRS液体培养基,37 ℃静置培养16 h,测定抑菌圈直径,每个实验组设3个平行。
1.2.4 干酪乳杆菌AS02菌株发酵液中有机酸的分离 使用MRS液体培养基将干酪乳杆菌AS02活化后,按1×109CFU/mL接种于MRS液体培养基中,置于37 ℃静止培养48 h,于4 ℃、2863×g离心30 min,弃去菌体沉淀,得到培养上清液,取上清加入蛋白酶K(0.5 μg/mL),30 ℃温育4 h,再通过0.45 μm超滤膜超滤,超滤后得到的上清液用等体积的乙酸乙酯萃取3次,萃取后得到上层乙酸乙酯相、中间层白色絮状沉淀相和下层水相,对上层乙酸乙酯相在40~45 ℃,120 r/min条件下进行旋蒸浓缩,对中间层白色絮状沉淀相在 35~40 ℃、120 r/min条件下进行旋蒸浓缩;对下层水相在60~65 ℃,120 r/min条件下进行旋蒸浓缩,以上均按照10倍体积浓缩,浓缩后得到乙酸乙酯相旋蒸相、乙酸乙酯相旋蒸余相、中间相旋蒸相、中间相旋蒸余相、水相旋蒸相和水相旋蒸余相,浓缩后的各相液体置于4 ℃保存[12]。
1.2.5 干酪乳杆菌AS02菌株发酵液各萃取相抑菌活性物质抑菌试验 采用spot-on-lawn[13]改进法对浓缩后的各相进行抑菌试验;spot-on-lawn改进法的优点是为其提供固相支持物,充分考虑抑菌因子分泌的细胞群体感应效应,并能更加真实地模拟发酵环境,具体步骤如下:吸取5 μL各相,分别滴加于含有106CFU/mL指示菌的25 mL且含0.75%凝胶琼脂固体平板(E.coliO157∶H7采用LB凝胶琼脂固体平板,S.aureus和L.monocytogenes采用BHI凝胶琼脂固体平板)中,将平板先置于4 ℃冰箱中,使各抑菌相均匀扩散2 h后,再倒置放入30 ℃的培养箱中,培养20 h(培养基及培养温度以指示菌而定),后观察有无抑菌圈,并测定抑菌圈直径。
1.2.6 干酪乳杆菌AS02菌株发酵液乙酸乙酯相旋蒸余相中有机酸组成分析 运用HPLC对干酪乳杆菌AS02菌株发酵液乙酸乙酯相旋蒸余相的有机酸组成进行分析,进样量为300 μL,HPLC色谱分析条件为:Waters T3 C18色谱柱(4.6 mm×250 mm,5 μm);流动相:0.03 mol/L NH4H2PO4(pH2.45)∶甲醇(95∶5,v/v);进样体积:10 μL;流速:0.8 mL/min;检测波长:210 nm;柱温:30 ℃。
1.2.7 抑菌物质对食源性病原菌细胞形态的影响 取干酪乳杆菌AS02菌株发酵液乙酸乙酯相旋蒸余相200 μL添加至培养3 h且已接种1×109CFU/mLE.coliO157∶H7的LB培养基和S.aureus的BHI培养基中,30 ℃,200 r/min摇床培养15 h,采用添加200 μL生理盐水于培养3 h,且接种1×109CFU/mLE.coliO157∶H7的LB培养基和S.aureus的BHI培养基做阳性对照。4 ℃,2863×g离心10 min取沉淀,用0.75%生理盐水洗脱菌体2次,然后用固定液将菌体固定于1.5 mL离心管中,送电镜室扫描菌体表面结构和透射电镜观察病原指示菌的细胞形态与内部构造。
1.2 数据处理
本实验做3个平行,干酪乳杆菌AS02菌株生长曲线、pH动态监测,干酪乳杆菌AS02菌株发酵液的抑菌动态监测数据使用图进行表示,干酪乳杆菌AS02菌株发酵液各萃取相活性物质的抑菌活性数据使用表进行表示。本实验使用Excel软件进行作图。
2 结果与分析
2.1 干酪乳杆菌AS02菌株生长曲线、pH动态监测
干酪乳杆菌AS02菌株在发酵6 h后进入指数生长期,26 h后进入稳定生长期,培养40 h后,菌落数开始有下降趋势,但总体变化不大,保持稳定趋势。该菌株发酵液的pH在培养6 h后急剧下降,在培养26 h时,pH降至最低值3.6,随着发酵延续,pH基本保持稳定,见图1。通过检测干酪乳杆菌AS02菌株维持较高浓度以及较低pH的时间,为后续抑菌实验时间提供依据。

图1 干酪乳杆菌AS02菌株的生长与pH动态监测Fig.1 The dynamic monitoring of growth and pH of Lb. casei AS02 strain
2.2 干酪乳杆菌AS02菌株发酵液的抑菌动态监测
干酪乳杆菌AS02菌株发酵液对EscherichiacoliO157∶H7、Staphylococcusaureus和Listeriamonocytogenes具有不同的抑菌效果。该菌株在培养6 h后,能对EscherichiacoliO157∶H7发挥抑菌作用,培养28 h时,抑菌效果最强,抑菌圈直径可高达32 mm;而该菌在培养10 h后,才开始显示对Listeriamonocytogenes的抑制作用,培养42 h时抑菌效果最强,其抑菌圈直径达到20 mm;在培养14 h后开始对Staphylococcusaureus起到抑制作用,培养36 h时抑菌效果最强,抑菌圈直径达到17 mm,见图2。由此表明,干酪乳杆菌AS02菌株发酵液对EscherichiacoliO157∶H7、Staphylococcusaureus和Listeriamonocytogenes均有较好的抑菌活性。

图2 干酪乳杆菌AS02菌株发酵液的抗食源性病原菌的动态监测结果Fig.2 The inhibition ratio of fermentation of Lb. caseiAS02 strain against foodborne-pathogens
2.3 干酪乳杆菌AS02菌株发酵液各萃取相活性物质的抑菌活性
对用蛋白酶K处理的干酪乳杆菌AS02发酵液用乙酸乙酯萃取后浓缩,以E.coliO157∶H7,S.aureus和L.monocytogenes作为病原指示菌,利用spot-on-lawn改进法对浓缩后的各萃取相进行抑菌试验。表1结果表明,该干酪乳杆菌的乙酸乙酯相旋蒸余相对三种食源性病原菌均呈现很好的抑菌效果,它抑制E.coliO157∶H7和L.monocytogenes的生长最为明显,抑菌圈直径分别达到20.00、21.67 mm。水相旋蒸余相也显示出抑菌效果,表明该相中也含有相应的抑菌活性物质,这是因为乙酸乙酯属于低极性有机溶剂,不同极性的抑菌物质可能不完全溶于该溶剂中。
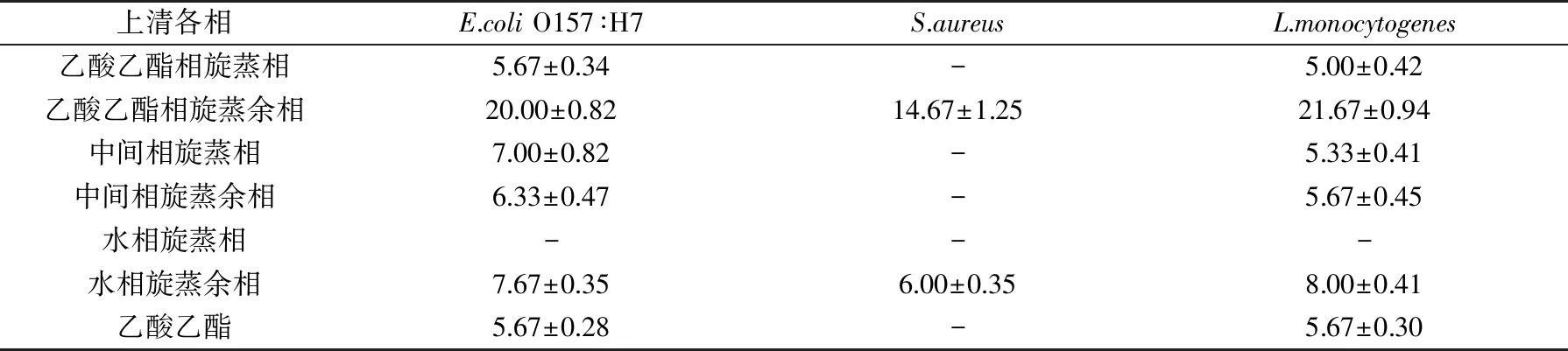
表1 干酪乳杆菌AS02萃取相对食源性病原菌的抑菌效果(mm)Table 1 The anti food-borne pathogens effect of extraction phase of Lb.casei AS02(mm)
2.4 干酪乳杆菌AS02菌株发酵液乙酸乙酯相旋蒸余相抑菌物质的组成分析
因乙酸乙酯相旋蒸余相对三种食源性病原菌均呈现很好的抑菌效果,故使用HPLC对其成分进行分析。由表2可知,乙酸乙酯相旋蒸余相中主要有机酸成分为乳酸、乙酸和苯乳酸,丙酸、苹果酸和柠檬酸的含量较少。刘冬梅等[14]利用HPLC对Lactobacillusrhamnosus所产生的抑菌物质进行分析,发现乳酸是主要的抑菌物质。张忠华等[15]建立了LactobacillusparaplantarumAY01发酵液中抑菌物质苯乳酸高效液相色谱法快速检测方法。另据报道,不同弱酸混合使用可强化抑菌作用,如乳酸和乙酸混合作用的抑菌能力大于等量的2种酸单独作用[16]。李洁等[9]利用HPLC对乳酸片球菌发酵液进行抑菌物质分析,发现主要抑菌物质为有机酸,包括乳酸、苹果酸、柠檬酸、丙酸和乙酸。

表2 干酪乳杆菌AS02菌株培养液乙酸乙酯相旋蒸余相有机酸组分含量Table 2 The content of organic acid components of ethyl acetate phase derived from Lb. casei AS02 strain
2.5 抑菌物质对食源性病原菌生长状态的影响
通过扫描电镜对E.coliO157∶H7与S.aureus菌体表面进行观察发现,实验组和对照组中病原菌菌体表面有明显的差异性,正常生长状态的病原菌菌体表面光滑、无空洞现象;经抑菌物质处理后的病原菌菌体表面有黏丝状物质出现,菌体表面有褶皱并伴随有空洞,如图3。
通过透射电镜对E.coliO157∶H7与S.aureus菌体细胞结构进行观察发现,正常生长的病原菌菌体细胞膜与细胞壁结构均匀、完整;经抑菌物质处理后的病原菌菌体细胞壁向内折叠,细胞膜与细胞壁之间空间增加,渗透能力增强,内壁浓缩并挤压细胞内溶物,致使细胞壁出现裂口,内溶物流出致死,如图3,结果表明,有机酸对病原菌的作用机理与已报到的一致[17-18]。

图3 电镜分析干酪乳杆菌AS02菌株发酵液抑菌物质处理后的食源性病原菌Fig.3 Electron microscope analysis of pathogenic bacteria which were treatmented with antibacterial substances of Lb. casei AS02 注:A1:E. coli O157∶H7对照组(扫描电镜,8000×);A2:E. coli O157∶H7实验组(扫描电镜,8000×);A3:E. coli O157∶H7对照组(透射电镜,50000×);A4:E. coli O157∶H7实验组(透射电镜,50000×);B1:S.aureus对照组(扫描电镜,250000×);B2:S.aureus实验组(扫描电镜,250000×);B3:S.aureus对照组(透射电镜,50000×);B4:S.aureus实验组(透射电镜,50000×)。
3 讨论与结论
本研究对干酪乳杆菌AS02菌株进行生长曲线和pH动态监测,在发酵6 h后进入指数生长期,26 h后进入稳定生长期,培养40 h后,菌落数开始有下降趋势。该菌株发酵液的pH在培养6 h后急剧下降,在26 h时,pH降至最低值3.6,随着发酵延续,pH基本保持稳定。该菌株在培养6 h后,能对大肠杆菌O157∶H7发挥抑菌作用,证明干酪乳杆菌AS02菌株在培养6 h后开始大量产生有机酸。徐静等[19]研究表明,筛选的2株干酪乳杆菌在开始培养时菌体密度增加迅速,大约在14 h左右达到最大,pH随着培养时间的延长而逐渐降低,24 h后pH降至4左右。Rathore等[20]研究表明,植物乳杆菌NCIMB 8826在发酵6 h后生长达到稳定期,24 h后细胞浓度开始下降,pH在前4 h迅速降低,随后降低速度减缓,24 h后,pH降至最低值3.5,达到稳定状态。
干酪乳杆菌AS02发酵液对大肠杆菌O157∶H7、金黄色葡萄球菌和单核细胞增生李斯特菌三种食源性致病菌均呈现很好的抑菌效果。而Palacios等[6]报道的Lb.casei705的代谢产物仅对L.monocytogenes具有抑菌作用。雷霞等[5]对筛选的两株干酪乳杆菌的发酵液进行抑菌实验,表明两株菌除能有效地抑制革兰氏阳性菌枯草杆菌、单核增生李斯特菌外,还可抑制革兰氏阴性的大肠杆菌K88,但不能抑制大肠杆菌O157。Corsetti等[21]报道的Lb.sanfranciscoCB1产生的代谢产物可抑制多种革兰氏阴性菌和革兰氏阳性菌。表明干酪乳杆菌AS02发酵液抑菌物质具有较广泛的抑菌效果。
在乳酸菌代谢产物抑菌物质分离纯化中,一般使用硫酸铵沉淀法[22-26]、超滤法、疏水层析、离子交换色谱、高效液相色谱和凝胶色谱法,虽然方法简单易行,但只能分离蛋白质类细菌素。本研究首次使用乙酸乙酯法萃取发酵液中的有机酸,方法简单。通过HPLC分析,主要的有机酸为乳酸、乙酸和苯乳酸,而丙酸、苹果酸和柠檬酸的含量较少。对萃取液进行抑菌实验表明,抑制E.coliO157∶H7和L.monocytogenes的生长最为明显,抑制S.aureus较为明显。近年来发现乳酸菌分泌产生一种新型生物防腐剂苯乳酸,能够抑制多种引起食物腐败的革兰氏阳性菌和革兰氏阴性菌[27]。Dieuleveux[28]发现G.candidum发酵液对L.monocytogenes具有很强的抑菌作用,经超滤、离心分离色谱、薄层色谱、凝胶过滤,确定苯乳酸是主要的抑菌物质。袁景环等[17]研究发现,苯乳酸能有效抑制革兰氏阴性菌、革兰氏阳性菌和真菌的生长,对荧光假单胞菌和金黄色葡萄球菌有杀灭作用,并具有一定的溶菌性。李洁等人[9]利用HPLC对乳酸片球菌发酵液进行抑菌物质分析,发现主要抑菌物质为有机酸,包括乳酸、苹果酸、柠檬酸、丙酸和乙酸,对大肠杆菌O157∶H7的抑制活性高于金黄色葡萄球菌YM2-3。
用萃取的有机物分别抑制E.coliO157∶H7和S.aureus,扫描电镜观察发现病原菌菌体表面有黏丝状物质出现,菌体表面有褶皱并伴随有空洞;透射电镜观察发现病原菌菌体细胞壁向内折叠,细胞膜与细胞壁之间空间增加,渗透能力增强,内壁浓缩并挤压细胞内溶物,致使细胞壁出现裂口,内溶物流出致死。袁景环等[17]研究了苯乳酸对金黄色葡萄球菌的作用机理,表明苯乳酸作用后指示菌严重变形,部分细胞壁破坏,细胞结构破坏,细胞质流出。Crist等[29]认为乳酸和乙酸可以酸化细胞质,引起质子动力受到阻碍,细胞新陈代谢迅速降低,使细菌生长缓慢甚至死亡。Roe等[18]研究发现,乙酸能导致细菌胞内蛋氨酸合成受阻,使细菌生长受阻。
本研究表明,对用蛋白酶K处理的干酪乳杆菌AS02发酵液用乙酸乙酯萃取,乙酸乙酯相旋蒸余相对大肠杆菌O157∶H7、金黄色葡萄球菌和单核细胞增生李斯特菌三种食源性致病菌均呈现很好的抑菌效果,抑制E.coliO157∶H7和L.monocytogenes的生长最为明显,分别达到20.00、21.67 mm。对乙酸乙酯相旋蒸余相使用HPLC进行分析表明,主要有机酸成分为乳酸、乙酸和苯乳酸,丙酸、苹果酸和柠檬酸的含量较少。乙酸乙酯萃取法简单高效,为研究乳酸菌抑菌物质提供了一种新手段。乳酸菌在生物防腐中起着重要作用,随着食品安全问题日益受重视,希望通过生物工程技术,将其早日应用于生物防腐领域。

