miR-138-5p 靶向缺氧诱导因子对人肾癌细胞GRC-1生长、侵袭和迁移的影响①
赵军华 周志杰 崔吉冈 倪灵凡 孟晓青
(洛阳东方医院呼吸肾病科,洛阳 471003)
肾癌是最常见的10种癌症之一,也是泌尿外科恶性肿瘤中最致命的恶性肿瘤。据统计2012年全世界新增肾癌病例33.8万,肾癌死亡病例14.3万[1]。肾癌治疗是一个全球性的医学难题。大量文献报道许多微小RNA(MicroRNA,miR)在肾癌发生发展进程中发挥着重要作用[2]。MicroRNAs是在所有真核细胞中发现的长度约为22个核苷酸的短非编码RNA,在几乎所有的生物途径中都扮演着重要的角色。MicroRNAs的异常表达常与包括癌症在内的各类疾病密切相关[3]。越来越多的数据表明MicroRNAs在癌症治疗方面具有很大的潜力[4]。深入研究MicroRNAs在癌症中的作用对人类抗癌事业具有重要意义。据报道miR-138-5p在非小细胞肺癌的耐药性、胰腺癌细胞侵袭和迁移及鼻咽癌自噬方面具有重要作用[5-7]。但miR-138-5p在肾癌中的报道还十分罕见,有待进一步研究。本文的主要目的是探究miR-138-5p对人肾癌细胞GRC-1增殖、凋亡、侵袭和迁移的影响及其分子机制。
1 材料与方法
1.1细胞系与主要试剂 人肾癌GRC-1细胞系购自美国典型培养物保藏中心 (American Type Culture Collection,ATCC)。DMEM培养基、胎牛血清和转染试剂TurboFect Transfection Regent购自赛默飞世尔科技公司。miR-138 mimic、缺氧诱导因子(Hypoxia inducing factor,HIF)-1α过表达载体pc-HIF-1α以及含HIF-1α野生型和突变型的荧光素酶报告基因质粒载体由上海Genepharm公司合成。荧光素酶检测试剂盒购自Promega公司。RNA提取试剂盒和定量PCR试剂盒SYBR Premix Ex TaqTM购自大连TaKaRa公司。miRNA定量PCR试剂盒TaqMan miRNA Assay购自Applied Biosystems公司。Transwell小室及人工基底膜购自美国BD公司。抗HIF-1α抗体购自英国Abcam公司。
1.2方法
1.2.1细胞培养 肾癌GRC-1细胞培养于添加10%胎牛血清和1%青-链霉素的DMEM培养基,置于37℃、5%CO2的恒温培养箱中培养。当细胞增殖密度到约80%时进行传代。
1.2.2细胞分组与转染 GRC-1细胞机分为5组:对照(GRC-1)组、mimic-scramble组、miR-138 mimic组、HIF-1α过表达(pc-HIF-1α)组和共转染(mimic+pc-HIF-1α)组。mimic-scramble为miR-138 mimic的阴性对照随机序列。按照转染试剂TurboFect Transfection Regent说明书将miR-138 mimic和pc-HIF-1α分别或者同时转入GRC-1细胞中。转染 48 h 后进行后续实验。
1.2.3荧光素酶分析 首先按照转染试剂TurboFect Transfection Regent说明书将HIF-1α野生型或突变型的荧光素酶报告基因质粒载体单独转入细胞中,或同时添加miR-138 mimic转入细胞,培养48 h后移去培养液。然后用洗涤液洗涤细胞,弃去洗涤液后向孔中加入1×的细胞裂解液将细胞裂解。室温下振荡器上振荡5~10 min,再移入离心管中3 000 r/min 离心5 min,取上清进行发光测定。按照试剂盒说明书和仪器操作说明对待测样品进行发光值测定。
1.2.4实时定量PCR(Quantitative real-time reverse transcription PCR,qRT-PCR) 首先用RNA提取试剂盒提取总RNA后反转录成cDNA,然后用以下引物进行qRT-PCR:miR-138-5p上游引物:5′-AGCTGGTGTTGTGAATCAGGCCG-3′,miR-138-5p下游引物:5′-CAGTGCGTGTCGTGGAGT-3′;HIF-1α上游引物:5′-TT GCTCATCAGTTGCCACTTCC-3′,HIF-1α下游引物:5′-AGCAATTCATCTGTGCT TTCATGTC-3′。按照试剂盒说明书进行检测,用公式2-ΔΔCt计算相对表达量。
1.2.5蛋白印迹 各组待测细胞经PBS清洗3次后加入含蛋白酶抑制剂的细胞裂解液提取总蛋白,100℃变性5 min。等量蛋白经SDS-PAGE凝胶电泳分离后转至PVDF膜。然后用5%的BSA封闭1 h,再加入抗HIF-1α的一抗,4℃过夜孵育。第2天加入辣根过氧化物酶标记的二抗,室温孵育1.5 h。最后加入发光液后于凝胶成像仪进行曝光拍照,并统计灰度值计算相对表达量。
1.2.6CCK-8检测细胞增殖能力 首先用培养液将CCK-8溶液稀释到10%浓度,然后用上述CCK-8稀释液将待测细胞制成1×106个/ml的细胞悬液,于37℃恒温培养箱中培养4 h,最后检测450 nm处吸光值,计算细胞增殖倍数。
1.2.7流式细胞术分析细胞凋亡 收集各组待测细胞后用PBS洗涤3次,再用1×Binding buffer将细胞制成1×106个/ml的悬液。然后加入Annexin V-fluorescein isothiocyanate (FITC),避光,轻轻地混匀,室温孵育10 min。再加入碘化丙啶(Propidium Iodide,PI),避光,室温孵育5 min。最后利用流式细胞仪对染色的细胞进行检测。
1.2.8Transwell检测细胞侵袭能力 首先用无血清的培养液将各组待测细胞制成细胞密度为1×106个/ml的悬液,并将上述细胞悬液加入铺有人工基底膜的Transwell的上室中,同时在下室中加入含20%胎牛血清的培养基。37℃培养24 h。然后用0.5%的结晶紫对上室底部细胞进行染色,并用棉签将上室内侧的细胞除去。显微镜下观察并统计细胞数量。
1.2.9划痕实验分析细胞迁移能力 将各组待测细胞制成1×106个/ml的细胞悬液,加入6孔板中。过夜培养至形成单层细胞。然后在单层细胞上用10 μl 的枪头划横线,PBS洗3次,洗去因划痕而脱落的细胞。显微镜下拍照测量划痕宽度。培养24 h后再取出拍照测量划痕宽度,计算划痕愈合率。
1.3统计学分析 用SPSS16.0软件进行统计学分析,两两比较用独立的t检验。P<0.01表示差异有统计学意义。
2 结果
2.1miR-138-5p靶向HIF-1α 通过生物信息学预测发现miR-138-5p可靶向HIF-1α。利用荧光素酶实验进一步验证miR-138-5p与HIF-1α的靶向关系。图1显示, HIF-1α野生型序列中与miR-138-5p互补的序列ACCAGC突变为UGGUCG后,HIF-1α野生型与HIF-1α突变型细胞中荧光素酶活性不存在统计学差异。在HIF-1α野生型中转染miR-138 mimic后荧光素酶活性降低(P<0.01)。但在HIF-1α突变型细胞中转染miR-138 mimic后荧光素酶活性无明显变化。上述结果表明,miR-138-5p可靶向HIF-1α。
2.2miR-138 mimic对人肾癌GRC-1细胞HIF-1α的mRNA水平的影响 向人肾癌GRC-1细胞转染miR-138 mimic后,通过qRT-PCR检测miR-138表达及HIF-1α的mRNA水平。如图2所示,miR-138 mimic组miR-138表达高于对照组(P<0.01)。miR-138 mimic组HIF-1α的mRNA水平低于对照组(P<0.01)。由此可见,miR-138 mimic可降低人肾癌GRC-1细胞HIF-1α的mRNA水平。
2.3miR-138对人肾癌GRC-1细胞HIF-1α的蛋白水平的影响 为进一步分析miR-138表达与HIF-1α表达间的关系,将miR-138 mimic和pc-HIF-1α分别或者同时转入GRC-1细胞后通过蛋白印迹检测HIF-1α的蛋白水平。由图3可知,miR-138 mimic组HIF-1α的蛋白水平低于对照组(P<0.01)。与对照组相比,pc-HIF-1α组HIF-1α的蛋白水平上升(P<0.01)。mimic+pc-HIF-1α组HIF-1α的蛋白水平低于pc-HIF-1α组(P<0.01)。以上结果说明,miR-138负向调控人肾癌GRC-1细胞HIF-1α的表达。
2.4miR-138-5p靶向HIF-1α对人肾癌GRC-1细胞增殖能力的影响 利用CCK-8检测细胞增殖能力, 分析miR-138-5p 靶向HIF- 1α对人肾癌GRC-1细胞增殖能力的影响。图4显示,miR-138 mimic组细胞增殖倍数低于对照组(P<0.01)。与对照组相比,pc-HIF-1α组细胞增殖倍数升高(P<0.01)。mimic+pc-HIF-1α组细胞增殖倍数低于pc-HIF-1α组(P<0.01)。以上结果说明,miR-138-5p靶向HIF-1α可降低人肾癌GRC-1细胞增殖能力。

图1 荧光素酶实验验证miR-138-5p与HIF-1α的靶向关系Fig.1 Luciferase reporter assay verified targeting relationship between miR-138-5p and HIF-1α
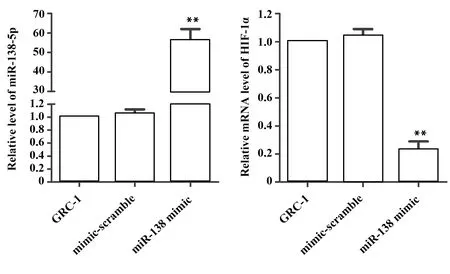
图2 qRT-PCR检测miR-138表达及HIF-1α的mRNA水平Fig.2 Expression of miR-138 and mRNA level of HIF-1α were detected by Quantitative Real-time PCR
2.5miR-138-5p靶向HIF-1α对人肾癌GRC-1细胞凋亡的影响 为分析miR-138-5p靶向HIF-1α对人肾癌GRC-1细胞凋亡的影响,通过流式细胞术检测细胞凋亡。如图5所示,miR-138 mimic组细胞凋亡率高于对照组(P<0.01)。与对照组相比,pc-HIF-1α组细胞凋亡率下降(P<0.01)。mimic+pc-HIF-1α组细胞凋亡率高于pc-HIF-1α组(P<0.01)。由此可见,miR-138-5p靶向HIF-1α可提高人肾癌GRC-1细胞凋亡能力。
2.6miR-138-5p靶向HIF-1α对人肾癌GRC-1细胞侵袭能力的影响 利用Transwell检测细胞侵袭能力,分析miR-138-5p靶向HIF-1α对人肾癌GRC-1细胞侵袭能力的影响。由图6可知,miR-138 mimic组侵袭细胞数量低于对照组(P<0.01)。与对照组相比,pc-HIF-1α组侵袭细胞数量升高(P<0.01)。mimic+pc-HIF-1α组侵袭细胞数量低于pc-HIF-1α组(P<0.01)。上述结果表明,miR-138-5p靶向HIF-1α可降低人肾癌GRC-1细胞侵袭能力。

图3 蛋白印迹检测HIF-1α的蛋白水平Fig.3 Protein levels of HIF-1α were detected by Western blot
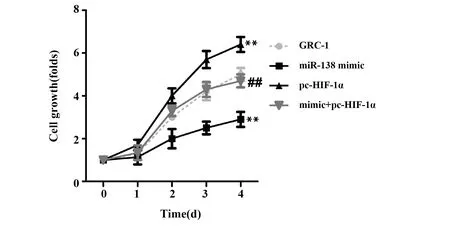
图4 CCK-8检测细胞增殖能力Fig.4 Cell proliferation was detected by CCK-8
2.7miR-138-5p靶向HIF-1α对人肾癌GRC-1细胞迁移能力的影响 通过划痕实验检测细胞迁移能力,分析miR-138-5p靶向HIF-1α对人肾癌GRC-1细胞迁移的影响。图7显示,miR-138 mimic组划痕愈合率低于对照组(P<0.01)。与对照组相比,pc-HIF-1α组划痕愈合率上升(P<0.01)。mimic+pc-HIF-1α组划痕愈合率低于pc-HIF-1α组(P<0.01)。以上结果说明,miR-138-5p靶向HIF-1α可减弱人肾癌GRC-1细胞迁移能力。
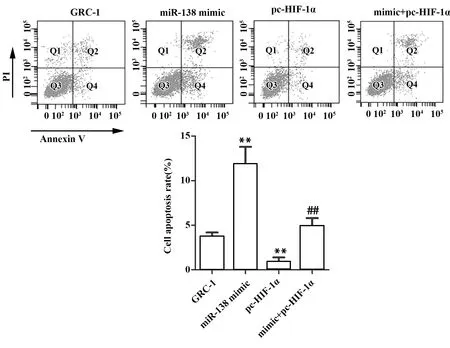
图5 流式细胞术检测细胞凋亡Fig.5 Cell apoptosis was detected by flow cytometry
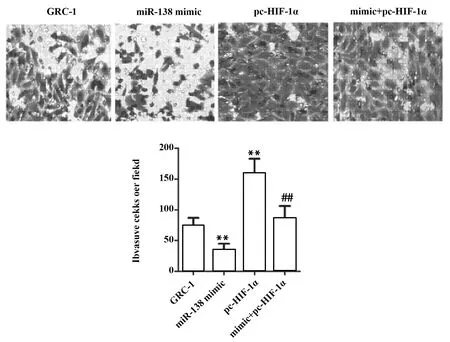
图6 Transwell检测细胞侵袭能力Fig.6 Transwell assay for cell invasion
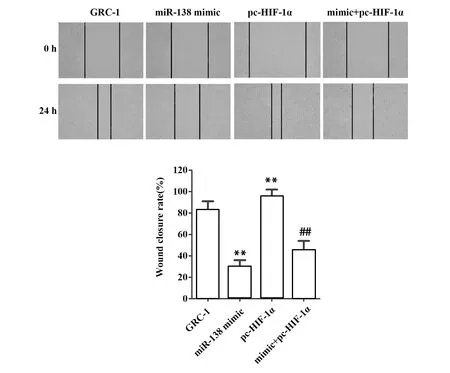
图7 划痕实验检测细胞迁移能力Fig.7 Cell migration was detected by scratch test
3 讨论
肾癌的传统治疗方法主要包括化疗、根治性肾切除术、免疫疗法等[8-10]。而在过去的15年里,随着原发性肿瘤外科治疗的进展和对肾癌分子生物学和基因组学的认识增加,肾癌治疗研究发生了很大的变化,靶向治疗在肾癌治疗中受到了广泛关注[11-13]。寻找合适的靶点对靶向治疗至关重要。越来越多的研究表明MicroRNAs在细胞增殖、凋亡、侵袭和迁移方面发挥着重要作用,具有成为靶向治疗靶点的潜能。
细胞增殖的失控是癌细胞的主要特征之一,大量文献报道MicroRNAs具有抗癌细胞增殖的功能。有数据显示miR-106a*可靶向IRS-2减弱肾癌A498 细胞增殖[14]。有研究表明miR-335可通过负向调控BCL-W表达降低肾癌786-O 和 CaKi-1细胞增殖[15]。Xu等[16]发现miR-203可通过靶向FGF2抑制肾癌786-O细胞增殖。据报道miR-138-5p可靶向FOXC1减弱胰腺癌细胞增殖[17]。另外,有研究发现miR-138-5p靶向PD-L1可抑制结肠直肠癌细胞增殖[18]。本文结果显示,miR-138-5p靶向HIF-1α可降低人肾癌GRC-1细胞增殖能力。
癌细胞常常会出现异常的细胞凋亡,越来越多的研究表明MicroRNAs在诱导癌细胞凋亡方面发挥着积极作用。据报道在肾癌ACHN和786-O细胞中miR-145可靶向ANGPT2和 NEDD9促进细胞凋亡[19]。有研究显示miR-646可靶向NOB1增加肾癌786-O细胞凋亡[20]。Ma等[21]发现miR-185可靶向VEGFA诱导肾癌ACHN和786-O细胞凋亡。有数据显示miR-138-5p可靶向SIRT1促进宫颈癌细胞凋亡[22]。据报道在视网膜母细胞瘤细胞中miR-138-5p可靶向PDK1增加细胞凋亡[23]。与前人结果类似,本研究结果显示,miR-138-5p靶向HIF-1α可提高人肾癌GRC-1细胞凋亡。
癌细胞的侵袭能力在癌症进程中至关重要,大量数据表明MicroRNAs具有调节癌细胞侵袭的功能。有研究发现miR-141可通过调控EphA2表达抑制肾癌786-O和SN12-PM6细胞侵袭[24]。有数据显示miR-34a可靶向CD44降低肾癌ACHN,786-O 和SN12PM6细胞侵袭[25]。据报道microRNA-145可靶向MMP-11减弱肾癌786-O 和A498细胞侵袭[26]。研究表明miR-138-5p靶向Survivin可降低膀胱癌细胞侵袭[27]。另外,Zhuang等[28]发现miR-138-5p还可直接靶向ΔNp63抑制口腔鳞状细胞癌细胞侵袭。本文结果显示,miR-138-5p靶向HIF-1α可减弱人肾癌GRC-1细胞侵袭能力。
细胞迁移能力的提高是癌症扩散转移的基础,越来越多的文献报道MicroRNAs在癌细胞迁移方面发挥着重要的调控作用。有研究发现miR-204可通过负向调控SOX4降低肾癌786-O和A498细胞迁移[29]。有数据显示,miR-182可靶向IGF1R减弱肾癌Caki-1细胞迁移[30]。有研究表明在胃癌细胞中miR-138-5p可靶向EGFR降低细胞迁移[31]。Xiao等[32]发现miR-138-5p可靶向YAP1抑制非小细胞肺癌细胞迁移。据报道在骨肉瘤细胞中miR-138-5p还可通过靶向EZH2减弱细胞迁移[33]。本文结果显示,miR-138-5p靶向HIF-1α可降低人肾癌GRC-1细胞迁移能力。
本研究表明,在人肾癌GRC-1细胞中,miR-138-5p可靶向HIF-1α;miR-138负向调控HIF-1α的表达;miR-138-5p靶向HIF-1α可减弱细胞增殖、侵袭和迁移能力;并促进细胞凋亡。下一步计划在肾癌动物模型中研究miR-138-5p对肾癌发生发展的影响,为开发有效的肾癌治疗方法奠定基础。

