脑胶质瘤中心体的异常扩增及其与疾病分期的相关性
陆玉成,王丽娟,车峰远,于继徐,姜良军,张礼忠,李少钦
1.山西大学 生命科学学院,山西 太原 030000;2.临沂市人民院 中心实验室,山东 临沂 276000;3.临沂市人民医院 神经内科,山东 临沂 276000;4.临沂市人民医院 病理科,山东 临沂276000;5.江苏师范大学 生命科学学院,江苏 徐州 221000
中心体是由2 个中心粒及其周围物质组成的非膜细胞器,存在于哺乳动物和低等植物细胞中。它是细胞的微管组织中心,对于细胞分裂和维持基因组稳定性非常重要[1]。在正常细胞中,中心体负责产生两极有丝分裂纺锤体,促进染色体分离成2 个相同的子细胞,在每个子细胞中均包含1 个中心体。中心体异常扩增,是在一个细胞中出现超过2 个中心体的情况。现已发现中心体异常扩增存在于各种类型的癌症中,包括各种实体肿瘤和白血病[2]。
胶质瘤是人脑中枢神经系统中最常见的恶性肿瘤之一,由于其与脑组织边界不清晰,且常常呈浸润性生长,所以手术不易将其完全切除,并且术后常出现高复发率和高致残率。虽然现在对胶质瘤采用手术切除和术后放、化疗等综合治疗,但总体治疗效果不好[3]。先前研究报道[4],中心体扩增与多种肿瘤的发生发展相关,但目前还没有关于胶质瘤方面的报道。
我们收集正常脑组织和各级别脑胶质瘤共50 例,用HE 染色和免疫组化检测Ki67 阳性表达来确定脑胶质瘤的分级,并采用免疫组化和免疫荧光方法检测中心体扩增与胶质瘤分期的相关性,旨在探讨中心体扩增在胶质瘤中的表达及其临床意义。
1 资料与方法
1.1 组织标本
收集临沂市人民医院2017年1~12月的脑胶质瘤组织标本40 例(实验组),收集重症脑外伤手术患者的正常脑组织标本10 例(对照组),依据2016年世界卫生组织的中枢神经系统肿瘤分类标准,包括Ⅰ/Ⅱ级 20 例、Ⅲ级 10 例、Ⅳ级 10 例。本研究通过了临沂市人民医院伦理委员会批准,并且所选患者均签署知情同意书。
1.2 材料
光学显微镜购自Olympus 公司;γ-微管蛋白抗体和Ki-67 抗体购自Cell Signaling Technology公司;光谱型SP 试剂盒、DAB 显色剂购自福州迈新生物技术有限公司。
1.3 苏木精-伊红(HE)染色
取材置于4%多聚甲醛溶液中,过夜固定;次日进行乙醇由低到高梯度脱水和二甲苯透明,浸蜡,石蜡包埋;包埋后切片,置于载玻片上,再用二甲苯进行脱蜡处理,接着再进行乙醇由高到低梯度至水洗,再行苏木精染色,水洗1~2 min,盐酸乙醇分化,水洗1~2 min,0.5%氨水水洗反蓝,水洗1~2 min,伊红染色,90%乙醇1 min,无水乙醇2 次,每次2 min,封片保存,并在光学显微镜下观察脑组织的病理变化。
1.4 免疫组化
组织标本经4%甲醛溶液固定,常规石蜡包埋,5 μm 连续切片,二甲苯脱蜡,经枸橼酸钠缓冲液(pH6.0)抗原修复处理,3% H2O2阻断内源性过氧化物酶,用10%小牛血清封闭,然后加入γ-微管蛋白和Ki67 抗体,PBS 冲洗,加入二抗及SP/HRP,DAB 显色,苏木素复染,中性树胶封片。
1.5 免疫荧光
连续切片2 μm,将切片贴附于经多聚赖氨酸处理的载玻片上,60℃烤片30 min,二甲苯脱蜡,乙醇复水,经枸橼酸钠缓冲液(0.1 mol/L,pH6.0)抗原修复处理,滴加小牛血清封闭处理,滴加γ-微管蛋白抗体,用于显示中心体,于4℃冰箱中过夜,滴加二抗(室温下避光湿盒孵育1 h),加入DAPI 进行细胞核染色,用抗荧光淬灭剂封片。从制备的标本中随机抽取2~4 张切片,以一抗不加γ-微管蛋白的同步染色作为阴性对照。
1.6 结果判定
1.6.1 免疫组化结果评价 随机抽取制备的切片,在双盲情况下由2 名病理科同事观察评价结果并采集病理图像。γ-微管蛋白染色阳性定位为细胞质内呈均匀着色的棕黄色,其中细胞核处会着色深;Ki67 染色阳性定位为细胞核着色为棕黄色。计数阳性细胞百分率和阳性细胞数。
1.6.2 中心体观察与计数 具有以下特征之一可判定为中心体异常扩增:①在一个细胞中观察到3 个或3 个以上中心体;②中心体直径大于同一张切片中心体直径的2 倍或以上;③形状异常中心体,包括长形中心体、线状中心体、成块状中心体及成簇堆积中心体。
在荧光显微镜10×100 倍数下,每张切片选取肿瘤区10 个视野,首先计数视野内肿瘤细胞数,接着计数具有异常中心体的细胞数,计算每个样本异常中心体细胞占所计数的肿瘤细胞数的百分率,即中心体异常扩增率。
1.7 统计学分析
采用SPSS 21.0 统计学软件分析,计量材料采用x±s,2组间比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 HE染色检测组织标本的病理变化
正常脑组织层次分明,细胞密度均匀,细胞核规则,无异型性细胞;Ⅰ/Ⅱ级胶质瘤细胞密度增加,异型性较明显,核深染但较规则,可出现少数多核或瘤巨细胞;Ⅲ级细胞大小形态不一致,细胞排列紊乱,核异型性更加明显;Ⅳ级细胞大小形态极不一致,出现多核瘤巨细胞,核膜不清晰,可多至数个核,出现大面积坏死灶(图1)。
2.2 Ki67在胶质瘤中的表达及其相关性
Ki67 在正常脑组织中没有阳性表达;在Ⅰ/Ⅱ级胶质瘤中,13 例阳性表达,7 例阴性表达,阳性表达率为65%;Ⅲ级中8 例阳性表达,2 例阴性表达,阳性表达率为80%;Ⅳ级中10 例全部阳性表达,阳性表达率为100%(图2)。分析表明Ki67 在不同脑组织中的表达强度具有统计学差异(χ2=24.753,P<0.01)(表1)。与正常脑组织相比,Ⅰ/Ⅱ、Ⅲ和Ⅳ级胶质瘤组织的Ki67 阳性表达率均较高,差异具有统计学意义(均P<0.001)。
2.3 免疫组化检测γ-微管蛋白的表达
γ-微管蛋白是微管蛋白家族成员,具有控制有丝分裂纺锤体复制的功能,是中心体复制的重要蛋白[5]。当前在中心体的研究中,都是通过检测γ-微管蛋白来评估中心体的表达情况。免疫组化结果显示,在正常组织中,仅有3 例细胞质中出现浅黄色,其余均为阴性表达;Ⅰ/Ⅱ级胶质瘤中,有10 例出现细胞质黄色,并且有的细胞核附近出现阳性表达;Ⅲ级中有8 例出现阳性表达,并且细胞核及其周围出现棕黄色;Ⅳ级中全部10 例出现细胞核与周围胞质棕褐色表达,并且表达情况明显强于其他级别与正常脑组织(图3)。对γ-微管蛋白表达情况做了统计学分析,具有统计学意义(表2)。

图1 正常脑组织和胶质瘤组织HE染色结果(×200)

图2 正常脑组织和胶质瘤组织中Ki67的表达(×200)
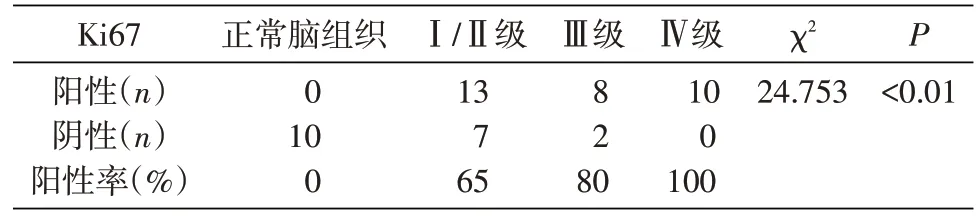
表1 Ki67在正常脑组织和各胶质瘤级别中的表达
2.4 免疫荧光检测中心体的表达
结果见图4。细胞核呈蓝色,γ-微管蛋白在细胞中呈红色,显示此处为中心体。中心体异常扩增表现在中心体数目增加(多于2 个)、中心体体积增大、中心体形状异常。正常对照组中未发现中心体异常,Ⅰ/Ⅱ、Ⅲ、Ⅳ级胶质瘤中分别有2.25%±1.15%、5.04%±2.12%和5.25%±2.23%的中心体异常扩增。
3 讨论
胶质瘤是原发性的颅内神经恶性肿瘤。2016年,世界卫生组织将其分为4 个级别,其中Ⅰ/Ⅱ级为低级别胶质瘤,Ⅲ/Ⅳ级为高级别胶质瘤。级别越低越容易治疗,且预后相对较好,生存时间相对较长,而高级别胶质瘤难治疗,预后较差,生存时间也相对较短。当前胶质瘤的诊断主要依据患者的临床表现(如头痛头晕、恶心呕吐和视觉障碍等),再加以辅助检查(如颅脑CT 平扫、颅脑核磁共振平扫和PET 等)。对胶质瘤级别的判断还须进行病理学分析。我们的结果显示,与正常脑细胞相比,Ⅰ/Ⅱ级胶质瘤细胞密度增加,异型性较明显,胞核深染但较规则,出现少数多核或瘤巨细胞;Ⅲ级细胞大小形态不一致,细胞排列紊乱,核异型性更加明显;Ⅳ级细胞大小形态极不一致,出现多核瘤巨细胞,核膜不清晰,可多至数个核,出现大面积坏死灶。
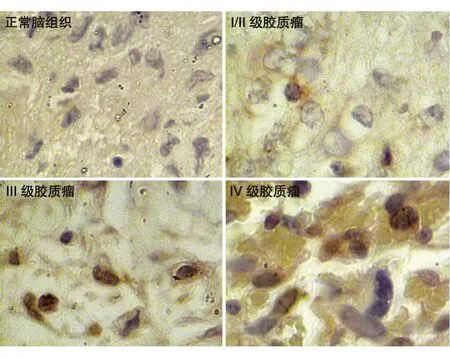
图3 正常脑组织和胶质瘤组织中γ-微管蛋白的表达(×1000)

表2 γ-微管蛋白在正常脑组织和各胶质瘤级别中的表达
Ki67 是一种细胞核抗原,它的表达情况常常与肿瘤的形成、浸润和转移等恶性程度相关,所以Ki67 通常作为肿瘤细胞增殖状态的一个重要指标。最近有文献[6]报道,Ki67 在许多恶性肿瘤中表达程度的升高造成了差的临床疗效及预后。我们的实验表明,正常脑组织中没有发现Ki67的表达,Ⅰ/Ⅱ级胶质瘤中Ki67 阳性表达率为65%,Ⅲ级胶质瘤中Ki67 阳性表达率为80%,Ⅳ级胶质瘤中Ki67 阳性表达率为100%。从以上结果可以观察到,Ki67 阳性表达率与胶质瘤级别的升高呈正相关。Smith 等[7]也发现正常脑组织中Ki67没有阳性表达;Wanyne[8]和 Okumura 等[9]也报道了Ki67 在不同病理级别的脑胶质瘤中均阳性表达,并且随着肿瘤级别升高,表达率和表达强度均升高。这和本研究结果相一致。
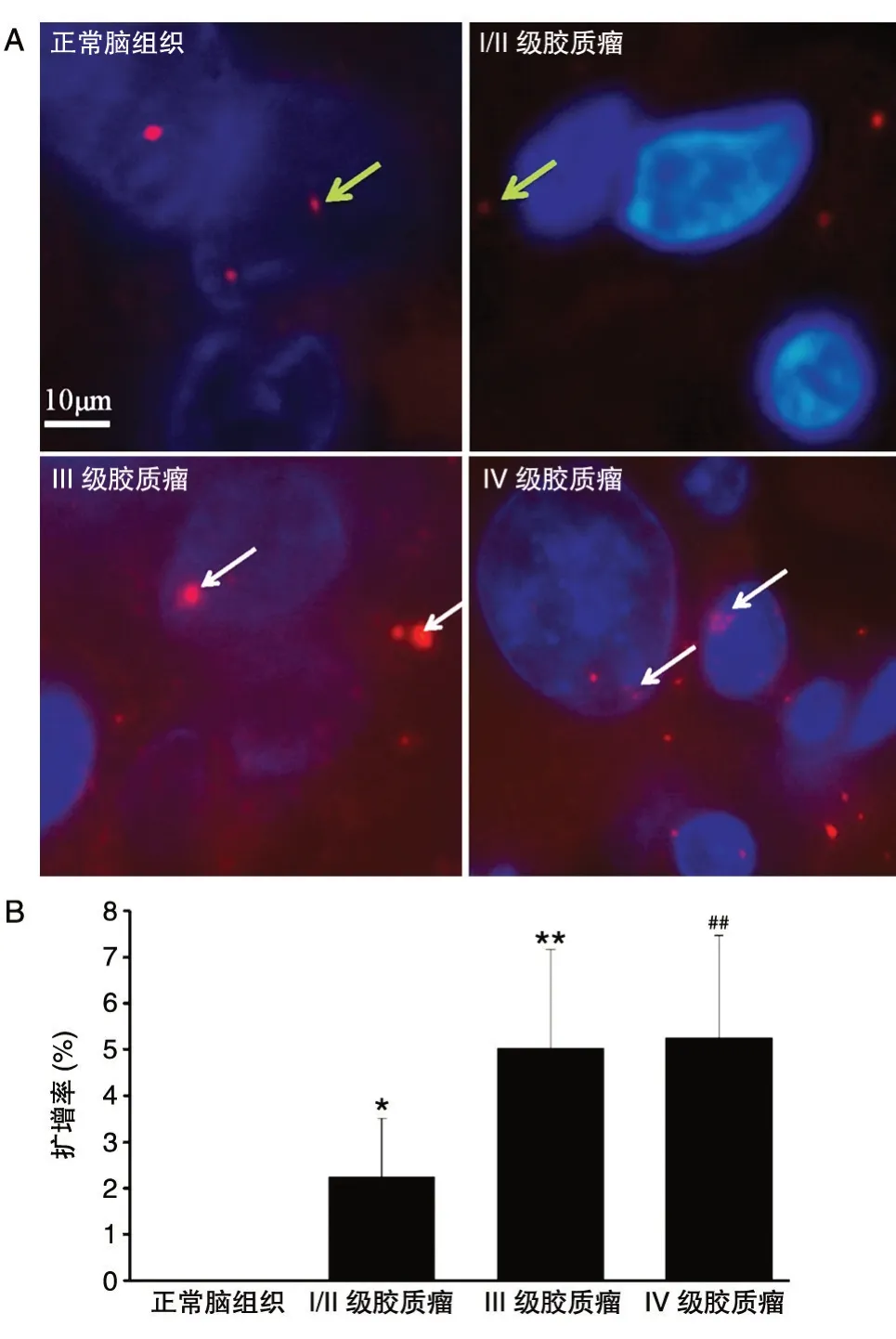
图4 免疫荧光检测中心体扩增(×1000)
中心体是动物细胞中主要的微管组织中心,参与维持细胞极性、染色体的正确分离。γ-微管蛋白作为中心体微管蛋白家族成员之一,控制着有丝分裂纺锤体的复制[5],是有丝分裂中心体复制中的关键蛋白,实验中通常以检测γ-微管蛋白的表达来反映中心体状态。中心体扩增是指1 个细胞中包含2 个以上的中心体。众所周知,中心体扩增可以引起染色体不稳定,从而引起基因组的不稳定,造成肿瘤发生,可以增加肿瘤的侵袭性并使患者的预后变差[10-11]。鉴于此,中心体扩增在临床检测中的应用越来越多。Pihan 等[12]报道,在子宫颈癌、膀胱癌和乳腺癌中,中心体扩增均发生在癌症早期阶段。Mahathre 等[13]报道,在结直肠癌中,中心体扩增可以作为一个生物标志物,并可作为个性化治疗的靶点。Yamamoto 等[14]报道,中心体扩增可以作为尿路上皮癌分类与预后评估的生物标志物。我们的结果显示,在正常脑组织中未发生中心体扩增,但在不同级别的胶质瘤样本中都检测到了中心体扩增,并且从低级别到高级别的进展中,中心体在细胞中的扩增率是逐渐升高的,表明在胶质瘤中中心体扩增也可以作为肿瘤发展和临床病理分级的标志物。
总之,中心体异常扩增随着胶质瘤的级别升高呈逐渐递增趋势,说明中心体扩增是胶质瘤发展过程中不可缺少的重要环节。当然,我们的发现还须大量样本进一步检验。相信未来对中心体扩增的研究将有利于改善胶质瘤患者的预后。
——水芹主要害虫识别与为害症状

