不同时间氧糖剥夺再灌注对SH-SY5Y细胞线粒体自噬及功能的影响*
刘雨霞, 郑 菊, 张文萍, 李 毅, 吴昌学, 齐晓岚, 官志忠, 肖 雁*
(1.贵州医科大学 地方病与少数民族疾病教育部重点实验室, 贵州 贵阳 550004; 2.贵州医科大学 贵州省医学分子生物学重点实验室, 贵州 贵阳 550004)
血管性痴呆(VaD)被广泛认为是除阿尔茨海默病外的第二种痴呆类型,其临床表现主要为神经认知障碍,包括行为症状和运动异常[1]。缺血再灌注所致神经元损伤是引起VaD的主要原因,其机制主要包括炎症反应及氧化应激。线粒体作为细胞呼吸和能量产生的中心细胞器,也是缺血再灌注损伤的靶细胞器[2],众多研究表明当缺血再灌注发生时,神经元细胞内线粒体功能受到损伤[3-4],因此及时消除受损或功能失调的线粒体被认为是在氧糖剥夺再灌注(oxygen and glucose deprivation,OGD/R)中保护细胞免受缺血应激的必要条件[5]。线粒体自噬是由自噬选择性清除线粒体的过程,线粒体自噬可以识别并去除异常线粒体,维持线粒体的内稳态,线粒体蛋白中Beclin1、P62的表达水平能很好地反应胞内线粒体自噬的活性[6]。本研究对人神经母细胞瘤(SH-SY5Y)细胞体外构建不同时间的OGD/R模型,观察OGD/R后SH-SY5Y细胞线粒体膜电位及活性氧 (reactive oxygen species, ROS)含量、线粒体蛋白Beclin1及P62表达变化,探讨不同时间OGD/R对SH-SY5Y细胞线粒体自噬及功能的影响。
1 材料与方法
1.1 细胞、试剂及仪器
1.1.1细胞及试剂 SH-SY5Y细胞购自美国典型菌种保藏库(american type culture collection,ATCC,货号ATCC ® CRL-2266TM)。试剂DMEM/F12(1∶1)完全培养基、无糖DMEM、澳洲胎牛血清、0.25%胰酶消化液(购自美国Gibco公司),Beclin1抗体购自美国Abcam公司,SQSTM1/P62抗体购自美国CST公司,COXⅣ抗体购自美国CST公司,HRP标记的抗兔二抗购自美国CST公司,BCA蛋白定量试剂、ECL-Plus发光液购自美国Thermo Fisher Scientific公司,ROS检测试剂盒购自北京贝博公司,JC-1流式试剂盒购自美国BD公司,细胞线粒体提取分离试剂盒购自碧云天生物试剂公司,PVDF膜购自美国Millipore公司。
1.1.2仪器 ELX800UV酶标仪(美国 Bio-Tec公司),Western blot跑胶装置电源(北京百晶科技公司),Varioskan LUX多通道酶标仪(美国Thermo Fisher Scientific公司),GeneGnome XRQ 化学发光成像仪(英国SYNGENE公司),FACS Verse 流式细胞仪(美国BD公司)。
1.2 方法
1.2.1SH-SY5Y细胞培养及分组 将完全培养基、血清及双抗按89∶10∶1的比例制成工作培养基,取冻存SH-SY5Y细胞悬液1 mL、工作培养基10 mL加入透气盖培养瓶中,置于37 ℃,5% CO2培养箱中正常培养,次日换液。培养3~5 d时进行传代,待第二代细胞均匀铺满瓶底的80%时,取1.5×106/孔细胞于6孔板中;待第三代SH-SY5Y细胞处于对数生长期时对细胞进行OGD/R。根据剥夺及再灌注的时间不同,将细胞分为5组:control组(不作OGD/R)、3 h/12 h组(氧糖剥夺3 h后再灌注12 h)、3 h/24 h组(氧糖剥夺3 h后再灌注24 h)、6 h/12 h组(氧糖剥夺6 h后再灌注12 h)、6 h/24 h组(氧糖剥夺6 h后再灌注24 h)。
1.2.2SH-SY5Y细胞OGD/R模型的制备 每99 mL无糖DMEM中加入1 mL双抗,制成1%双抗的无糖培养基。取处于对数生长期SH-SY5Y细胞进行氧糖剥夺:弃去板内工作培养基,1×PBS洗3次(1 min/次),每孔加入无糖培养基2 mL,将六孔板置于37 ℃、5%CO2、94%N2、1%O2的三气培养箱中进行氧糖剥夺(对照组与3 h/24 h组共同换液,每次换液后用1×PBS洗后每孔加入工作培养基2 mL,置于37 ℃、5%CO2培养箱中培养),剥夺相应时间(3 h或6 h)后弃去无糖培养基,1×PBS洗3次(1 min/次),换工作培养基2 mL,置于37 ℃,5%CO2培养箱中正常培养进行再灌注,时间分别为12 h或24 h。
1.2.3细胞线粒体膜电位检测 采用流式细胞术,每只JC-1冻干粉加入DMSO溶解125 μL成JC-1储存液,JC-1储存液与1×Assay Buffer按99∶1的比例配置JC-1工作液;阳性对照用CCCP稀释1 000倍处理细胞20 min。OGD/R后用0.25%不含EDTA的胰酶消化、收集细胞,每孔取1×106个细胞,1×PBS洗1次,用JC-1工作液0.5 mL悬浮细胞,放入37 ℃、5%培养箱中孵育15 min,孵育完毕后加入1×Assay Buffer 2 mL洗涤,1 500 r/min离心5 min,1×Assay Buffer洗涤2次后去除多余探针,将细胞沉淀重悬于0.5 mL的 1×Assay Buffer中,吹打重悬细胞,用40 μm过滤网筛除去细胞团块及JC-1颗粒物质,上机检测。
1.2.4细胞ROS含量测定 采用流式细胞术,用完全培养基按1∶1 000比例稀释DCFH-DA探针, OGD/R后的细胞用不含EDTA胰酶消化、离心收集细胞,1×PBS洗涤细胞,阴性对照(blank)直接用0.5 mL完全培养基重悬细胞,其余组将细胞沉淀重悬于1 mL稀释的DCFH-DA探针中,放入37 ℃、5%培养箱中孵育20 min(为使探针与细胞更好接触,每4 min颠倒混匀1次);用1 mL完全培养基洗3次(分别1 500 r/min离心5 min),充分去除未进入细胞的探针。最终用完全培养基0.5 mL吹打重悬细胞,用40 μm过滤网筛除去细胞团块及JC-1颗粒物质,即刻上机检测,平均荧光强度表示ROS含量。
1.2.5SH-SY5Y细胞线粒体中Beclin1、P62蛋白表达 采用Western blot方法,OGD/R后的细胞用0.25%胰酶消化,离心收集细胞,冰浴1×PBS洗1次,2 000 r/min,4 ℃离心5 min,每管细胞加入500 μL分离试剂(每1mL线粒体分离试剂临用前加入PMSF 10 μL),冰浴15 min后玻璃匀浆器匀浆30次,2 700 r/min,4 ℃离心10 min,取上清9 000 r/min,4 ℃离心10 min,弃上清,每管沉淀加入线粒体裂解液100 μL(100 μL线粒体裂解液临用前加入PMSF 1 μL),冰上放置20 min(每5 min旋涡混匀1次),12 000 r/min,4 ℃离心10 min,收集上清即为线粒体蛋白。BCA蛋白定量法测定蛋白浓度,每孔取20 μg线粒体蛋白(20 μL)上样于12%的SDS-PAGE凝胶后进行电泳分离,于Gene Gnome XRQ中曝光。COXⅣ作为内参。
1.3 统计学方法

2 结果
2.1 OGD/R后线粒体膜电位
细胞OGD/R相应时间后,用JC-1染料标记,流式细胞术评估SH-SY5Y细胞线粒体膜电位(MMP,Δψm)变化。如图1所示,JC-1在正常线粒体内形成聚集体,在Q2象限中显示红色荧光;当线粒体发生去极化时,JC-1以单体形式存在,表现为Q3象限的绿色荧光。OGD / R后,Q3象限中细胞的比例增加, JC-1分裂成绿色荧光单体,表现为低膜电位(绿色荧光)的细胞百分比增加(可反映线粒体膜电位的去极化程度);半定量分析结果显示,与control组比较,SH-SY5Y细胞OGD/R后线粒体膜电位均发生去极化(P<0.01),且3 h/24 h组的线粒体膜电位去极化程度最高。
2.2 OGD/R后细胞内ROS含量
利用DCFH-DA探针标记处理相应时间的SH-SY5Y细胞,流式细胞术检测细胞内ROS含量。如图2 所示,在胞内DCFH-DA被活性氧氧化生成荧光物质DCF,OGD/R后SH-SY5Y细胞荧光增多,表示OGD/R后细胞内ROS含量增高,用ROS荧光强度表示胞内ROS相对含量;半定量结果显示,与与control组比较,细胞OGD/R后胞内ROS含量增高(P<0.01),且再灌注24 h组ROS含量较剥夺相同时间再灌注12 h组高(P<0.01),且6 h/24 h组ROS含量最高(P<0.01)。
2.3 SH-SY5Y细胞线粒体中Beclin1及P62蛋白表达
用线粒体蛋白COX Ⅳ做内参,Western bolt检测各组细胞线粒体中Beclin1及P62蛋白表达,以对照组细胞线粒体中Beclin1及P62蛋白表达量为对照,观察各OGD/R组细胞线粒体蛋白的相对表达量。如图3所示:与control组比较, 3 h/24 h组、6 h/12 h组及6 h/24 h组线粒体中Beclin1蛋白表达显著升高(P<0.01),且3 h/24 h组较3 h/12 h组更高(P<0.01);各组P62蛋白表达比较,3 h/12 h组、3 h/24 h组P62蛋白表达与对照组比较显著升高,差异有统计学意义(P<0.01)。
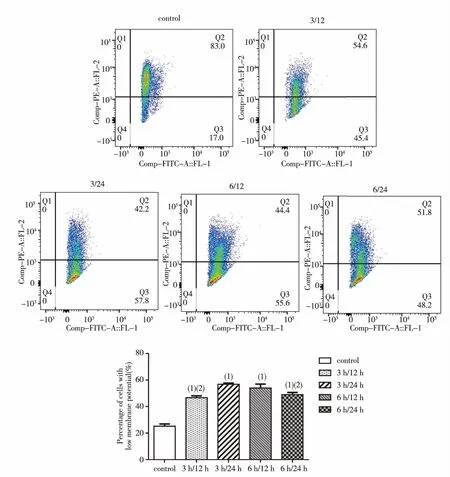
(1)与control组比较P<0.01;(2)与3 h/24 h组比较P<0.01图1 OGD/R后SH-SY5Y细胞线粒体膜电位的变化情况Fig.1 Changes of mitochondrial membrane potential in SH-SY5Y cells after OGD/R

(1)与control组比较,P<0.01;(2)与3 h/24 h组比较,P<0.01;(3)与6 h/24 h组比较,P<0.01图2 OGD/R后SH-SY5Y细胞内ROS的变化情况Fig.2 Changes of ROS in SH-SY5Y cells after OGD/R
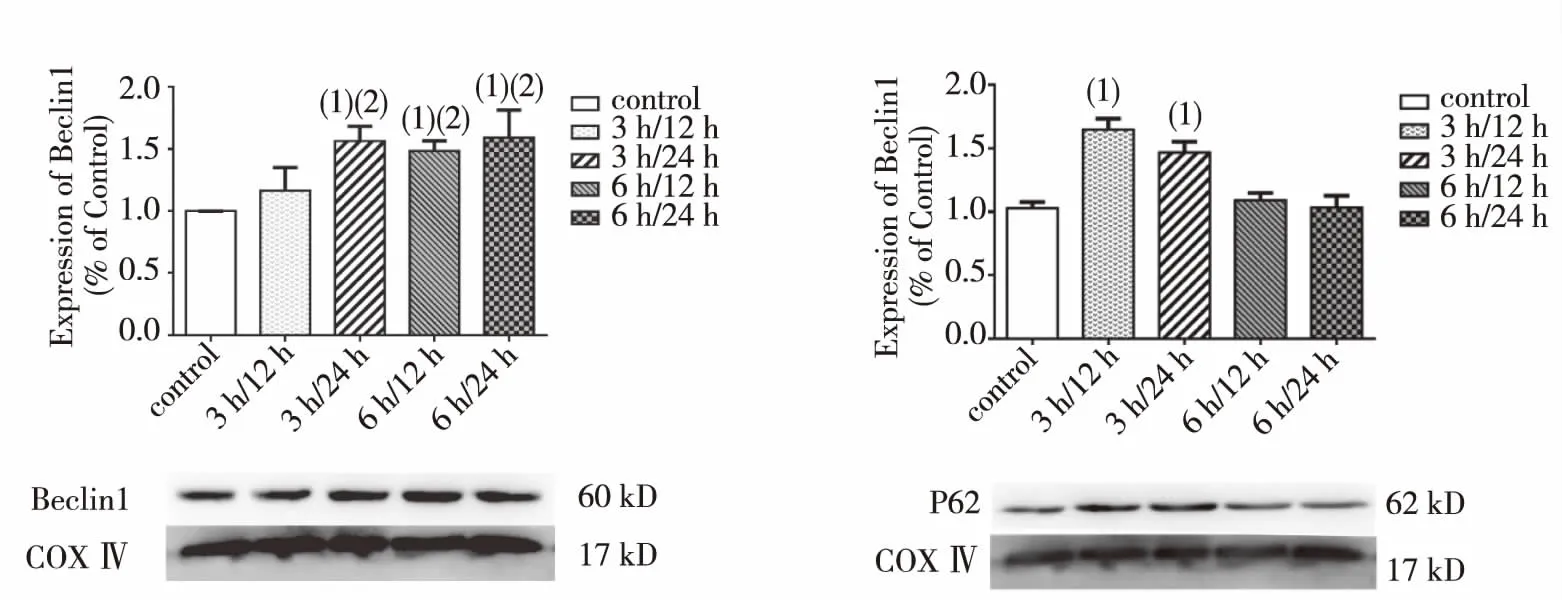
(1)与control组比较,P<0.01; (2)与3 h/12 h组比较,P<0.01图3 各组SH-SY5Y细胞线粒体中Beclin1及P62蛋白表达(Western bolt)Fig.3 Expression of Beclin1 and P62 in mitochondria of SH-SY5Y cells in each group
3 讨论
VaD作为最常见的老年期痴呆之一,患病人数占所有老年痴呆人数的15%,其发病率随中国人口老龄化而逐年升高[7]。脑卒中后缺血缺氧是VaD的常见诱因之一,缺氧导致氧化应激和引发炎症反应,氧化应激使血管内皮细胞,胶质细胞和神经元细胞受损,这些病理变化发生在大脑并导致VaD,其中神经元细胞的损伤是最主要诱因之一[8]。对SH-SY5Y细胞系进行OGD/R作为缺血性神经元损伤快速且灵敏的体外模型已被广泛用作潜在神经保护剂开发[9-10]。
线粒体是一种重要的细胞器,在活细胞中主要负责能量代谢和ROS生成。在脑卒中后的慢性低灌注可引发神经系统中神经元细胞内线粒体发生功能障碍[11]。缺血再灌注可以阻断ROS产生与细胞抗氧化酶的解毒和清除能力之间的稳态,这将引起脑组织内线粒体氧化应激激活并进一步加重缺血引起的组织损伤[12-13]。同时线粒体膜通透性转换孔(MPTP)上的硫醇被氧自由基氧化而诱导开放从而导致线粒体膜电位发生去极化[14]。有研究发现在2-VO大鼠中,观察到线粒体呼吸链复合酶活性降低,线粒体膜电位发生去极化,同时ROS含量升高[15],本研究通过对SH-SY5Y细胞系进行OGD/R体外模拟脑卒中患者脑缺血再灌注。通过不同时间的OGD/R探索缺血不同时间段下线粒体功能改变及线粒体自噬程度。从实验结果可以看出OGD/R后SH-SY5Y细胞线粒体膜电位发生去极化,且胞内ROS含量增加,提示SH-SY5Y细胞OGD/R后细胞内线粒体功能受损。与YU等[16]的研究结果,缺血再灌注与神经元细胞线粒体受损有关,并能引起神经元线粒体自噬一致。
OGD/R后,需要有效的清除机制及时清除受损线粒体以保证细胞状态,特别是神经元这类细胞线粒体受损可导致细胞死亡的的高活力低再生能力的细胞更为重要[17-18]。自噬是介导功能障碍线粒体去除的关键细胞机制之一,是一种囊泡介导的用于受损物质的识别、隔离并将其运送至溶酶体进行降解并释放营养物质的胞内分解代谢途径。自噬对受损线粒体的选择性清除被称为线粒体自噬,其可以识别并去除异常线粒体维持线粒体内稳态[5]。但目前仍没有统一的系统理论来解释线粒体自噬在脑缺血中的作用,但可能与脑缺血时间及线粒体自噬程度有关。Beclin1是自噬标志性蛋白,在评估自噬发生程度方面有重要作用[19],P62又称为SQSTM1,是一种泛素结合蛋白,介导线粒体与自噬相关蛋白的结合,从而被选择性的转移到自噬机器中进行降解,常用来监测自噬的发生、蛋白底物的清除,以及自噬的抑制等过程[20]。线粒体蛋白中Beclin1、P62的表达量能很好地反应胞内线粒体自噬的活性,在本研究发现OGD/R后SH-SY5Y线粒体蛋白中Beclin1表达量升高,3 h/12 h组及3 h/24 h组P62表达量升高,说明OGD/R后SH-SY5Y细胞线粒体自噬被激活,发生线粒体自噬,且3 h/24 h组Beclin1表达量明显高于3 h/12 h组,说明在某一时间限度内,神经元线粒体自噬活性随着氧糖剥夺时间及再灌注时间的增加而升高。
综上所述,当SH-SY5Y细胞发生OGD/R时,线粒体功能受到损伤,当OGD/R时间超过3 h/24 h时神经细胞发生线粒体自噬,且在某一时间限度内,神经元线粒体自噬活性随着氧糖剥夺时间及再灌注时间增加而升高。

