尼群地平片人体生物等效性预研究
鲁婷婷,崔佳丽,梅 晶,赵高琼,李窦红,刘红斌 ,王京昆
(1.大理大学,云南 大理 671000;2.云南省药物研究所,云南 昆明 650111;3.云南白药集团创新研发中心,云南 昆明 650111;4.云南省中药和民族药新药创制企业重点实验室,云南 昆明 650111)
尼群地平为德国拜耳公司 (Bayer Vital GmbH)研发的二氢吡啶类钙离子拮抗剂,由于起效迅速、疗效确切、副作用小等特点,被广泛应用于治疗各类型高血压及冠心病[1]。截止2012年,我国已有191家企业仿制生产尼群地平片[2]。为促使企业全面提高仿制药质量,国家食品药品监督管理总局《关于开展仿制药质量一致性评价工作的通知》中提出:“对2007年修订的《药品注册管理办法》施行前批准基本药物和临床常用仿制药,分期分批进行质量一致性评价”[3]。而生物等效性 (bioequivalence,BE)评价是仿制药质量与疗效一致性评价的重点内容之一[4-5]。只有仿制药与原研药具有生物等效性,临床上才可以仿制药替代原研药[6]。本研究进行空腹状态和餐后状态下尼群地平受试制剂与参比制剂生物等效性预研究,以期获得尼群地平生物等效性评价结果,为尼群地平片生物等效性正式试验的设计提供参考和指导。
1 仪器和试药
1.1 仪器
Agilent 1200SL HPLC(美国安捷伦科技有限公司)、API3200 Q-Trap质谱仪(美国AB公司)、Allegra 64R台式高速冷冻离心机(美国Beckman公司)、DV215CD电子天平 (上海OHAUS公司)。
1.1 药品与试剂
受试制剂:尼群地平片(云南白药集团股份有限公司,批号ASPL201702,规格10 mg);参比制剂:尼群地平片(Bayer Vital GmbH,批号BJ33777,规格10 mg)。尼群地平对照品(中国食品药品检定研究院,含量为99.4%,批号:100585-201705);内标:氘代尼群地平(TORONTO RESEARCH CHEMICALS INC,批号:15-BHW-78-4);甲酸、乙腈为色谱纯,水为超纯水。
2 试验方法
2.1 血浆样品分析方法的建立
2.1.1 血浆样品处理方法
精密量取100 μL血浆,置1.5 mL棕色离心管中,加入200 μL的内标沉淀剂,涡旋3 min,于15000 r·min-1,4℃离心10 min后,取上清液进行分析检测。
2.1.2 色谱条件与质谱条件
色谱条件:色谱柱为 XBridge○RBEH C18柱(4.6mm×75mm,2.5μm);流动相为0.1%甲酸水-乙腈,洗脱梯度为0.0~2.0 min,乙腈10%;2.0~7.5 min,乙腈90%;7.5~12 min,乙腈10%;柱温为20℃;流速为350 μL·min-1;进样量为10 μL。
质谱条件:电喷雾离子源 (ESI),多反应监测 (MRM)方式进行负离子检测,对质谱参数进行优化,优化后的质谱参数,喷雾电压 (IS):-4500 V,雾化温度 (TEM):600℃,气帘气(CUR):30 psi,雾化气 (GS1):85 psi,辅助气(GS2):60 psi,碰撞气 (CAD):Low;尼群地平[M-H]-母离子m/z:359.10,定量/定性碎片离子m/z:122.00/236.00;解簇电压(DP):-40V/-50 V,射入电压(EP):-5V/-5V,碰撞池入口电压(CEP):-15 V/-13 V,碎裂电压 (CE):-26V/-25 V,碰撞室射出电压(CXP):-2 V/-2 V;氘代尼群地平 [M-H]-母离子m/z:364.10,定量/定性碎片离子m/z:122.00/241.10;解簇电压(DP):-50V/-50 V,射入电压 (EP):-5V/-5 V,碰撞池入口电压(CEP):-15 V/-15 V,碎裂电压 (CE):-27 V/25 V,碰撞室射出电压(CXP):-2 V/-2 V。
2.2 溶液的配置
精密称定尼群地平对照品5.84mg于10 mL棕色容量瓶,用乙腈溶解并定容稀释成浓度分别为1.97、4.93、14.8、44.3、133、400ng·mL-1的标准曲线工作液;同法精密称定尼群地平对照品5.26mg和内标氘代尼群地平对照品2.60 mg用乙腈分别稀释成质量浓度分别为 3.90、82.0、328ng·mL-1的质控工作液和质量浓度为2.08 ng·mL-1的内标沉淀剂。
2.3 分析方法的确证
2.3.1 特异性
测定空白血浆样品、空白血浆加标样品及任一志愿者服药后的未知浓度血浆样品,由尼群地平、氘代尼群地平定量离子对(m/z359.10→m/z122.00、m/z 364.10→m/z122.00) 的提取离子流图可知,血浆中内源性物质和代谢物不干扰尼群地平和内标的测定,方法的特异性良好。
2.3.2 标准曲线及定量下限
配制血药质量浓度为 0.197、0.493、1.48、4.43、13.3、40.0 ng·mL-1的标准曲线样品,进样检测,得标准曲线回归方程为Y=0.284X+0.00962(r=0.9996),结果表明,尼群地平血药质量浓度在0.197~40.0 ng·mL-1范围内线性关系良好,定量下限为 0.197 ng·mL-1。2.3.3 精密度与准确度
处理定量下限、低、中、高4个质量浓度(0.197、0.390、8.20、32.8 ng·mL-1)的血浆样品各6份,连续3天,进样检测,得批内准确度为88.32%~111.28%,批内精密度为RSD%为1.75%~6.42%,批间准确度为102.03%~106.15%,批间精密度为RSD%为2.83%~10.95%,符合生物样本分析检测要求。
2.3.4 提取回收率
配制质量浓度分别为0.390、8.20、32.8 ng·mL-1的质控血浆样品,每样6份,与相应质量浓度标准品溶液以水代替血浆同法配制的6份样品比较,计算提取回收率,3个质量浓度尼群地平的提取回收率分别为 (106.14±4.82)%,(103.93±3.22) %和 (101.53±4.50) %,相对标准偏差RSD%分别为4.53%、3.10%和4.43%,平均提取回收率为103.89%,相对标准偏差RSD%为2.22%,回收对尼群地平及内标氘代尼群地平的影响较小,符合生物样本分析检测要求。
2.3.5 基质效应

图1血浆中尼群地平和内标氘代尼群地平的提取离子流图Fig.1 Extracted ion chromatograms of nitrendipine(m/z359.10 →m/z122.00,1) and nitrendipine-d5(m/z 364.10 →m/z122.00,2) in plasma samples
处理低、中、高(0.390、8.20、32.8ng·mL-1)3个质量浓度的尼群地平基质样品,每浓度各6份,与相应浓度标准品以水代替血浆照“血浆样品的预处理”方法操作处理后的6份样品进样比较,计算内标归一化基质效应,尼群地平各质量浓度的内标归一化基质效应分别为(112.85±4.20) % , (111.56±4.42) % 和 (111.84 ±4.23)%,相对标准偏差RSD%分别为3.72%、3.96%、3.78%,平均内标归一化基质效应为112.20%,相对标准偏差RSD%为0.61%,基质对尼群地平及内标氘代尼群地平的影响较小,满足生物样品分析检测要求。
2.3.6 稳定性
取低、中、高3个质量浓度(3.90、82.0、328ng·mL-1)的质控标准工作液各15份,室温氮气吹干,加入100 μL空白血浆,涡匀,分别考察室温避光放置10 h和室温不避光放置3 h及处理后放置7d的稳定性。结果所有样品相对偏差RE%在-10.37%~8.21%范围内,RSD%在1.23%~8.49%范围内,表明尼群地平血浆样本在上述条件下均稳定。
2.4 临床试验
试验方案实施前经伦理委员会审查批准,16名健康志愿者体格检查、心电图检查和实验室检查均正常。试验前两周至试验结束未使用影响尼群地平片体内过程或安全性评价的药物或食物,自愿签署知情同意书,采用自身交叉对照设计,将志愿者随机分为空腹给药组和餐后给药组,空腹给药组服药前禁食10h,餐后给药组服药前禁食10h并于服药前30 min内进食高脂高热量餐,服药剂量为10 mg,清洗期7天,服药前(1 h内) 及服药后0.5 h、0.75 h、1 h、1.25 h、1.5 h、2 h、2.5 h、3 h、4 h、5 h、6 h、8 h、10 h、12 h、24 h采集静脉血,所采血液在3000 r·min-1,2~8℃条件下离心10 min,然后分离血浆样品,于-80℃冰箱中保存待测(全血采集和离心分装等均在避光环境下进行操作)。

图2 志愿者空腹状态 (A)和餐后状态 (B)下服用两种制剂后平均血药浓度-时间曲线 (n=8)Figure.2 Mean plasma concentration-time curves of oral administration of twopreparation under fasting (A)and fed (B)conditions in healthy volunteers(n=8)
2.5 统计学处理
采用DAS3.3.0软件非房室模型计算药代动力学参数,对药动学参数AUC和Cmax经对数转换后进行多因素方差分析和双单侧t检验,以AUC和Cmax的90%置信区间 (90%CI)评价尼群地平片的生物等效性。以多因素方差分析得到的残差(mean square error,MSE)[7],采用 DAS3.3.0 软件计算尼群地平空腹服药及餐后服药Cmax、AUC0-t、AUC0-∞的个体内变异和个体间变异。
3 结果
3.1 药-时曲线
志愿者餐后或空腹服用尼群地平参比制剂和受试制剂平均血药浓度-时间曲线,见图2。
3.2 药动学参数
采用DAS3.3.0软件计算得到的药代动力学参数结果见表1。
3.3 生物等效性评价
尼群地平片空腹状态或餐后状态服药后Cmax、AUC0-t、AUC0-∞的 90%CI 结果见表 2。Cmax、AUC0-t、AUC0-∞的 90%CI均超出 80%~ 125%,尼群地平两制剂不符合生物等效性假设,餐后服药药动学参数AUC在个体间差异有统计学意义
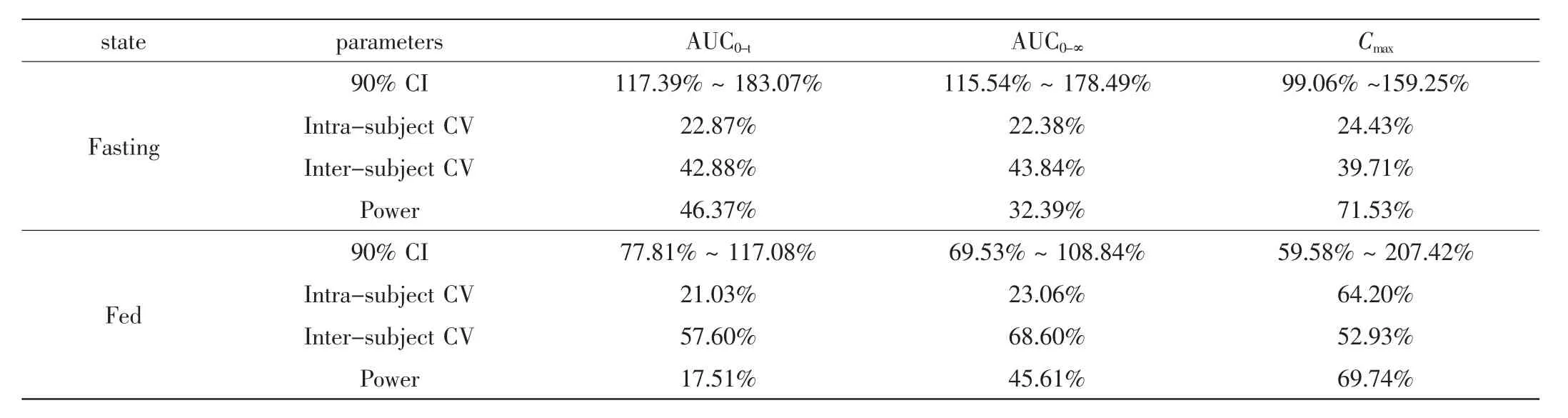
表2 受试者空腹及餐后状态下经口给予受试制剂与参比制剂后等效性统计检验Tab.2 Statistical test of bioequivalence after oral administration of test or reference preparation under fasting and high-fat diet conditions
(P<0.05),空腹服药药动学参数Cmax在个体间、AUC在个体间及药物间差异有统计学意义(p<0.05)。
空腹服用尼群地平片后Cmax、AUC0-t、AUC0-∞个体内变异为24.43%、22.87%、22.38%,个体间变异为39.71%、42.88%、43.84%;餐后服用尼群地平片后Cmax、AUC0-t、AUC0-∞个体内变异为64.20%、21.03%、23.06%,个体间变异为52.93%、57.60%、68.60%。
4 讨论
药动学参数Cmax、AUC个体间差异有统计学意义,可能与尼群地平药物本身个体间变异有关[8],空腹状态或餐后状态服药后药动学参数Cmax、AUC置信区间均超出80%~125%,两个企业生产的尼群地平片生物不等效,说明受试制剂与原研药仍存在一定差距,提示后续需要继续优化尼群地平片处方、改善制剂工艺,以期获得等效性结果。

