基于ISSR数据探讨节茎曲柄藓(Campylopus umbellatus (Arn.) Paris)遗传多样性和居群遗传结构
单壹壹 申琳 李丹丹 于晶
摘 要: 选用简单序列重复区间扩增多态性(ISSR)分子标记,对分布于浙江清凉峰国家级自然保护区顺溪坞和凉源、浙江台州临海天台山、浙江舟山嵊泗列岛、江苏苏州天平山、广西上思十万大山、台湾宜兰县马告生态公园和云南西双版纳纳板河流域国家自然保护区8个自然居群的40份节茎曲柄藓(Campylopus umbellatus (Arn.) Par.)的遗传多样性进行了研究.应用筛选出的12条引物,共扩增出172条清晰、重复性高的条带.使用POPGENE 3.2分析发现:其中158条条带的多态性位点百分率(PPB)为91.86%,根井正利基因多样性指数(H)为0.2922,香农-维纳多样性指数(I)为0.4459,说明节茎曲柄藓居群遗传多样性水平较高.8个居群的遗传分化系数(Gst)为0.6346,居群间的基因流(Nm)为0.2879,63.33%的遗传变异存在于居群间,36.67%的遗传变异存在于居群内,说明节茎曲柄藓居群间的遗传分化明显.基于ISSR数据的聚类分析表明:以遗传距离65为分组阈值,8个居群可被分为6组,节茎曲柄藓居群间的遗传分化主要由地理因素造成,居群内的遗传分化可能与生境的异质性有关.
关键词: 节茎曲柄藓; 简单序列重复区间扩增多态性(ISSR); 遗传多样性
中图分类号: Q 948文献标志码: A文章编号: 1000-5137(2019)02-0207-10
0 引 言
在分子水平上,对于苔藓植物的遗传研究一般运用分子标记法[1].目前,DNA分子标记技术已发展出10余种,常用手段包括随机扩增多态性DNA标记(RAPD)、简单序列重复区间扩增多态性(ISSR)、扩增片段长度多态性(AFLP)、相关序列扩增多态性(SRAP)等[1-2].ISSR是由加拿大ZIETKIEWICZ等[3]提出的,以锚定的微卫星为引物,扩增间隔较小的两个简单序列长度多态性(SSR)间的序列,再通过凝胶电泳条带分析样本DNA多态性的方法[2].其优点是无需预先知道基因组的任何信息就可以进行标记,可以在生长周期的任何阶段进行检测,而且引物设计容易,成本低,DNA用量少[1-2,4],被认为是一种非常理想的分子标记方法.ISSR分子标记技术已被广泛应用于许多被子植物[2,5-7]的遗传多样性分析中,但对于苔藓植物,如:黄丝瓜藓(Pohlia nutans (Hedw.) Lindb.)[8]、鼠尾藓(Myuroclada maximowiczii (G.G.Borshch.) Steere & W.B.Schofield)[9]、小羽藓属(Haplocladium (Müll.Hal.) Müll.Hal.)[10]和中华蓑藓(Macromitrium cavaleriei Cardot & Thér.)[11]的遗传多样性的研究,常使用的是RAPD标记法.汪琛颖等[12]对狭边大叶藓(Rhodobryum ontariense (Kindb.) Paris)[4]和真藓科(Bryaceae Schwgr.),王莹莹[13]对浙江千岛湖大灰藓(Hypnum plumiforme Wilson)和东亚小金发藓(Pogonatum inflexum (Lindb.) Sande Lac.),买买提明·苏来曼等[14]对水藓科(Fontinalaceae Schimp.),魏青永等[15]对卷叶凤尾藓(Fissidens dubius P.Beauv.)使用ISSR标记法进行了遗传多样性的研究.
曲尾藓科(Dicranaceae)的曲柄藓属(Campylopus Brid.)是泛热带分布的类群[16].自BRIDEL[16]基于Campylopus flexosus (Hedw.) Brid.创立曲柄藓属以来,该属植物先后被报道多达1480 种,目前接受的种名有160种左右[17].
中国曲柄藓属植物目前被接受的有20余种[18-21].其中,节茎曲柄藓(Campylopus umbellatus (Arn.) Paris)分布于中国十几个省.该种植物体形态、大小以及不同部位叶片特征变化很大,毛尖有无、毛尖长度、茎长度以及叶片和中肋宽度的比值等都会有强烈变异[21].其典型特点是:植物体中等至大型,粗壮,墨绿色或黄绿色,常具透明长毛尖,叶基部宽,具明显角细胞,不突出或略突出,中肋占叶片基部1/3~1/2,中肋背部有2~4个细胞高的栉片,叶片中上部细胞为纺锤形至短虫形.BROTHERUS[22]把叶片无透明毛尖和透明毛尖短的类型归类为C.sinensis (Müll.Hal.) J.-P.Frahm;DUBY[23]把叶片有毛尖、透明毛尖短、中肋上部栉片低的类型归类为C.nigrescens (Mitt.) Duby.DIXION[23]根据该种植物体与C.coreensis Cardot相似,因其叶片稍长、叶宽、中肋背面栉片稍高等,将其归类为一个变种C.coreensis Card.var.amoyensis Dixon & Thér;高谦[21]认为以上各类型均属本种特点范畴,故都拟为本种异名,并且认为本种并非中美洲和南美洲产的C.richardii Brid..FRAHM[14]在对东亚曲柄藓属植物进行修订时,列出了该种的12个异名,其中包括了C.coreensis Cardot.由密苏里植物园主办的Tropics(http://www.tropicos.org/)网站收录的该种异名达38个.
FRAHM[16]认为C.umbellatus (Arn.) Paris植物的大小在其分布范围内,从内部到邊缘呈梯度变化,在东南亚和中国南部高达几厘米,但在北部仅1 cm左右.为了解这些形态变异是否有遗传基础,本文作者基于ISSR技术,对该种的8个地理居群进行了遗传多样性分析.
1 实验材料与方法
1.1 实验材料
本实验对象为采自浙江、江苏、广西、云南和台湾的节茎曲柄藓8个居群40份样品,具体采集信息见表1.为确保采集的样品是不同克隆的植株,每个居群采样间距最小为5 m [14].样品采集后装于牛皮纸标本袋中,自然风干后冷冻保存备用.实验所涉及的凭证标本保存于上海师范大学(SHNU)苔藓植物标本馆.
1.2 试剂
植物基因组DNA提取试剂盒(天根生化科技(北京)有限公司,DP305);Es Taq MasterMix(康为世纪生物科技有限公司,CW0690);所有引物均由上海生物工程有限公司合成并提供.
1.3 DNA提取及聚合酶链式反应(PCR)扩增
选取40份节茎曲柄藓的新鲜植物体茎尖,无菌水冲洗干净并用变色硅胶粒干燥后,分别用试剂盒提取基因组DNA,制成DNA样品,-20℃保存备用;从加拿大哥伦比亚大学(UBC)公布的100条ISSR通用引物中,参考文献[2]选取退火温度为50~55 ℃之间的56条引物进行筛选,筛出的12条引物见表2;采用康为公司提供的Es Taq MasterMix 50 μL反应体系进行PCR扩增,扩增程序参考汪琛颖等[4]对狭边大叶藓遗传多样性ISSR分析的扩增程序;PCR扩增产物在含溴化乙锭(EB)核酸染料的质量浓度为20 g·mL-1的琼脂糖凝胶电泳中分离,电压为80 V;应用全自动数码凝胶成像分析系统(Tanon 2500)对电泳结果进行观察并拍照记录.
1.4 数据记录与分析
将实验得到的凝胶电泳图中的每一个条带均视为一个分子标记,统计电泳图谱是否有处于同一位置的DNA带,有的记为“1”,无带的记为“0”,得到一个0/1二元数据矩阵[4].采用POPGENE 3.2分析软件对节茎曲柄藓所有居群进行遗传多样性参数分析[4],分别计算多态性位点百分率(PPB)、根井正利基因多樣性指数(H)、香农-维纳多样性指数(I)等遗传多样性参数以及各居群间的遗传分化系数和基因流等遗传分化指数,并分别计算12条引物的PPB.运用PCORD 4.0软件,根据40份样品的遗传距离构建反映各居群遗传关系的聚类图,以研究各居群间遗传变异与地理距离的相关性[2,4].
2 结果与分析
2.1 节茎曲柄藓ISSR扩增结果
利用筛选出扩增条带清晰、重复性好的12条引物,对8个居群40份节茎曲柄藓样品进行PCR扩增,共得到172个扩增位点,其中158个为多态性位点,PPB达91.86%,表明8个居群的40份节茎曲柄藓样品在分子水平上具有丰富的多态性,遗传基础较广.12个引物扩增出的条带大小多集中在300~2500 bp之间.由表2可知,平均每个引物扩增出位点14.33个,多态性位点13.17个.扩增位点最多的是UBC841,共扩增出19个位点;引物UBC808,UBC880次之,分别为18个;最少的是UBC825和UBC827,只有9个.引物多态性位点百分率最高的是UBC825,UBC827和UBC842,可达100%.引物UBC826的PPB最低,但也达81.82%,说明引物UBC825,UBC827和UBC842对于节茎曲柄藓这8个居群遗传多样性的研究效果最好.本实验筛选出的12条ISSR引物,碱基A含量都非常丰富,其中5条含有丰富的碱基C,另外8条富含碱基G.
2.2 居群的遗传多样性分析
多样性指数通常用于表示居群内和居群间的遗传变异程度[11].基于ISSR标记的节茎曲柄藓的遗传多样性指数如表3所示.由表3可知:8个居群的PPB变化范围为9.30%~36.05%,PPB最高的居群是云南西双版纳纳板河居群,为36.05%;广西上思十万大山居群和浙江省清凉峰保护区的顺溪坞居群次之,都为35.47%;接着依次是浙江舟山嵊泗列岛居群、台湾宜兰县马告生态公园居群、浙江台州临海天台山居群和江苏苏州天平山居群,分别为34.30%,30.23%,29.07%和13.95%;多态性位点百分率最低的是浙江清凉峰保护区凉源居群,仅为9.30%;各居群内平均PPB为27.98%,物种水平上居群总的PPB为91.86%.
I的变化范围为0.0576~0.2210(表3),表明不同地理来源的节茎曲柄藓居群内的遗传多样性存在一定差异,其中I最高的是云南西双版纳纳板河居群,接着依次是十万大山居群、嵊泗列岛居群、顺溪坞居群、马告生态公园居群、天台山居群和天平山居群,最低的是凉源居群.各个居群内平均I为0.1635,物种水平上居群总的I为0.4459.
节茎曲柄藓居群的H的变化范围为0.0400~0.1526(表3),其中H最高的是云南西双版纳纳板河居群,接着依次是十万大山居群、嵊泗列岛居群、顺溪坞居群、天台山居群、马告生态公园居群和天平山居群,最低的是凉源居群.各个居群内H的平均值为0.1114,物种水平上居群总的H为0.2922.
由表3还可知,各居群的PPB,I和H比较一致,云南西双版纳纳板河、广西上思十万大山、浙江舟山嵊泗列岛和浙江清凉峰顺溪坞居群的遗传多样性指数比浙江台州临海天台山、台湾宜兰县马告生态公园、江苏苏州天平山和浙江清凉峰凉源居群的高.仅在个别居群之间,3个参数略有差异,如I和H反映嵊泗列岛居群的遗传多样性高于顺溪坞居群,而PPB反映的结果则相反;PPB和I反映马告生态公园居群的遗传多样性高于天台山居群,而H反映的结果则相反.
2.3 居群的遗传分化分析
H是衡量居群遗传分化的最常用指标,常用来计算总的遗传变异中,居群间变异所占的比例[10].表4显示:由I估算的总遗传变异中,63.33%的遗传变异存在于居群间,36.67%存在于居群内;由H估算的遗传分化系数表明总遗传变异中,61.88%的遗传变异存在于居群间,38.12%存在于居群内.I和H估算的结果一致,均表明节茎曲柄藓的遗传变异大部分存在于居群间.同时,居群的基因流较小,仅为0.2879,说明居群间的基因流动水平低,居群之间的遗传隔离明显,不同的居群通过遗传变异以适应不同的环境,但是基因交流较少.
2.4 居群的遗传距离和聚类分析
基于ISSR标记的8个节茎曲柄藓居群的遗传距离和遗传相似系数见表5,节茎曲柄藓8个居群间遗传相似系数在0.6408~0.8766之间变化,平均值为0.7517,说明节茎曲柄藓8个居群间的遗传相似性较小,居群间的遗传分化明显,这与2.3节的结果一致;其中浙江清凉峰保护区顺溪坞居群和浙江台州临海天台山居群遗传相似系数最高,为0.8766,其次是顺溪坞居群和凉源居群,遗传相似系数为0.8587,江苏苏州天平山居群和浙江清凉峰保护区凉源居群的遗传相似系数相对较小,为0.6408;8个居群的遗传距离在0.1317~0.4451之间变化,平均值为0.2895.
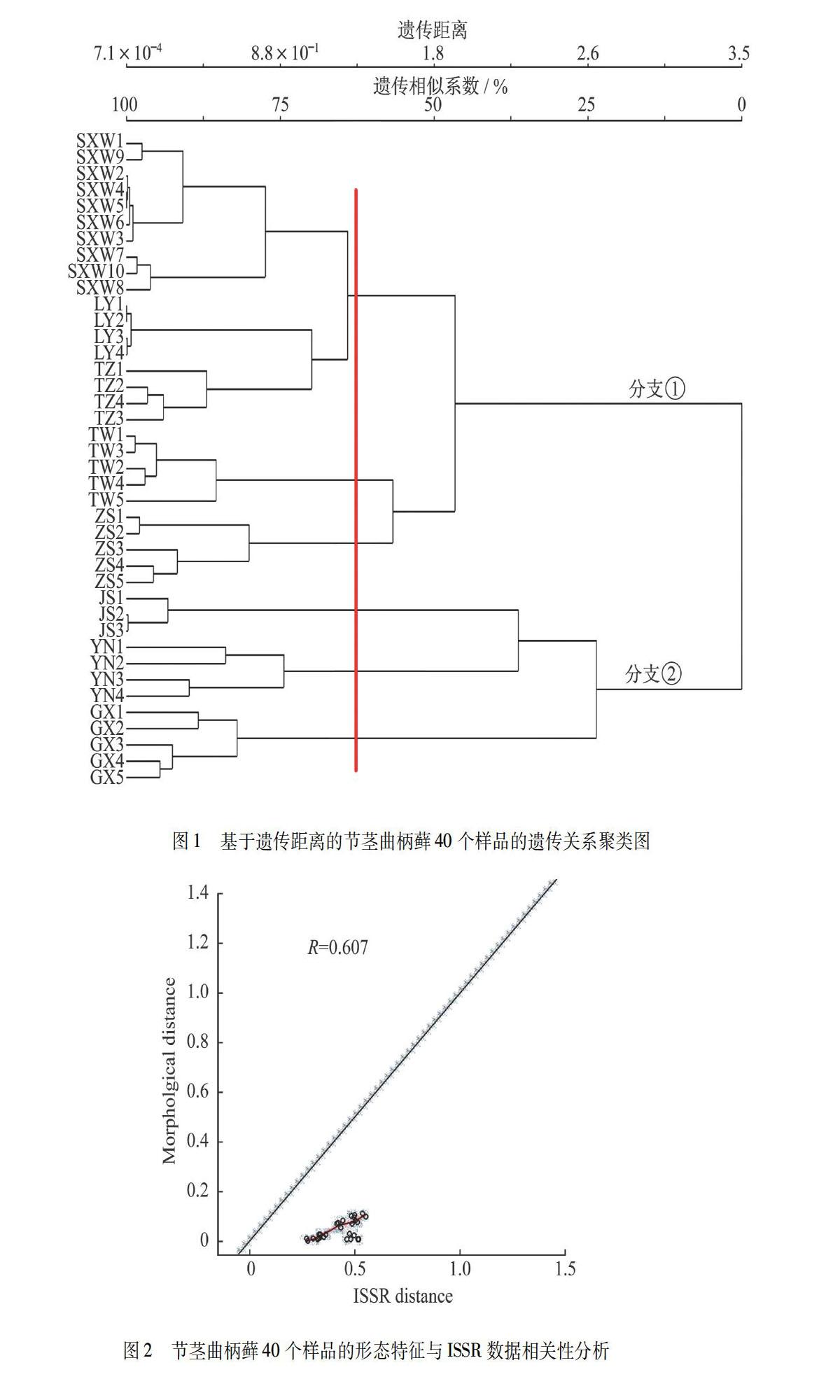
基于ISSR标记,应用POPGENE 3.2软件,根据遗传距离作出8个居群40个样品的遗传关系聚类图(图1).以遗传距离65为分组阈值,由图1可知,这8个居群可以分為6组,分别是浙江清凉峰保护区的顺溪坞居群、凉源居群和浙江台州临海天台山居群聚集成的一组,剩下的5个居群(台湾宜兰马告生态公园居群、浙江舟山嵊泗列岛居群、江苏苏州天平山居群、云南纳板河居群、广西上思十万大山居群)分别自成一组.这8个居群主要分成两个大的分支:分支①由顺溪坞居群、凉源居群、台州天台山居群、台湾宜兰居群及舟山嵊泗列岛居群组成;分支②由江苏天平山居群、云南纳板河居群和广西十万大山居群聚集形成.分支①又由2个小的分支组成:同属于浙江省的顺溪坞居群、凉源居群和台州天台山居群聚为一个小分支;同属于岛屿气候的舟山嵊泗列岛居群和台湾宜兰居群聚集为另一个小分支.分支②中江苏天平山居群先和云南纳板河居群聚集再与广西十万大山居群聚集.研究结果显示:节茎曲柄藓的遗传变异与地理位置及生境气候相关.
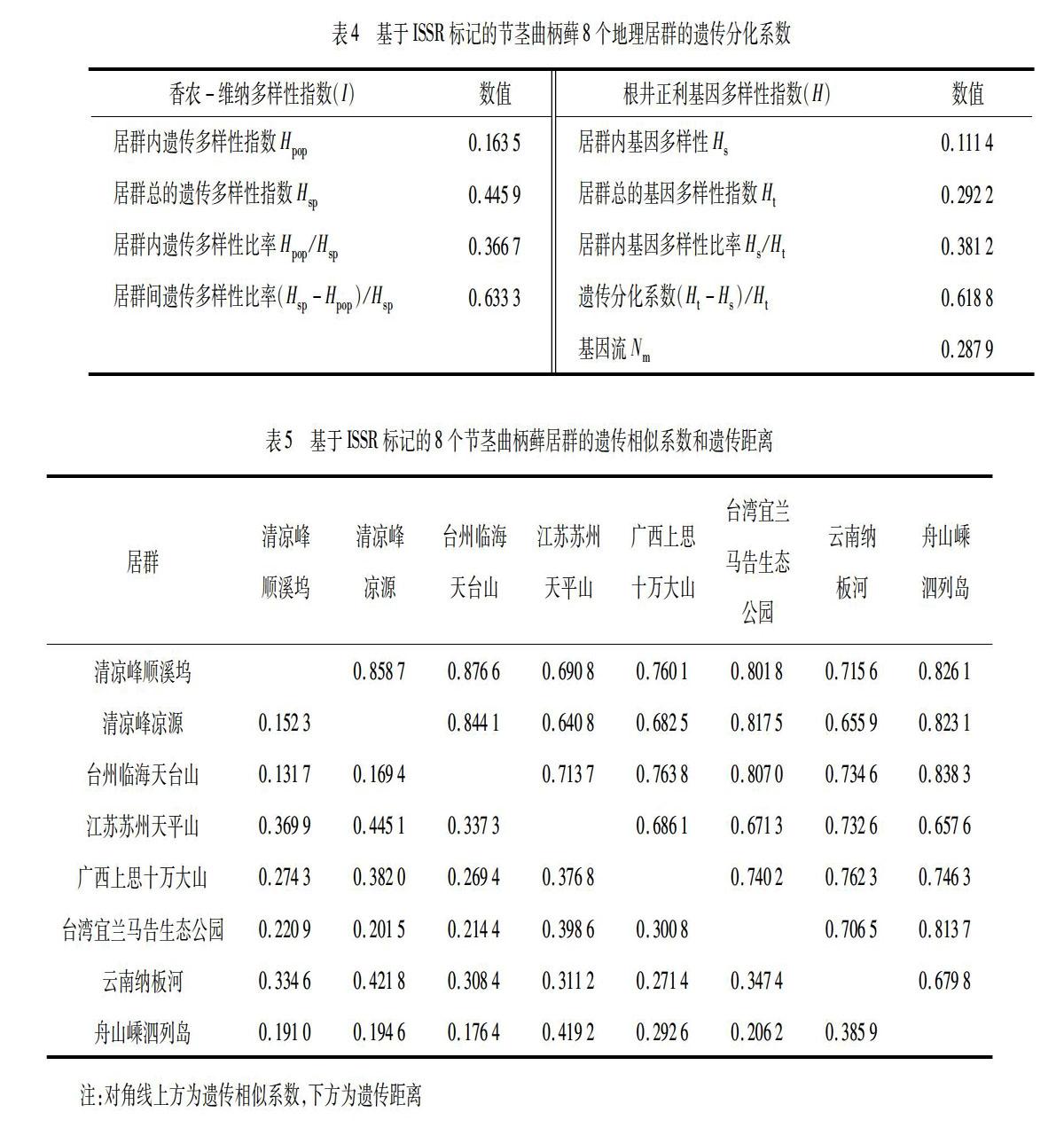
基于节茎曲柄藓40个样品,8个居群的形态特征数据,即ISSR电泳位点和8个居群分布的地理信息数据,应用R语言程序计算得到该种40个样品的形态特征与ISSR数据相关性分析图(图2).由图2可知,该种40个样品的形态分化与其地理分布的相关性系数R为0.607,在P<0.05的水平上达到显著相关.
3 讨 论
3.1 节茎曲柄藓的遗传多样性
在种水平上,应用12个引物对节茎曲柄藓8个居群40个样品进行了ISSR分析,共扩增出172条清晰、重复性高的条带,POPGENE 3.2分析结果表明:有158个为多态性位点,PPB为91.86%;I为0.4459,居群内平均值为0.1635;H为0.2922,居群内平均值为0.1114.郭水良等[11]基于RAPD数据探讨了中华蓑藓4个居群的遗传变异基础,中华蓑藓的PPB为79.96%,物种水平的I为0.5126,4个居群的平均值为0.4055,总的H为0.3307,4个居群的平均值为0.2755,认为中华蓑藓的遗传变异主要存在于居群之内.刘丽等[9]也应用RAPD分子标记对鼠尾藓8个居群的遗传多样性进行了研究,得到其PPB为84.60%,I为0.4877,H为0.3326,居群内平均值为0.2228;李倩影[10]研究了小羽藓属遗传多样性,在104个检测位点中发现94个多态性位点,PPB为91.35%,总居群的H为0.2682,I为0.4108,该种居群表现出较高的遗传多样性,总的遗传居群间遗传分化系数为0.5591,居群内遗传分化系数为0.1182,居群间的变异程度远远大于居群内的变异程度;汪琛颖等[4]对9个狭边大叶藓居群的遗传多样性进行了ISSR分析,PPB为37.75%,H为0.1530,I为0.2228,遗传分化指数为0.2997,遗传变异主要存在于居群内,认为该种的居群遗传距离和地理距离没有相关性.比较发现,节茎曲柄藓的遗传多样性与鼠尾藓和小羽藓属相近,而高于狭边大叶藓,低于中华蓑藓.可能是因为在野外,很少见有节茎曲柄藓的孢子体,说明该种有性繁殖能力弱,配子体主要通过营养繁殖扩展种群,这种繁殖方式使其遗传多样性主要存在于居群之间.
3.2 节茎曲柄藓的遗传结构与分化
从聚类分析图(图1)可看出:节茎曲柄藓的40个样本8个居群以遗传距离65为分组阈值可以分为6组,同属于浙江省的顺溪坞居群、凉源居群以及台州临海天台山居群聚集为一组,说明这3个居群的遗传相似性高,遗传距离近,这个结论与其相近的地理位置关系是吻合的;剩下的5个居群(台湾宜兰居群、浙江舟山嵊泗列岛居群、江苏天平山居群、云南纳板河居群、广西十万大山居群)各自分别形成5组,这5个居群的遗传相似性低,遗传距离远,这与其所处的空间距离较远吻合;聚类图中分支②是由江苏天平山居群、云南纳板河居群、广西十万大山居群聚集形成,云南纳板河居群和广西十万大山居群所处的地理位置毗邻且处于同一纬度,而这两个居群与江苏天平山居群的气候特点相似,说明空间距离相近的居群,或者生长环境相近的居群遗传相似度高.分支①中:虽然舟山嵊泗列岛也属于浙江省,但其同台湾宜兰居群先聚集在一起,最终才与浙江省另外3个居群形成的分支聚集在一起,这是由于这两个地区都属于岛屿气候.说明节茎曲柄藓的遗传变异受地理生境和环境气候影响大,这8个居群的基因流动水平较低,居群间遗传分化明显,这与居群所处环境的异质性有关.同时,形态特征与ISSR数据相关性分析图(图2)反映出该种40个样品的形态分化与其地理分布的相关性指数为0.607,在P<0.05的水平上达到显著相关,也证明了节茎曲柄藓8个居群间的遗传分化与所处环境的异质性有关.
WRIGHT[25]认为,居群间基因流大于1时,则能发挥其均质化作用,反之若基因流小于1时,则表明基因流是造成遗传分化的主要因素,不同的基因型在不同的微生境上的适合度不同,导致具有相同基因型的个体聚集在相似的微生境上,从而产生居群间的遗传分化.本研究中,节茎曲柄藓居群的基因流为0.2879,遗传分化系数为0.6346,说明节茎曲柄藓居群间虽然有一定的基因流动,但是流动水平较低,且主要存在于生境相似的居群间,而在居群内部,由于居群生境连续性差,像江苏的天平山、清凉峰保护区的凉源,发生大量的遗传漂变[4],从而导致该种植物遗传变异的产生.
3.3 岛屿生境的节茎曲柄藓居群的遗传多样性分析
由于岛屿的特殊环境,关于其苔藓植物的遗传多样性研究较少.沿海岛屿,由于长期处于隔离状态下,并且相当一部分苔藓植物又很少产生孢子,无法基于孢子进行远距离传播,因而产生基因流减弱,苔藓植物遗传漂变等[26].WANG等[27]研究发现:千岛湖区破碎化的生境中,以无性繁殖为主的大灰藓(Hypnum plumiforme Wilson),其岛屿居群的遗传多样性显著高于湖边居群,而经常以有性繁殖为主的东亚小金发藓(Pogonatum inflexum (Lindb.) Lac.),其岛屿群落和湖边群落的遗传分化程度不高.
本研究中采自舟山嵊泗列岛的节茎曲柄藓居群,其位于长江口与杭州湾的交汇处,在浙江省最东部、舟山群岛最北部,处于华南褶皱系的次级构造单元新昌—定海—花鸟山断隆的东北部边缘,是浙东天台山脉向东北延伸沉陷入海的外露部分[26].从表5可知,舟山嵊泗列岛居群与台州天台山居群的遗传相似性系数最高,其次是与同样位于浙江的顺溪坞和凉源居群.聚类分析图(图1)也显示:舟山嵊泗列岛节茎曲柄藓居群最后与浙江顺溪坞和凉源居群聚类在一起,说明节茎曲柄藓居群遗传距离和地理距离有相关性.多态性位点百分率、根井正利基因多样性指数和香浓-维纳多样性指数(表3)分析表明:舟山嵊泗列岛节茎曲柄藓居群的遗传多样性又高于浙江台州天台山居群.这与WANG等[27]对千岛湖区大灰藓居群遗传多样性的研究结果相符,说明岛屿生境的长期隔离使苔藓植物发生遗传漂变,这也印证了HUTSEMKERS等[28]的观点:海洋岛屿不是孢子植物遗传多样性的“洼地”,也不是进化上的死胡同.
本研究中采自舟山嵊泗列岛的节茎曲柄藓居群与采自台湾的居群聚类在一起,这是由岛屿环境的特殊性导致的.嵊泗列岛属亚热带海洋性季风气候,冬无畏寒,夏无酷暑,常年温和湿润,四季分明[29];台湾是位于亚洲东部、太平洋西北侧的岛屿,北回归线将其划为南北两个气候区,北部属亚热带季风气候,南部则为热带季风气候,因其四面环海,气候又受海洋性季风调节.本研究所用样品采自台湾最北端的宜兰县马告生态公园明池森林游乐区,气候特点与嵊泗列岛相似,且经度相近,故节茎曲柄藓在这两个地区的居群遗传距离相近,在聚类图上聚集在一起.
参考文献:
[1] 王慧,徐杰.分子生物学在苔藓植物分类学中的应用 [J].科学时代,2013(3):1-3.
WANG H,XU J.Application of molecular biology in taxonomy of bryophytes [J].Science Times,2013(3):1-3.
[2] 刘德好.中国主要稻区稗属植物分类与多样性研究 [D].上海:上海师范大学,2014.
LIU D H.On classification and diversity of Echinochloa Beauv.in main rice regions of China [D].Shanghai:Shanghai Normal University,2014.
[3] ZIETKIEWICZ E,RAFALSKI A,LABUDA D.Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification [J].Genomics,1994,20(2):176-183.
[4] 汪琛穎,赵建成.狭边大叶藓(Rhodobryum ontariense)遗传多样性的ISSR分析 [J].贵州师范大学学报(自然科学版),2010,28(4):33-40.
WANG C Y,ZHAO J C.Genetic diversity in a medicinal plant species:Rhodobryum ontariense (Bryaceae),detected by ISSR[J].Journal of Guizhou Normal University (Natural Sciences),2010,28(4):33-40.
[5] 吴雪琴.南岭地区观光木居种群遗传多样性的ISSR分析 [D].长沙:中南林业科技大学,2013.
WU X Q.ISSR analysis on genetic diversity of Tsoongiodendron odorum chun populations from the Nanling Mountains [D].Changsha:Central South University of Forestry and Technology,2013.
[6] 王仕玉,郭凤根,张应华,等.18份滇产岩白菜资源的ISSR分析 [J].中国农学通报,2012,28(7):114-118.
WANG S Y,GUO F G,ZHANG Y H,et al.ISSR analysis of 18 Bergenia purpurascens resources in Yunnan [J].Chinese Agricultural Science Bulletin,2012,28(7):114-118.
[7] 吴祝华,施季森,席梦利,等.百合属野生种及品种亲缘关系的 ISSR 分析 [J].江苏农业科学,2012,40(1):19-22.
WU Z H,SHI J S,XI M L,et al.ISSR analysis of the relationship between wild species and varieties of Lilium [J].Jiangsu Agricultural Science,2012,40(1):19-22.
[8] SKOTNICKI M,BARGAGLI R,NINHAM J.Genetic diversity in the moss Pohlia nutans on geothermal ground of Mount Rittmann,Victoria Land,Antarctica [J].Polar Biology,2002,25(10):771-777.
[9] 劉丽,朱永青,王幼芳.鼠尾藓不同居群间形态及RAPD分析 [J].云南植物研究,2006,28(6):570-574.
LIU L,ZHU Y Q,WANG Y F.Morphological and RAPD analyses of different Myuroclada maximowiczii (Brachytheciaceae) populations [J].Acta Botanica Yunnanica,2006,28(6):570-574.
[10] 李倩影.小羽藓属(Haplocladium)植物遗传多样性及其与环境因子关系分析 [D].上海:上海师范大学,2010.
LI Q Y.Genetic diodiversity of moss genus Haplocladium and its relationship with the environmental factors [D].Shanghai:Shanghai Normal University,2010.
[11] 郭水良,郑园园,娄玉霞,等.基于RAPD 数据探讨中华蓑藓(Macromitrium cavaleriei Card.& Ther.) 形态变异的遗传基础 [J].植物科学学报,2011,29(3):312-318.
GUO S L,ZHENG Y Y,LOU Y X,et al.Genetic background of morphological variation in Macromitrium cavaleriei Card.& Ther.) based on RAPD [J].Plant Science Journal,2011,29(3):312-318.
[12] 汪琛颖,赵建成.真藓科植物ISSR-PCR反应体系的优化及ISSR指纹图谱的初步构建 [J].安徽农业科学,2011,39(27):16490-16493.
WANG C Y,ZHAO J C.Optimization of ISSR-PCR reaction system and preliminary construction of ISSR fingerprinting of some species in Bryaceae [J].Journal of Anhui Agricultural Sciences,2011,39(27):16490-16493.
[13] 王莹莹.浙江千岛湖生境片断化对苔藓植物物种及遗传多样性的影响 [D].上海:华东师范大学,2011.
WANG Y Y.Effects of habitat fragmentation on bryophytes richness and genetic diversity in Thousand-Island Lake Region,Zhejiang [D].Shanghai:East China Normal University,2011.
[14] 买买提明·苏来曼,徐红红,玛尔孜亚·阿不力米提,等.水藓科植物遗传多样性研究 [J].新疆大学学报(自然科学版),2013,30(4):390-395.
MAMTIMIN S,XU H H,MARZIYA A,et al.Genetic diversity of fontinalaceae by ISSR analysis [J].Journal of Xinjiang University (Natural Science),2013,30(4):390-395.
[15] 魏青永,郭水良,曹同,等.基于 ISSR 数据探讨卷叶凤尾藓 (Fissidens dubius P.Beauv.) 遗传多样性 [J].植物科学学报,2016,34(2):238-245.
WEI Q Y,GUO S L,CAO T,et al.Genetic diversity of Fissidens dubius P.Beauv.based on ISSR data [J].Plant Science Journal,2016,34(2):238-245.
[16] BRIDEL S E.Muscologiae Recentiorum Supplementum [M].Gotha:C.G.Ettinger,1819,4:220.
[17] FRAHM J P.A revision of the East-Asian species of Campylopus [J].Journal of the Hattori Botanical Laboratory,1992,71:133-164.
[18] CROSBY M R,MAGILL R E,ALLEN B,et al.A Checklist of the Mosses [M].St.Louis:Missouri Botanical Garden,2000:55-246.
[19] FRAHM J P.The Campylopus species of the world-a picture book:photographs of 59 species,subspecies and varieties [J].Archive for Bryology,2012(Special 9):1-63.
[20] 贾渝,何思.中国生物物种名录:第1卷植物,苔藓植物 [M].北京:科学出版社,2013.
JIA Y,HE S.Species Catalogue of China:Volume 1 Plants,Bryophytes [M].Beijing:Science Press,2013.
[21] 高谦.中国苔藓植物志:第1卷 [M].北京:科学出版社,1994.
GAO C.Flora Bryophytarum Sinicorum:Volume 1 [M].Beijing:Science Press,1994.
[22] BROTHERUS V F.Musci novi sinenses collecti a Dr.Henr.Handel-Mazzetti.II [J].Sitzungsberichte,Akademie der Wissenschaften in Wien.Mathematisch-naturwissenschaftliche Klasse.Abteilung 1,1924,133:559-584.
[23] DUBY J .Choix de cryptogames exotiques nouvelles ou mal counues:I.mousses [J].Mémoires de la Société de Physique et d'Histoire Naturelle de Genève,1868,19:291-304.
[24] DIXON H N.Mosses of Hong Kong with other Chinese mosses [J].Hong Kong Naturalist,1933,2(Suppl.):1-31.
[25] WRIGHT S.Isolation by distance under diverse systems of mating [J].Genetics,1946,31(1):39-59.
[26] 于晶,孙鹏雁,郭水良.岛屿苔藓植物多样性和生物地理学研究的意义、概况和方向 [J].上海师范大学学报(自然科学版),2016,45(1):70-75.
YU J,SUN P Y,GUO S L.Studies on diversity and biogeography of island bryophytes:significances,progress and dircetion [J].Journal of Shanghai Normal University (Natural Sciences),2016,45(1):70-75.
[27] WANG Y Y,ZHU Y Q,WANG Y F.Differences in spatial genetic structure and diversity in two mosses with different dispersal strategies in a fragmented landscape [J].Journal of Bryology,2012,34(1):9-16.
[28] HUTSEMKERS V,SZVNYI P,SHWA A J,et al.Oceanic islands are not sinks of biodiversity in spore-producing plants [J].Proceedings of the National Academy of Sciences,2011,108(47):18989-18994.
[29] 任淑華,蔡克勤.嵊泗列岛旅游气候资源开发利用 [J].海洋开发与管理,2008,25(5):112-114.
REN S H,CAI K Q.Development and utilization of tourism climate resources in the Shengsi Islands [J].Ocean Development and Management,2008,25(5):112-114.
(责任编辑:顾浩然)

