茶树咖啡碱合成酶基因稀有等位变异TCS1g的筛选、克隆及功能
刘玉飞,金基强,姚明哲,陈亮
茶树咖啡碱合成酶基因稀有等位变异的筛选、克隆及功能
刘玉飞1,2,金基强1,姚明哲1,陈亮1
(1中国农业科学院茶叶研究所/农业农村部茶树生物学与资源利用重点实验室,杭州 310008;2中国农业科学院研究生院,北京 100081)
【目的】茶树咖啡碱合成酶1(TCS1)是山茶属()茶组植物咖啡碱合成的关键酶,具有丰富的等位变异。从我国丰富的茶树种质资源中发掘稀有等位变异并研究其功能,深入解析茶树咖啡碱合成机制,为低咖啡碱育种提供新的基因资源。【方法】利用特异引物TCS1P InDel F/R对673份茶树资源中的等位变异进行鉴定;使用引物TCS1cDNAF/R,从含有新稀有等位变异的茶树资源中克隆基因的cDNA全长序列;利用生物信息学、实时荧光定量PCR(qRT-PCR)和原核表达等方法研究新发现稀有等位基因的功能。【结果】在部分大理茶()资源中鉴定到一个新的稀有等位变异,命名为。从大理茶资源‘龙陵17’(LL17,含有的等位变异为和)中克隆了的编码区序列全长为1 098 bp,编码365个氨基酸,编码蛋白的分子量和理论等电点分别为40.9 kD和5.1。序列比对结果表明,与、、、、的相似度在94.1%—99.2%;与具有可可碱合成酶活性(TS)的和编码蛋白序列相似度均大于96.7%,而与同时具有TS和咖啡碱合成酶(CS)活性的TCS1a、TCS1d、TCS1e、TCS1f相似度都小于95.4%,且TCS1g第221位氨基酸残基与TCS1b、TCS1c同为组氨酸(His),而TCS1a、TCS1d、TCS1e、TCS1f为精氨酸(Arg)。第221位氨基酸残基位于TCS1g蛋白活性中心,该位点的突变(His突变为Arg),可以导致TCS1g的等电点(5.05变为5.06)和亲水性(-0.119变为-0.123)发生改变。此外,5′上游调控区域的比对结果显示、、起始密码子(ATG)比、、延后了15 bp。原核表达发现TCS1g具有TS活性,活性为44.3 pkat/mg,但未检测到CS活性。qRT-PCR的结果表明LL17中等位变异有表达。LL17的咖啡碱和可可碱的含量分别为40.3 mg·g-1和5.4 mg·g-1。【结论】鉴定并克隆了一个新的稀有等位变异,其在LL17中具有一定的表达水平,且其表达蛋白具有TS活性,而未检测到CS活性;推测决定TCS1g仅具有TS活性的关键位点是第221位氨基酸残基。
等位变异;咖啡碱合成酶;功能分析;嘌呤生物碱;茶树
0 引言
【研究意义】咖啡碱(caffeine,Cf)是茶叶的重要功能成分之一,具有兴奋和刺激神经的作用[1-4],但是过量的摄入会使一些敏感人群出现失眠等现象[5-7]。因此,保持茶叶应有风味和营养价值的低咖啡碱茶和茶制品受到了特殊需求消费群体的青睐[8]。低咖啡碱茶树育种是实现茶叶低(无)咖啡碱最经济、安全和有效的方法[9]。从我国丰富多样的茶树种质中发掘咖啡碱合成酶稀有等位基因资源,探析其遗传机制,对低(无)咖啡碱茶树育种具有重要理论和实践指导作用。【前人研究进展】咖啡碱的生物合成是以黄嘌呤核苷(xanthosine,XR)为底物,通过三步甲基化、一步脱核苷酸化的核心途径来实现的[10-12](图1)。核心途径第一步(-7)、第二步(-3)和第三步(-1)甲基化反应均由-甲基转移酶类(-methyltransferases,NMTs)催化完成,其甲基供体是-腺苷-L-甲硫氨酸(-adenosyl-L-methionine,SAM)[13]。茶树咖啡碱合成酶(tea caffeine synthase,TCS)属于NMTs,可以催化-3和(或)-1甲基化反应。Kato等[14]和YONEYAMA等[15]分别克隆到一个(和)的cDNA全长,并通过原核表达发现TCS1具有催化-3和-1甲基化的活性,而TCS2不具有NMT活性。金基强等[16]克隆了6条茶树咖啡碱合成酶的基因组全长(—),其中为假基因,而、、在嫩叶中表达量很低。以上研究均表明TCS1是催化茶树咖啡碱生物合成后两步甲基化的关键酶。JIN等[17]发现在茶组(Sect.)植物中具有多个等位变异,根据5′上游调控区域的插入/缺失突变在茶组植物中鉴定到6个等位变异(),并克隆了这6个等位变异的cDNA全长,其中、、分别与NCBI上已登录的、(来源于滇缅茶,)和(来源于毛叶茶)的序列一致,蛋白重组试验发现TCS1d、TCS1e、TCS1f与TCS1a(TCS1)都具有催化-3和-1甲基化的活性,而YONEYAMA等[15]研究发现ICS1(TCS1b)和PCS1(TCS1c)仅具有催化-3甲基化反应的功能。具有多个等位变异是由茶树咖啡碱合成酶基因的独立进化和近期的快速演化机制导致[18-21]。也正是由于序列变异多样,导致了我国茶树资源嘌呤生物碱具有不同的分布模式:多数资源以咖啡碱为主(2.5%—4.5%)[16],少数资源以可可碱[22-24]或茶叶碱[25]为优势组分。【本研究切入点】是茶树咖啡碱合成的关键基因,具有丰富的等位变异,以往研究主要对茶种植物中含有的等位变异进行了筛选,但对茶树近源植物(多为野生茶树资源)筛选较少,因此有必要对更多的茶树近源植物进行鉴定,发掘新的稀有等位变异。【拟解决的关键问题】通过进一步筛选我国茶树资源,从而确定是否还存在新的稀有等位变异;克隆新的稀有等位变异的基因序列,研究其序列特征和蛋白活性,进一步解析茶树咖啡碱合成的机制,为低咖啡碱茶树育种寻找新的优异等位基因。

(1)7-甲基黄嘌呤核苷合成酶(黄嘌呤核苷N-甲基转移酶);(2)N-甲基核苷酶;(3)可可碱合成酶(单甲基黄嘌呤N-甲基转移酶):TCS1b(ICS1)、TCS1c(PCS1);(4)咖啡碱合成酶(二甲基黄嘌呤N-甲基转移酶);(3-4)双功能咖啡碱合成酶:TCS1a、TCS1d、TCS1e、TCS1f。SAM:S-腺苷-L-甲硫氨酸;SAH:S-腺苷-L-高半胱氨酸;Ribose:核糖。图片参考文献[10-12]
1 材料与方法
试验于2016—2018年在中国农业科学院茶叶研究所进行。
1.1 试验材料
以国家种质杭州茶树圃采集的200份(多为地方品种和野生茶树资源)和云南采集的473份茶树资源(来源于临沧古茶树群体:野生、栽培大理茶,阿萨姆茶var.及其中间过渡型茶树)为试验材料,取一芽二叶新梢,迅速液氮固样,并置于-80℃保存,待基因组DNA的提取;另采摘龙井43(LJ43,)、广东可可茶(CCT,)和龙陵17(LL17,)春季第一轮一芽二叶新梢,一部分迅速液氮固样,并置于-80℃保存,用于总RNA的提取;另一部分采用120℃热风干燥5 min,75℃烘干,作为生化成分测定的样品。
1.2 TCS1稀有等位变异的筛选
利用DNAsecure新型植物基因组DNA提取试剂盒(DP320-03,天根生化科技)进行茶树基因组DNA的提取,提取完毕后所有DNA均稀释至50 ng·µL-1。利用特异引物TCS1P InDel F/R(表1),对提取的基因组DNA进行PCR扩增,扩增结束后在2.5%的琼脂糖凝胶上电泳检测。扩增区域为起始密码子ATG上游303 bp与第一外显子67 bp处。
1.3 生化成分测定
采用高效液相色谱法(high performance liquidchromatography,HPLC)测定生化样中生物碱含量,各样品均独立重复3次。待测样品的前处理参照GB/T 8313—2018[26],液相色谱测定条件参照金基强等[16]的测定方法。用SPSS17.0进行数据的统计分析。
1.4 总RNA的提取、cDNA的合成和TCS1等位变异cDNA全长的克隆
茶树总RNA的提取采用RNA快速提取试剂盒(RN5301,北京艾德莱生物科技),并利用FastKing cDNA第一链合成试剂盒(Kr116-02,天根生化科技)进行第一链cDNA的合成。以反转录得到的cDNA为模板进行PCR扩增,获取目的基因。参考JIN等[17]研究设计PCR扩增的引物TCS1cDNAF/R(表1)。
1.5 蛋白活性测定
表达载体pMAL-c5x和目标基因(添加酶切位点的引物TCS1gF/R见表1)同时进行双酶切,酶切成功后进行重组连接、鉴定,以构建蛋白活性测定的表达载体。将成功构建的表达载体和pMAL-c5x空载体分别转化至大肠杆菌表达菌株BL21(DE3) pLysS(CD701-03,全式金)的感受态细胞并进行阳性验证。
阳性菌扩大培养到250 mL,然后利用IPTG(终浓度0.5 mmol∙L-1)诱导蛋白表达:37℃,120 r/min,诱导4 h。蛋白纯化和蛋白活性检测参考JIN等[17]的方法进行,其中细胞破碎功率改为277 W。蛋白定量采用Bradford法进行(DQ101-01,全式金),每个样品均独立重复测定3次。
1.6 实时荧光定量PCR
以茶树作为内参基因(引物序列见表1)。其中TCS1-CS、TCS1-TS和TCS1-Total分别是研究表达蛋白同时具有可可碱和咖啡碱合成酶(caffeine synthase,CS)活性等位变异、表达蛋白仅具有可可碱合成酶(theobromine synthase,TS)活性等位变异和整体表达水平的引物。
Real-Time PCR反应使用定量试剂盒(KK4601,Kapa Biosystems),反应条件:95℃预变性1 min;95℃变性5 s,60℃退火延伸34 s,40个循环;60—95℃分析溶解曲线。应用ABI sequence detection system(Applied Biosystems,USA)进行检测,每个样品做3个生物学重复。

表1 试验引物及其序列
下划线表示酶切位点 The underlines are restriction enzyme cutting sites
1.7 序列分析
利用DNAMAN软件包对序列进行拼接;EXPASY(http://expasy.org/tools/)中的ProtParam工具对氨基酸序列进行基本的生物信息学分析;SOPMA(https://npsa-prabi.ibcp.fr/)对蛋白进行二级结构预测;利用ClustalW进行序列比对,EXPASY中的BoxShade输出同源比对的结果;MEGA6.0软件构建系统进化树,选用Neighbor-joining法,Bootstrap重复次数为1 000;EXPASY中的SWISS-MODEL进行蛋白建模,并用Swiss-PdbViewer[27]进行可视化。
2 结果
2.1 TCS1等位变异的筛选
利用特异引物TCS1P InDel F/R扩增673份茶树资源中等位变异的5′上游调控区域(目标片段长度为368 bp),从部分大理茶()资源中扩增出一条620 bp左右的特异条带,通过测序验证,该条带大小为617 bp。序列比对(图2)显示该片段与已往鉴定的序列差异明显,长度长95—347 bp,相似度在52.3%—94.6%,因此将具有该片段的稀有等位变异命名为。此外,本研究还发现、、的起始密码子“ATG”均比和、、延后15 bp(图2)。
2.2 TCS1gcDNA全长的克隆
通过等位变异的鉴定发现,具有这一等位变异的茶树资源,同时还含有一个或多个其他类型的等位变异,为了更好地研究的功能,本研究选择具有常规等位变异和特异等位变异的大理茶资源LL17为试验材料。从LL17总cDNA中获得了的全长cDNA序列,编码区长度为1 098 bp,编码365个氨基酸,生物信息学分析结果显示TCS1g分子量为40.9 kD,理论等电点为5.1,酸性氨基酸(天冬氨酸和谷氨酸)有50个,碱性氨基酸(精氨酸和赖氨酸)有33个,其中含量最高的3种氨基酸是:亮氨酸(10.7%)、谷氨酸(8.8%)和丝氨酸(8.8%)。
与—的核酸序列相似度在94.1%—99.2%,与TCS1a—TCS1f的蛋白序列的相似度均大于90%,其中与具有TS活性的TCS1b、TCS1c相似度都大于96%(表2)。与咖啡中现已克隆(NCBI登陆)的编码区序列的相似性在29.3%—39.8%,与可可中分离的具有可可碱合成酶功能的(AB096699)[15]的序列相似度为55.0%。利用茶树、可可和咖啡中的cDNA序列进行系统发生树分析(图3),发现不同物种的独立成簇,茶树中的不同等位变异聚为两类,Ⅰ类包括新克隆的和表达蛋白仅具有可可碱合成酶活性的、,Ⅱ类包括、、、。
对已经克隆的—和新克隆的的氨基酸序列进行序列比对(图4),结果显示TCS1g与TCS1的其他等位变异一样,都具有编码蛋白的3个SAM结合域A、B和C以及一个保守域YFFF[17,28-29]。另外,TCS1b、TCS1c、TCS1g相比于TCS1a、TCS1d、TCS1e、TCS1f还有13个氨基酸残基的变异(图4)。TCS1g蛋白质二级结构预测结果显示:47.4%为α-螺旋、13.2%为延伸链、4.9%为β-转角、34.5%为无规则卷曲;通过同源建模的方式对TCS1g进行了蛋白质三级结构模拟(图5),绿色和红色分别标注是TCS1g与甲基受体和甲基供体结合的氨基酸残基。

图2 TCS1g与TCS1其他6个等位变异5′上游调控区域的多序列比对

空心圆、空心正方形和空心三角分别标注山茶属、咖啡属和可可属的N-甲基转移酶基因。TCS1g加粗突显

表2 TCS1g与TCS1其他6个等位变异编码区核酸序列(矩阵的上半部分)和蛋白序列(矩阵的下半部分)的相似性(%)比较

SAM的结合域A、B和C以及一个保守域YFFF用红框标出[15,28-29]。与底物特异性结合的关键位点用篮框标出[15,17,30]。TCS1b、TCS1c、TCS1g相比于TCS1a、TCS1d、TCS1e、TCS1f的变异位点用棕黄色三角标出
2.3 TCS1g编码蛋白活性的测定
在甲基供体SAM存在下,将重组酶制剂与底物7-甲基黄嘌呤或可可碱一起27℃孵育1 h后,通过HPLC检测发现,以7-甲基黄嘌呤为底物的反应有可可碱的生成,以可可碱为底物的反应中未检测到有咖啡碱生成,说明TCS1g与TCS1b、TCS1c功能相似,都只有TS活性,不具有CS活性。测定结果(表3)显示,TCS1g的TS活性为44.3 pkat/mg,约为对照TCS1c的2.5倍,但小于对照TCS1a的TS活性。
2.4 TCS1g的表达水平分析
实时荧光定量PCR结果(图6)显示,LL17(具有和两种等位变异)中整体表达水平比LJ43低58.0%,比CCT高1.8倍。为了明确的表达水平,设计了引物TCS1-TS和TCS1-CS,来区分LL17中功能不同的和的表达水平,引物TCS1-TS用于检测表达蛋白仅具有TS活性的基因:、,TCS1-CS用于检测表达蛋白同时具有TS和CS活性的基因:。以仅具有等位变异的LJ43和仅具有的CCT分别作为引物TCS1-TS和TCS1-CS的阴性对照,图6表明,使用TCS1-TS检测LJ43和TCS1-CS检测CCT时,表达水平均极低,说明设计的引物特异性高,能区分两种不同功能的等位变异。定量结果(图6)表明,LL17中(TCS1-TS检测结果)有表达,但表达水平较低:只有对照CCT中表达量的34.5%,另外LL17中(TCS1-CS检测结果)的表达也较低,为对照LJ43中的41.6%。

表3 TCS1g重组蛋白活性分析
TCS1a[17]和TCS1c[31]的酶活性结果来自以往发表文献。ND表示未检出。下同
TCS1a[17]and TCS1c[31]were taken from reference. ND, not detected. The same as below

黄色氨基酸残基为139—287区间TCS1b、TCS1c、TCS1g与TCS1a、TCS1d、TCS1e、TCS1f不同的氨基酸残基。绿色和红色分别标注是与甲基受体和甲基供体结合的氨基酸残基
2.5 具有TCS1g茶树资源LL17生物碱的含量
为了明确具有等位变异的大理茶资源LL17(含有和两个等位变异)生物碱含量,本研究通过HPLC法进行了测定(表4),可可碱和咖啡碱的含量分别为5.4 mg·g-1和40.3 mg·g-1。
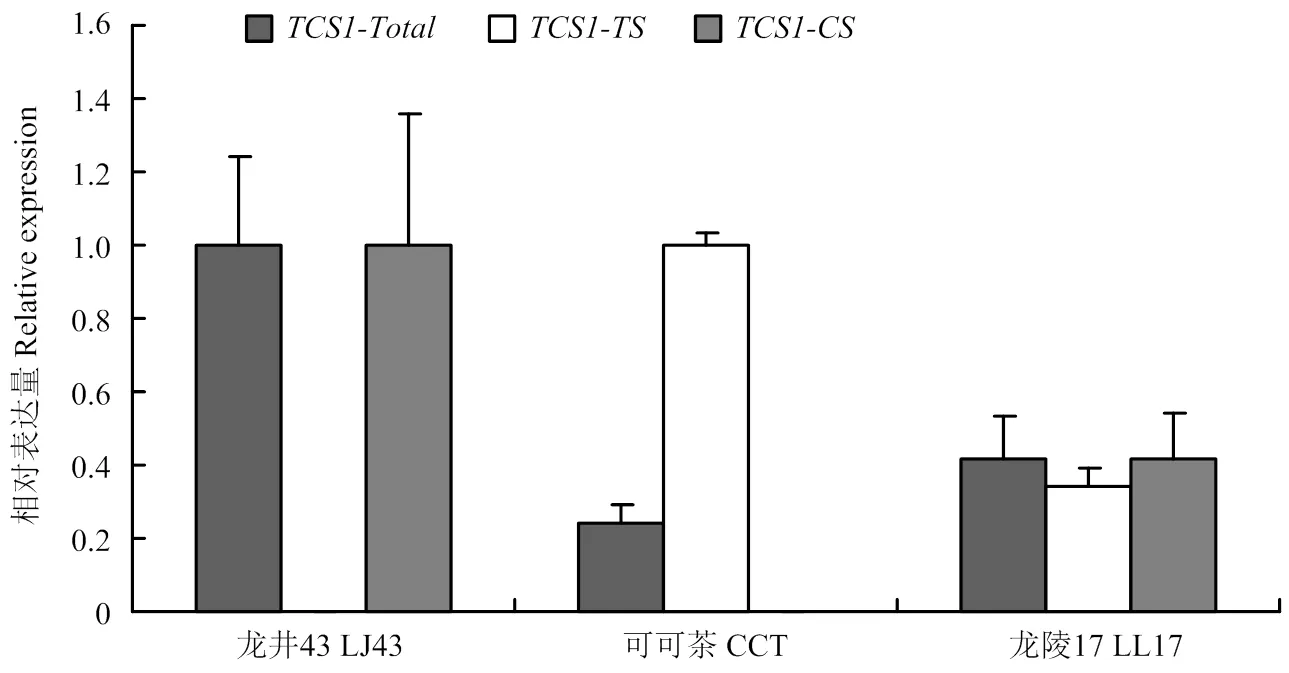
TCS1-CS,TCS1-TS和TCS1-Total分别表示表达蛋白同时具有可可碱和咖啡碱合成酶活性的等位变异、表达蛋白仅具有可可碱合成酶活性的等位变异和整体TCS1的表达水平
虽然LL17具有可可碱合成酶基因,但是其生物碱分布模式与仅具有可可碱合成酶基因的CCT(高可可碱、无咖啡碱)不同,而是与仅具有的LJ43(可可碱和咖啡碱的含量分别为1.8 mg·g-1和31.2 mg·g-1)相似。编码的蛋白能将大部分可可碱转化生成咖啡碱,从而导致具有的茶树资源没有大量可可碱的积累,LL17具有这一等位基因,所以LL17没能像CCT(只具有可可碱合成酶基因)那样积累大量的可可碱。

表4 含等位变异TCS1g的茶树资源LL17嘌呤生物碱的含量
3 讨论
3.1 TCS1具有丰富的等位变异
本研究通过对673份茶树资源进行筛选,鉴定到一个新的等位变异。与JIN等[17]克隆的、、、、、的氨基酸序列相似度均大于90%,核酸序列相似度均大于94%(表2),与茶树中其他的相似度也都大于91%,而与咖啡中家族的基因序列的相似度均低于40%,与可可中分离的具有可可碱合成酶功能的的序列相似度约55%。以NCBI中已登录的茶树、咖啡和可可中的的cDNA序列构建进化树,结果表明不同物种的独立成簇,而不是不同属中相同功能的聚在一起。新克隆的具有可可碱合成酶功能的也同样与茶树中的聚在一起,这一新的聚类分析与前人[18-21,32]的结果相符,表明不同植物中咖啡碱的生物合成是独立进化形成的。茶树的独立和近期快速的进化机制[20]导致了具有丰富的等位变异,本研究的发现也进一步表明了等位变异极其丰富。也正是由于序列变异多样,导致TCS1酶活性多样,从而形成了我国茶树资源嘌呤生物碱具有不同的分布模式。
3.2 TCS1g编码蛋白无咖啡碱合成酶活性的重要位点
氨基酸序列比对结果显示,TCS1g的蛋白序列与TCS1b和TCS1c的相似性程度都大于96%,并且、、明显聚为Ⅰ类(图3),即TS类[17](表达蛋白仅具有可可碱合成酶活性)。本研究原核表达蛋白的结果也表明TCS1g仅具有催化7-甲基黄嘌呤生成可可碱的功能,不具有催化可可碱生成咖啡碱的功能,这与聚类结果相符;另外,、、、属于Ⅱ类,即CS类(表达蛋白具有可可碱和咖啡碱合成酶活性)。TS类编码的氨基酸序列相比于CS类的TCS1a、TCS1d、TCS1e(氮端缺少一个苏氨酸残基)、TCS1f的氮端缺少一个“ELATA”序列;此外,TS类编码的氨基酸序列还有多个残基的变异。YONEYAMA等[15]通过构建杂交酶(TCS1a和TCS1c)发现决定TCS1蛋白底物结合特异性的区域是139—287这一段氨基酸残基,说明这一区域仅有的4个氨基酸残基(188、221、230和263位)的变异决定了TS类与CS类底物特异性。
分析发现188位的赖氨酸(Lys)-精氨酸(Arg)、230位的谷氨酸(Glu)-天冬氨酸(Asp)和263位的缬氨酸(Val)-异亮氨酸(Ile)这3个位点的变异均是同性质氨基酸残基的变异,对蛋白的等电点和亲水性影响很小。另外,通过同源建模发现,这3个突变位点的氨基酸残基都位于蛋白的外侧,距离酶活性中心较远,因此,推测其对蛋白结构和功能影响不大。221位的组氨酸(His)突变为Arg导致编码蛋白的等电点(5.05变为5.06)和亲水性(-0.119变为-0.123)都发生改变,图5显示221位氨基酸残基位于酶活性的中心,以往研究指出221位的His突变为Arg会改变酶与底物结合的位阻[17]。另外,YONEYAMA等[15]通过定点突变发现仅具有TS活性的TCS1c第221位氨基酸残基(对应于TCS1a的第225位氨基酸残基的位置)由His突变为Arg后,TCS1c不仅具有TS活性,还具有CS活性;李萌萌等[32]研究发现当第225位的Arg突变为His,TCS1a则不再具有CS活性。综上所述,茶树编码蛋白的第221位氨基酸残基(对应于TCS1a的第225位氨基酸残基的位置)的突变将直接决定其是否具有CS活性。本研究克隆得到的编码蛋白的第221位氨基酸残基也为His(对应于TCS1a的第225位氨基酸残基的位置),并且仅具有TS活性,所以根据以上分析,可以推断第221位氨基酸残基是导致TCS1g仅具有TS活性(不具有CS活性)的关键位点,其他位点的变异可能对蛋白活性的高低有影响。
3.3 TCS1稀有等位变异在低咖啡碱茶树育种中的作用
利用特异引物TCS1P InDel F/R鉴定了673份茶树资源具有的等位变异,发现这些茶树资源中大多数都含有这一等位变异,而—以及类型的稀有等位变异只存在于个别的茶树资源中。常规茶树资源中的表达蛋白能将茶树中的大部分可可碱转化生成咖啡碱,这也是多数茶树资源咖啡碱较高含量[17]的主要原因,所以在茶树资源中很难直接筛选得到低咖啡碱植株,并且也很难利用常规的茶树资源通过杂交育种的方式育成低(无)咖啡碱茶树品种。另外,有报道通过理化方法降低茶叶中咖啡碱的含量[33],但是这种方法生产的茶叶风味会发生变化,并且生产成本较高[34]。因此,利用特异的茶树资源作为亲本进行杂交育种是快速选育出综合性状优良、低咖啡碱含量茶树新品种的有效方法。
笔者课题组前期开发了有效的InDel标记,可以对茶树资源具有的等位基因进行鉴定。JIN等[17]利用该标记发现具有多个等位变异(、、、、、),笔者通过进一步的鉴定又获得了一个新的等位变异。其中只具有TS活性的等位变异(、、)和具有低转录水平的等位变异()均是低咖啡碱茶树育种可利用的优异等位变异,具有这些有利等位变异的茶树资源是低咖啡碱茶树育种的优异茶树资源。本研究筛选到的多份茶树资源都可以作为以后低咖啡碱杂交育种的亲本。
4 结论
获得了一个新的茶树稀有等位变异的全长cDNA,其编码蛋白的分子量为40.9 kD,理论等电点为5.1,具有催化7-甲基黄嘌呤生成可可碱的能力,未检测到催化可可碱生成咖啡碱的活性,TS活性大小为44.3 pkat/mg;TCS1g与TCS1b、TCS1c的序列相似度均大于96%,都属于TS类;推测第221位氨基酸残基是导致TCS1g仅具有TS活性(不具有CS活性)的关键性位点。
[1] 宛晓春. 茶叶生物化学. 第三版. 北京: 中国农业出版社, 2008: 8-63.
WAN X C.. Beijing: China Agricultural Press, 2008: 8-63. (in Chinese)
[2] PARE W. The effect of caffeine and seconal on a visual discrimination task., 1961, 54(5): 506-509.
[3] Smith A. Effects of caffeine on human behavior., 2002, 40(9): 1243-1255.
[4] 吴命燕, 范方媛, 梁月荣, 郑新强, 陆建良. 咖啡碱的生理功能及其作用机制. 茶叶科学, 2010, 30(4): 235-242.
Wu M Y, Fan F Y, Liang Y R, ZhengX Q, Lu J L. The physiological functions of caffeine and their related mechanisms., 2010, 30(4): 235-242. (in Chinese)
[5] Tsuang Y H, Sun J S, Chen L T, Sun S C, Chen S C. Direct effects of caffeine on osteoblastic cells metabolism: the possible causal effect of caffeine on the formation of osteoporosis., 2006, 1(7): 1-7.
[6] Grosso L M, Bracken M B. Caffeine metabolism, genetics, and perinatal outcomes: A review of exposure assessment considerations during pregnancy., 2005, 15(6): 460-466.
[7] Hallstrom H, Wolk A, Glynn A, Michaëlsson K. Coffee, tea plants and caffeine consumption in relation to osteoporotic fracture risk in a cohort of Swedish women., 2006: 17(7): 1055-1064.
[8] 陈盛相, 齐桂年, 李建华, 夏建冰. 低咖啡因茶树育种研究进展. 福建茶叶, 2009, 32(1): 2-3.
CHEN S X, QI G N, LI J H, XIA J B. Research progress in low caffeine content germplasm breeding of tea plants., 2009, 32(1): 2-3. (in Chinese)
[9] 吴华玲, 陈栋, 李家贤. 茶树咖啡碱代谢及低咖啡碱茶树育种研究进展. 热带作物学报, 2011, 32(9): 1780-1785.
WU H L, CHEN D, LI J X. Research progress in caffeine metabolism and low caffeine content germplasm breeding of tea plants ((L.) O. Kuntze)., 2011, 32(9): 1780-1785. (in Chinese)
[10] Negishi O, Ozawa T, Imagawa H. Conversion of xanthosine into caffeine in tea plants., 1985, 49(1): 251-253.
[11] Ashihara H, Sano H, Crozier A. Caffeine and related purine alkaloids: biosynthesis, catabolism, function and genetic engineering., 2008, 69(4): 841-856.
[12] Mohanpuria P, Kumar V, Yadav S K. Tea caffeine: metabolism, functions, and reduction strategies., 2010, 19(2): 275-287.
[13] Suzuki T. The participation ofadenosylmethionine in the biosynthesis of caffeine in the tea plants., 1972, 24(1): 18-20.
[14] Kato M, Mizuno K, Crozier A, Fujimura T, Ashihara H. Caffeine synthase gene from tea leaves., 2000, 406(6799): 956-957.
[15] Yoneyama N, Morimoto H, Ye C X, Ashihara H, Mizuno K, Kato M. Substrate specificity ofmethyltransferase involved in purine alkaloids synthesis is dependent upon one amino acid residue of the enzyme., 2006, 275(2): 125-135.
[16] 金基强, 周晨阳, 马春雷, 姚明哲, 马建强, 陈亮. 我国代表性茶树种质嘌呤生物碱的鉴定. 植物遗传资源学报, 2014, 15(2): 279-285.
JIN J Q, ZHOU C Y, MA C L, YAO M Z, MA J Q, CHEN L. Identification on purine alkaloids of representative tea germplasms in China., 2014, 15(2): 279-285. (in Chinese)
[17] JIN J Q, YAO M Z, MA C L, MA J Q, CHEN L. Natural allelic variations of TCS1 play a crucial role in caffeine biosynthesis of tea plant and its related species., 2016, 100(1): 18-26.
[18] Ogawa M, Herai Y, Koizumi N, Kusano T, Sano Hiroshi. 7-Methylxanthine methyltransferase of coffee plants. Gene isolation and enzymatic properties., 2001, 276(11): 8213-8218.
[19] Pichersky E, Lewinsohn E. Convergent evolution in plant specialized metabolism., 2011, 62(1): 549-566.
[20] XIA E H, ZHANG H B, SHENG J, Li K, ZHANG Q J, Kim C, Zhang Y, Liu Y, Zhu T, Li W, Huang H, Tong Y, Nan H, Shi C, Shi C, Jiang J J, Mao S Y, Jiao J Y, Zhang D, Zhao Y, Zhao Y J, Zhang L P, Liu Y L, Liu B Y, Yu Y, Shao S F, Ni D J, Eichler E E, Gao L Z. The tea tree genome provides insights into tea flavor and independent evolution of caffeine biosynthesis., 2017, 10(6): 866-877.
[21] Wei C, Yang H, Wang S, Zhao J, Liu C, Gao L, Xia E, Lu Y, Tai Y, She G, Sun J, Cao H, Tong W, Gao Q, Li Y, Deng W, Jiang X, Wang W, Chen Q, Zhang S, Li H, Wu J, Wang P, Li P, Shi C, Zheng F, Jian J, Huang B, Shan D, Shi M, Fang C, Yue Y, Li F, Li D, Wei S, Han B, Jiang C, Yin Y, Xia T, Zhang Z, Bennetzen J L, Zhao S, Wan X. Draft genome sequence ofvar.provides insights into the evolution of the tea genome and tea quality., 2018, 115(18): 4151-4158.
[22] 张宏达, 叶创兴, 张润梅, 马应丹, 曾沛. 中国发现新的茶树资源-可可茶. 中山大学学报, 1988(3): 131-133.
Zhang H D, Ye C X, Zhang R M, Ma Y D, Zeng Q. China discovers new tea resources, one cocoa tea (Chang)., 1988(3): 131-133. (in Chinese)
[23] Ashihara H, Kato M, Ye C X. Biosynthesis and metabolism of purine alkaloids in leaves of Cocoa tea ()., 1998, 111(4): 599-604.
[24] 杨晓绒.野生五柱茶和厚轴茶主要生化成分的研究[D].广州: 中山大学, 2005: 41-42.
Yang X R. Studies on the main biochemistry components of wildand[D]. Guangzhou: Sun Yat-sen University, 2005: 41-42. (in Chinese)
[25] 闵天禄, 李炳钧, 王春, 龙春林, 张文驹, 杨世雄, 李学东, 许秀坤. 一种富含茶碱的保健茶及其制备方法. 中国, 1145178A[P]. 1997-03-17.
Min T L, Li B J, Wang C, Long C L, Zhang W J, Yang S X, Li X D, Xu X K. Health-care tea rich in theophylline and preparation method thereof. China, 1145178A [P]. 1997-03-17. (in Chinese)
[26] 周卫龙, 徐建峰, 黄伙水, 刘相真, 陆小磊, 林锻炼, 王启灿. GB/T 8313-2018 茶叶中茶多酚与儿茶素含量的检测方法. 北京: 中国标准出版社, 2018.
Zhou W L, Xu J F, Huang H S, Liu Z X, Lu X L, Lin D L, Wang Q C. GB/T 8313-2018 Determination of total polyphenols and catechins content in tea. Beijing: China Standard Press, 2018. (in Chinese)
[27] Guex N, Peitsch M C. SWISS-MODEL and the Swiss-Pdb Viewer: An environment for comparative protein modeling., 1997, 18(15): 2714-2723.
[28] Zubieta C, Ross J R, Koscheski P, Yang Y, Pichersky E, Noel J P. Structural basis for substrate recognition in the salicylic acid carboxyl methyltransferase family., 2003, 15(8): 1704-1716.
[29] Ishida M, Kitao N, Mizuno K, Tanikawa N, Kato M.Occurrence of theobromine synthase genes in purine alkaloid-free species ofplants., 2009, 229(3): 559-568.
[30] 李萌萌. 茶树咖啡碱生物合成相关酶基因原核多基因表达载体的构建及其体外表达调控[D]. 合肥: 安徽农业大学, 2014.
Li M M. Construction of the multi-gene prokaryotic expression vector for tea caffeine biosynthesis and expression regulation[D]. Hefei: Anhui Agricultural University, 2014. (in Chinese)
[31] Jin J Q, Chai Y F, Liu Y F, Zhang J, Yao M Z, Chen L. Hongyacha, a naturally caffeine-free tea plant from Fujian, China., 2018, 66(43): 11311-11319.
[32] Denoeud F, Carretero-Paulet L, Dereeper A, Droc G, Guyot R, Pietrella M, Zheng C, Alberti A, Anthony F, Aprea G, Aury J M, Bento P, Bernard M, Bocs S, Campa C, Cenci A, Combes M C, Crouzillat D, Da Silva C, Daddiego L,. The coffee genome provides insight into the convergent evolution of caffeine biosynthesis., 2014, 345(6201): 1181-1185.
[33] 许勇泉, 尹军峰, 袁海波, 陈建新, 汪芳. 茶叶脱咖啡因技术研究进展. 茶叶科学, 2008, 28(1): 1-8.
Xu Y Q, Yin J F, Yuan H B, Chen J X, Wang F. A review on the technique of tea decaffeination., 2008, 28(1): 1-8. (in Chinese)
[34] 王雪敏, 姚明哲, 金基强, 马春雷, 陈亮. 低咖啡碱茶树遗传群体的咖啡碱含量与分子变异分析. 茶叶科学, 2012, 32(3): 276-282.
Wang X M, Yao M Z, Jin J Q, Ma C L, Chen L. Analysis of caffeine content and molecular variance of low-caffeine tea plants., 2012, 32(3): 276-282. (in Chinese)
(责任编辑 赵伶俐)
Screening, Cloning and Functional Research of the Rare Allelic Variation of Caffeine Synthase Gene () in Tea Plants
LIU YuFei1,2, JIN JiQiang1, YAO MingZhe1, CHEN Liang1
(1Tea Research Institute of the Chinese Academy of Agricultural Sciences/Key Laboratory of Tea Biology and Resource Utilization, Ministry of Agriculture and Rural Affairs, Hangzhou 310008;2Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081)
【Objective】Tea caffeine synthase 1 (TCS1), a key enzyme in the caffeine biosynthesis pathway, shows a wide range of allelic variation withinsect.germplasm. Discovery of the specific alleles ofas the genetic basis of natural variation in caffeine levels will increase the understanding of the mechanism of caffeine synthesis and accumulation, and provide new genetic resources for improving caffeine content in tea plant. 【Method】An unique PCR primer set, namely TCS1P InDel F/R, was used to detectalleles in 673 accessions of tea germplasm. The primer set (TCS1cDNAF/R) was used to clone the full-length cDNA sequence of novelallele, whose function was subsequently validated by bioinformatics quantitative real-time PCR (qRT-PCR) and prokaryotic expression analysis. 【Result】The novel rare allele,, was identified in the several germplasm of. Thesequence was obtained by using the accession ‘LL17’, which contained bothand. The CDS ofwas 1098 bp, encoding 365 amino acids with a calculated molecular weight of 40.9 kD and a theoretical isoelectric point 5.1. The sequence similarities betweenand,,,,e,ranged from 94.1% to 99.2%. The TCS1g showed a high level (>96%) of amino acid sequence identity with the alleles (and) which had only theobromine synthase (TS) activity, while it was slightly lower for other alleles (,,and) having both TS and caffeine synthase (CS) activity. The amino acid residue in position 221, located at the active center motif of TCS1, was histidine (His) in the TCS1g, as well as TCS1b and TCS1c, however it was arginine (Arg) for the others. The mutation (His to Arg) would change the isoelectric point and hydrophilicity from 5.05 to 5.06, and from -0.119 to -0.123, respectively. Meanwhile, the 5' upstream regulatory region of TCS1g, TCS1b and TCS1c was 15 bp longer than that of TCS1a, TCS1d, TCS1e and TCS1f. The results of prokaryotic expression analysis indicated that TCS1g had only TS activity (44.3 pkat/mg), and qRT-PCR analysis showed thewas expressed in the ‘LL17’. The contents of caffeine and theobromine in the ‘LL17’ were 40.3 mg·g-1and 5.4 mg·g-1, respectively. 【Conclusion】A novel rare allele of() was cloned, and the expression was detected in the ‘LL17’. TCS1g had TS activity, but no CS activity, which might be caused by the change of amino acid residue in position 221.
allelic variation; caffeine synthase; functional analysis; purine alkaloids; tea plant
10.3864/j.issn.0578-1752.2019.10.010
2018-12-04;
2019-02-25
国家自然科学基金(31670685)、国家茶叶产业技术体系(CARS-19)、中国农业科学院科技创新工程(CAASASTIP-2017-TRICAAS)
刘玉飞,Tel:18737616921;E-mail:chaye18@163.com。通信作者姚明哲,Tel:13588718222;E-mail:yaomz@tricaas.com。通信作者陈亮,Tel:13958093541;E-mail:liangchen@tricaas.com

