干旱高温互作下高山杜鹃幼苗生理生化变化研究
李小玲,韩 洁,侯 瑶,华智锐
(商洛学院 生物医药与食品工程学院,陕西 商洛 726000)
植物在其生长发育过程中常常遭受生物因子及各种非生物因子的胁迫,其中非生物因子是主要的危害因素。近年来,频繁的人类活动排放了大量的温室气体,致使全球气温不断上升,随着全球气候变暖,极端天气的频繁发生,如局部地区的异常干旱、高温等已成为影响植物生长发育的重要环境因子。研究发现,在干旱、高温互作下,植物体内积累大量的有害物质,如活性氧,引起膜质过氧化作用,抑制植物的光合作用,降低植物体内水分利用效率,最终导致植物生长发育受阻和形态发生变化。为了抵御干旱高温对植物体的伤害,植物通过自身保护机制以降低逆境对其造成的伤害[1]。干旱、高温不仅影响植物的生理生态过程,还成为限制植物的分布、生长和生产力的重要生态因子[2]。
杜鹃花是杜鹃花属(Rhododendron)植物的统称,属于世界三大高山野生花卉之一,具有极高的观赏及园林应用价值[3]。据调查,世界杜鹃花属植物约有967种,我国作为世界杜鹃花资源最为丰富的地区,分布有原生种571种,其中特有种约409种,占国有种的71.6%[4]。而秦岭地区的野生杜鹃花属植物共有28种,占我国杜鹃花种类的5.1%[5]。秦岭是我国杜鹃花分布的重要区域之一,且单种蕴藏量较大,耐寒性较强。秦岭野生的杜鹃花植物作为西北地区急需开发的野生资源之一,其花朵鲜艳、枝叶繁茂,且能药食两用,具有极高的观赏价值和开发利用价值[5]。杜鹃花属植物常丛生为密不可分的灌木林,因其密集的枝条、发达的根系,在耐受极端的高山气候环境、保持高山土壤、防止山体滑坡等方面起到作用,著称优良的山地水土保持植物[6]。地处商洛市镇安县的国家木王林场中分布有秀雅杜鹃(R.concinnum)、美容杜鹃(R.calophytum)、头花杜鹃(R.capitatum)、照山白(R.micranthum)等,其中美容杜鹃的数量最多并且分布面积最广[7]。杜鹃花生态习性为喜冷凉、多雾、湿润气候,忌高温干旱,较耐阴,光照过强常引起植株失水、叶片黄化,甚至造成日灼;光照不足影响光合作用和开花结果数量。故此,开展高山杜鹃干旱高温互作机理的研究能为杜鹃的引种栽培提供理论参考。
目前对高山杜鹃抗逆性方面的研究大多集中于耐寒或耐高温等单一逆境因子方面[8-11],而对于干旱高温双重胁迫研究尚未见报道。鉴于此,本研究以秦岭高山杜鹃为材料,探讨其在干旱高温互作下的生长表现及叶片相应生理生化指标的变化,从理论上揭示高山杜鹃对高温胁迫的生理生态适应机制,丰富杜鹃花的生理研究内容,并通过对干旱高温互作下生理生化指标响应的研究及主因子的分析,为耐干旱高温种质的遗传改良和人工引种栽培提供理论依据。
1 材料和方法
1.1 试验材料试验所用高山杜鹃幼苗于2017年3月上旬采自商洛市镇安县国家木王林场海拔1500 m左右的杜鹃花景区。
1.2 试验方法
1.2.1 杜鹃幼苗的预培养 将采集的大小一致、生长状态良好的两年生高山杜鹃实生苗移栽到直径20 cm的花盆中,每盆栽两株,培养基质为腐叶土∶松针土=1∶2,每天傍晚适时喷洒0.1%~0.5%的硫酸亚铁保持70%~80%的相对湿润,在人工气候箱中25~27 ℃培养1周。
1.2.2 试验设计 配制浓度为10%、15%、20%聚乙二醇(PEG-6000)溶液,设轻度干旱胁迫 (10% PEG)、中度干旱胁迫 (15% PEG)、重度干旱胁迫 (20% PEG)处理。在人工气候箱中进行温度处理。空气相对湿度为75%,光照时间为12 h/d,光照强度为3级;设 25 ℃(对照)、33 ℃(轻度高温胁迫)、40 ℃(重度高温胁迫)3个温度梯度。干旱与温度交叉结合对高山杜鹃幼苗进行胁迫处理(表1),每天下午18:00对高山杜鹃幼苗叶片喷洒PEG-6000进行干旱胁迫,以室温栽培和喷洒蒸馏水的植物为对照(CK)。每处理3次重复,每次重复3株苗。处理后隔天采样,立即剪下适宜的叶片,洗净,用蒸馏水冲洗,除去叶脉后剪碎,用于测定MDA含量、脯氨酸含量、可溶性蛋白含量等生理指标。

表1 干旱高温互作试验设计
1.2.3 生理指标的测定脯氨酸含量的测定参照李小方[12]的茚三酮法,相对电导率的测定参照陈建勋等[13]的浸泡法,MDA含量的测定参照张志良等[14]的硫代巴比妥酸法,SOD活性的测定参照李合生[15]的氮蓝四唑(NBT)光还原法,POD活性的测定参照郝再彬等[16]的愈创木酚显色法,CAT活性的测定参照高俊风等[17]的紫外光谱法,可溶性蛋白含量的测定参照高俊风等[17]的考马斯亮蓝G-250法。
1.3 数据处理
所有处理每次重复测定3次,数据为3次测定值的平均值,用Excel 2010进行数据统计,用SPSS 17.0软件进行数据分析。
2 结果与分析
2.1 干旱高温互作对高山杜鹃幼苗脯氨酸含量的影响
由图1可知,与对照组相比,干旱高温互作下各处理组的脯氨酸含量随胁迫时间的延长而持续升高,但是各处理组的脯氨酸含量有明显差异。与CK相比,T1、T2、T3的脯氨酸含量变化不显著(P>0.05);而在其它浓度的处理下脯氨酸含量有显著性差异(P<0.05),脯氨酸含量随着胁迫时间的延长呈现逐渐增大的趋势。其中在40 ℃高温下,用20%的PEG处理下影响最大,其脯氨酸含量平均高达对照组的283.3%。
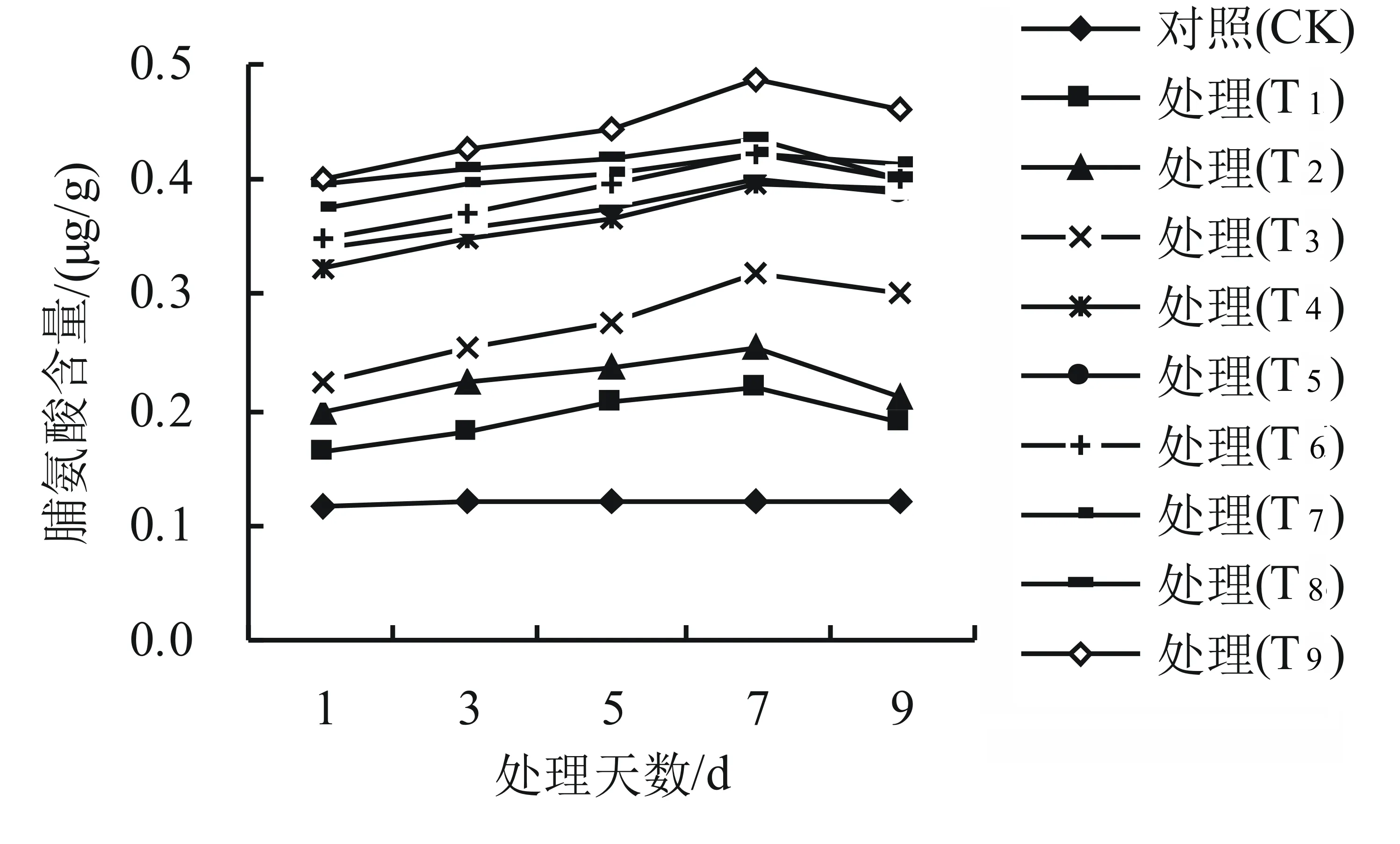
图1 干旱高温互作对高山杜鹃幼苗脯氨酸含量的影响
2.2 干旱高温互作对高山杜鹃幼苗相对电导率的影响
相对电导率是衡量细胞膜透性的重要指标。由图2可以看出,对照组的相对电导率变化不显著;随着干旱高温胁迫时间的延长,各处理的相对电导率均有较大幅度的增加。对照组叶片的相对电导率为31.5%,在胁迫处理9 d后,各处理的相对电导率分别比对照组增加了96.2%、99.4%、108.9%、109.5%、120.0%、131.4%、134.3%、145.1%、163.8%。相对电导率的值越大,电解质的渗漏量越多,细胞膜受害程度越重。
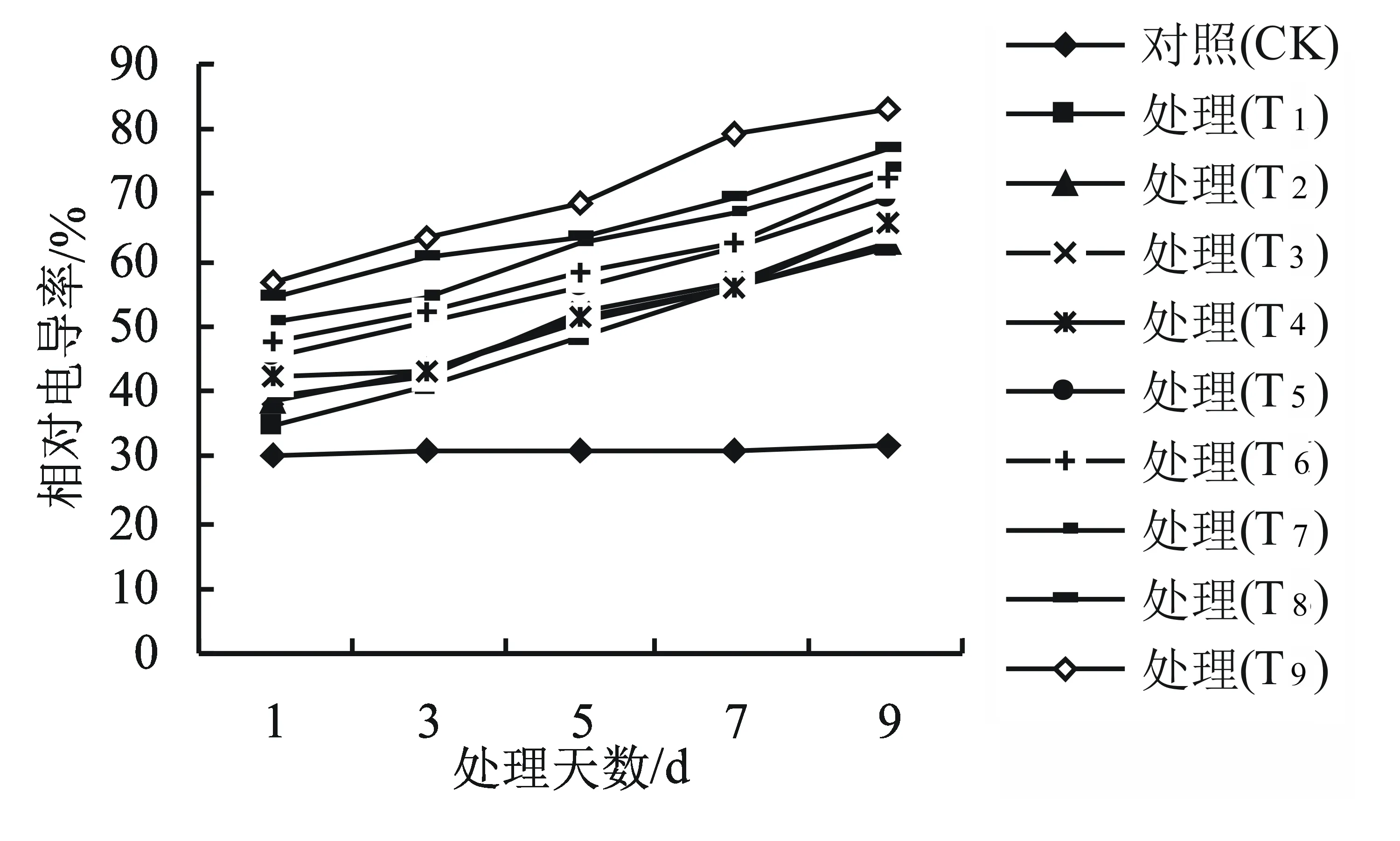
图2 干旱高温互作对高山杜鹃幼苗相对电导率的影响
2.3 干旱高温互作对高山杜鹃幼苗POD、SOD和CAT活性的影响
由图3可知,与对照组相比,SOD的活性呈先升后降的趋势,SOD活性在第7天时达到最大以后逐渐下降,T1、T2处理的SOD活性变化不显著(P>0.05);而T6处理的SOD活性差异最为显著(P<0.05),与对照组相比增加了15.4%,说明干旱高温互作显著影响了杜鹃叶片SOD的活性。由图4、图5可知,干旱高温互作下高山杜鹃的POD和CAT活性均随着胁迫天数的增加呈上升趋势,T1、T2、T3处理的POD活性变化不显著(P>0.05),而T9处理的POD活性差异最为显著(P<0.05),比对照组增长了71.9%。T1、T2处理的CAT活性变化不显著(P>0.05), 而T9处理的CAT活性差异最为显著(P<0.05),比对照组增长了22.9%,说明胁迫程度越大,杜鹃叶片的POD、CAT活性也逐渐增大以达到减少干旱高温伤害的保护目的。

图3 干旱高温互作对高山杜鹃幼苗SOD活性的影响
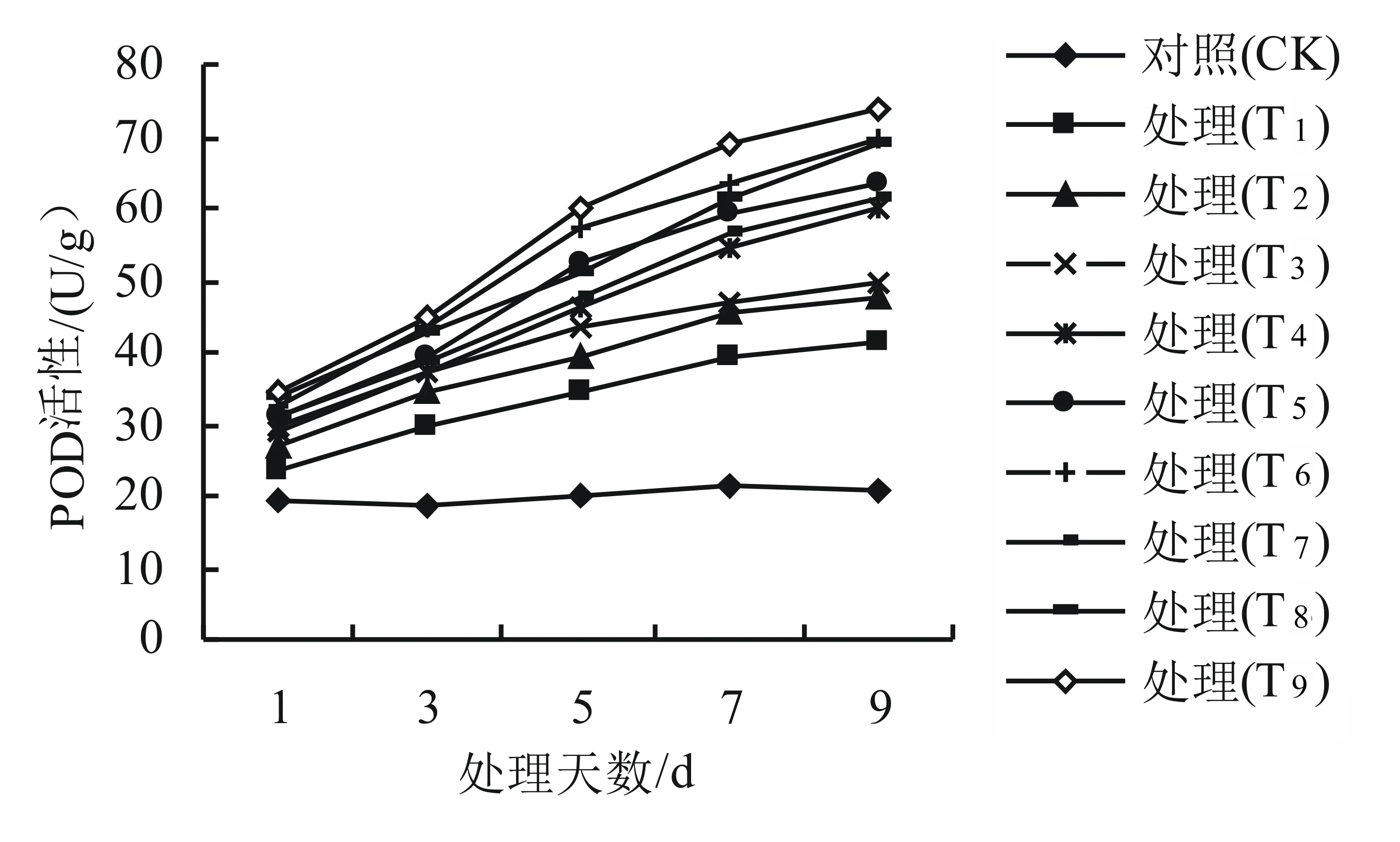
图4 干旱高温互作对高山杜鹃幼苗POD活性的影响
2.4 干旱高温互作对高山杜鹃幼苗MDA含量的影响
由图6可知,与对照组的MDA含量相比,干旱高温互作下各处理组的MDA含量随胁迫时间的延长而持续升高,但是各处理组的MDA含量有明显差异。T1、T2处理的MDA含量变化不显著(P>0.05);而T9处理的MDA含量差异最为显著(P<0.05),与对照组相比增加了178.1%。丙二醛含量随着胁迫时间的延长而升高,说明高温干旱互作下细胞质膜发生了过氧化作用,引起质膜正常的生理功能发生紊乱。

图5 干旱高温互作对高山杜鹃幼苗CAT活性的影响

图6 干旱高温互作对高山杜鹃幼苗MDA含量的影响
2.5 干旱高温互作对高山杜鹃幼苗可溶性蛋白含量的影响
可溶性蛋白质是植物体内的重要渗透调节物质。由图7可知,对照组的可溶性蛋白含量相对稳定,而在干旱高温互作下高山杜鹃叶片中可溶性蛋白含量随着胁迫时间的延长均呈上升趋势。T1、T2处理下可溶性蛋白含量与对照组相比无显著性差异(P>0.05);处理T9与对照组相比存在显著性差异(P<0.05),增加了28.8%。说明在抗逆境中可溶性蛋白不仅能够维持细胞的膨压,而且能够起到抵御或减轻干旱、高温伤害等作用。

图7 干旱高温互作对高山杜鹃幼苗可溶性蛋白含量的影响
3 讨论
植物受到非生物胁迫时,体内常通过自身的防御网络来调控相关的代谢途径。脯氨酸不仅是细胞内最重要的渗透调节物质,而且是一种水溶性极强的氨基酸,具有较强的水合能力;此外,还可以增加蛋白质的可溶性和减少可溶性蛋白质的沉淀,保持膜结构的完整性[18]。脯氨酸能有效帮助植物细胞组织持水和防止脱水,同时具有解氨毒和保护膜完整性的作用。干旱胁迫时脯氨酸的积累最为明显,其含量可以比正常条件下增加几十到几百倍[19-20]。本研究中,各处理组脯氨酸含量随着胁迫时间的延长呈上升趋势,在T9处理下高山杜鹃脯氨酸含量增长幅度最大。植物体内脯氨酸含量的多少在一定程度上与植物的抗逆性呈正相关,抗性强的品种往往积累的脯氨酸较多。因此脯氨酸含量可以作为衡量植物的抗逆性强弱的生理指标。
植物相对电导率是反映植物细胞膜透性的一项基本指标。在本试验中,对照组叶片的相对膜透性没有明显的变化,而干旱高温互作处理下的相对电导率变化显著,随着胁迫时间的延长均呈上升趋势,但存在一定的差异,其中T9增长幅度最大。因此,植物在受到干旱高温互作的情况下细胞膜容易被破坏,导致胞质的胞液外渗而使相对电导率增大。
在逆境胁迫下,植物体内活性氧的产生与清除平衡被打破,导致植物体在生命过程中活性氧不断积累。SOD、POD和CAT是植物体内3种重要的保护酶。SOD是植物活性氧代谢的关键酶,而POD和CAT这2种酶反映了植物生理生化代谢及生长发育情况,也可作为植物抗性强弱的标志[21]。普遍认为,在逆境胁迫下,植物的 SOD、POD和CAT活性都会有一定提高[22-23]。SOD活性受超氧阴离子自由基(O2-)的诱导,歧化O2-为H2O2和O2,而CAT和POD则进一步将H2O2催化生成H2O,从而减少O2-和H2O2的积累[24]。
在本研究中,干旱高温互作下高山杜鹃的POD、CAT活性均随着胁迫时间延长呈上升趋势,其中POD、CAT活性均在T9处理下增长幅度最大;而SOD的活性随着胁迫时间延长呈现出先升后降的趋势,其中在第7天时达到最大后逐渐下降,这与庞新华等[10]的研究结果一致。SOD的活性呈现这一趋势,可认为,尽管SOD 可清除 O2-,减轻膜脂过氧化对细胞内其他部位的伤害,但这种保护作用是有限的;到干旱高温胁迫后期,当胁迫压力超过植物所能承受的极限时,干旱高温会破坏酶的活性中心,通过改变酶的结构或抑制酶的表达,使得酶活性下降。王丽娟等[25]在对逆境胁迫下桃叶杜鹃幼苗的生理生化研究中却发现SOD活性持续上升。这一现象可能与不同实验研究中材料、方法或处理时间的不同或不同类型杜鹃对高温胁迫的反应不同有关,具体原因还有待深究。
MDA是膜脂过氧化作用的产物之一,其含量高低被作为活性氧伤害的重要指标。在本试验中,干旱高温互作下高山杜鹃幼苗的MDA含量显著增加,其中处理T1、T2的MDA含量增长幅度不明显,T9处理的MDA含量增长幅度最大,高山杜鹃MDA含量随胁迫时间的延长而增加的这一现象与对其它杜鹃花属植物的研究结果相吻合[10],说明干旱高温互作下胁迫程度的加深,致使抗氧化系统被破坏,植物体内的活性氧大量积累,导致了膜脂的过氧化,对细胞膜造成了严重的伤害。因此,MDA可被作为检测膜损伤程度、膜脂过氧化程度和植物对逆境条件反应强弱的指标。
可溶性蛋白质是细胞内的重要渗透调节物质,对维护细胞膜结构的稳定具有重要作用。高含量的可溶性蛋白质可使细胞维持较低的渗透势,抵抗水分胁迫带来的伤害。本研究结果表明,随胁迫时间的延长,可溶性蛋白质的含量呈上升趋势,其中T1处理的可溶性蛋白质含量增长幅度不明显,T9处理的可溶性蛋白质含量增长幅度最大。因此,可溶性蛋白不仅能够维持细胞的膨压,而且能够起到抵御或减轻干旱、高温伤害等作用。
综合各项指标表明,干旱高温胁迫处理程度越深,对秦岭高山杜鹃的伤害越大,植物越容易死亡。因此,秦岭高山杜鹃幼苗适宜在25 ℃左右的温度下和没有干旱胁迫的环境下生长,33 ℃和不同浓度的PEG干旱处理会导致植物生长受到抑制,但具有一定抗性;40 ℃和不同浓度的PEG干旱处理会导致植物生长受到严重影响。因此,将高山杜鹃引种栽培到夏季最高温度不超过25 ℃左右的地区是可行的,但随着近年来夏季温度的不断上升,通过什么方法让杜鹃在炎热的城市引种成功还需要进一步研究。

