OPN对低氧诱导的SD大鼠肺动脉平滑肌细胞自噬及增殖能力的影响*
鲍 金,刘川川,陈辛玲,刘辉琦,刘 杰,曹学锋,王生兰&
(1.青海大学医学院;2.青海大学高原医学研究中心;3.青海大学附属医院)
低氧性肺动脉高压(Hypoxic pulmonary hypertension,HPH)是长期受慢性低氧等刺激而引起的一系列红细胞增多、内皮细胞损伤、炎症等病理改变,最终导致肺血管重塑的病理过程。低氧刺激会使机体血管活性物质分泌失衡,导致肺血管平滑肌细胞(Pulmonary artery smooth muscle cells,PASMCs)异常增殖。HPH发生的机制复杂,但HPH动物模型中都存在明显的PASMCs细胞增殖和肥大[1-3],因而调控PASMCs的细胞增殖成为HPH研究和药物开发的靶点[4-8]。
骨桥蛋白(osteopontin,OPN)是一种分泌型糖基化磷蛋白,广泛分布在多种组织和细胞中,在动脉粥样硬化、心肌肥大、心力衰竭、肺动脉高压等心血管疾病的发展中,OPN都起着至关重要的作用[9-11]。OPN作为一种信号转导分子,它可以通过与整合素结合或与CD44结合来干扰细胞增殖、迁移、自噬等过程。自噬(Autophagy)作为机体维持稳态的重要机制,主要通过溶酶体介导、回收利用细胞本身的蛋白质或细胞器[12]维持细胞自稳态。OPN对自噬的调控是双向的:OPN可正向调控自噬增长[13-15],也可负向调控自噬发生[16-18]。OPN是血管平滑肌细胞的细胞表型转换的标志蛋白[19],对HPH血管重塑意义重大。有研究发现OPN可以通过CD44和p38MAPK通路来调节自噬从而影响平滑肌细胞功能[20]。但在低氧情况下,OPN是否参与调控肺血管平滑肌细胞自噬未见报道。本课题拟通过低氧干预和RNA干扰、过表达技术,探讨OPN在低氧下是否能够调控PASMCs的自噬发生,为预防肺源性心脏病及其肺动脉高压提供理论支撑。
1 材料与方法
1.1 材料与仪器
原代培养的大鼠肺动脉平滑肌细胞(PASMCs,课题组冻存品)。α-SMA抗体(武汉博士德公司,中国),OPN抗体(Abcam公司,美国),Beclin、LC3B一抗、辣根酶标记山羊抗兔二抗(ABclonal公司,中国),胎牛血清、DMEM/F12培养基、BCA蛋白定量试剂盒、蛋白Marker、细胞周期检测试剂盒(赛默飞公司,中国),PVDF膜(Millipore公司,美国),EdU检测试剂盒、SDS-PAGE凝胶制备试剂盒(碧云天公司,中国),OPN过表达及干扰慢病毒(赛业生物,中国)。超净工作台、培养箱(赛默飞公司,中国),流式细胞仪(艾森公司,美国),倒置显微镜(Olympus公司,日本),全波长酶标仪(Tecan公司,瑞士),蛋白质电泳仪、电转仪(Bio-Rad公司,美国),离心机(Eppendorf公司,德国)。
1.2 实验方法
1.2.1 PASMCs培养
将冻存PASMCs置于37 ℃水浴锅迅速溶解,离心弃上清液,加入含20%FBS的完全培养基,置于培养箱(37℃,3%CO2)培养,每隔3 d换液。待细胞生长至90%融合时,以0.25%胰酶(含0.001% EDTA)消化传代培养。将3~7代细胞用于实验。
1.2.2 PASMCs鉴定
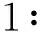
1.2.3 实验分组
细胞分为6组:常氧对照组(Normoxic)、低氧对照组(Hypoxia)、低氧+OPN干扰空病毒组(H+OPN EV)、低氧+OPN干扰慢病毒组(H+OPN shRNA)、低氧+OPN过表达空病毒组(H+OPN OEV)、低氧+OPN过表达慢病毒组(H+OPN shoRNA)。
1.2.4 细胞转染
将处于对数期PASMCs(3×106个)接种传代于35 mm培养皿中,待细胞长到合适浓度时进行细胞转染(干扰序列见表1)。将病毒悬液稀释为1×108TU/mL,转染滴度定为1×107TU/mL。常氧对照组加无血清DMEM/F12培养基;低氧对照组加无血清DMEM/F12培养基;低氧+OPN干扰空病毒组加OPN空病毒;低氧+OPN干扰病毒组加OPN干扰慢病毒;低氧+OPN过表达空病毒组加OPN过表达空病毒;低氧+OPN过表达病毒组加OPN过表达慢病毒。转染12 h时更换培养液,12 h后置于相应培养箱(常氧浓度21%,低氧浓度3%)处理48 h,收集细胞用于后续实验。
表1 OPN慢病毒干扰序列Table 1 OPN lentivirus interference sequence
1.2.5 细胞增殖检测
采用EdU法来评估细胞增殖能力。实验前将细胞(约1×104个)分别接种于24孔板,细胞贴壁后,转染相应OPN处理试剂,继续培养24 h后,置于低氧培养箱(3%)处理48 h后移除原培养基,将200 μL包含EdU的新鲜DMEM培养基加入孔中。培养1 h后,移除EdU培养基,用4%多聚甲醛固定细胞20 min后将细胞用含有3%BSA的PBS洗涤两次,每次5 min。将0.3%Triton X-100浸润(室温)15 min,然后用Click反应液在室温下避光染色30 min,用Hoechst33342染色15 min。最后,使用Zessis荧光显微镜观察并拍照分析。
1.2.6 细胞周期检测
将细胞(约1×106个)接种于35 mm培养皿,孵育过夜后,再转染相应OPN处理试剂,继续培养24 h,用无FBS的DMEM培养基饥饿处理细胞16 h后,将细胞置于低氧培养箱(3%)处理48 h。收集细胞,用70%冰乙醇在4 ℃下固定12 h。离心除去乙醇,用PBS洗涤细胞两次后染色。细胞在碘化丙啶溶液中重悬,于室温下避光孵育20 min。使用流式细胞仪分析样本。利用Novo Express软件对采集到的数据进行分析。
1.2.7 Western blot 检测
1.3 统计学方法
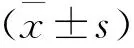
2 结果
2.1 PASMCs的免疫学鉴定
α-SMA免疫组化结果显示,超过95%的细胞均能表达α-SMA(图1)。细胞呈梭形,胞内肌丝明显,鉴定所培养的细胞为平滑肌细胞。
2.2 调控OPN对PASMCs细胞增殖的影响
用EdU法评估干扰或过表达OPN后低氧刺激对PASMCs细胞增殖的影响,结果显示:低氧干预能促进细胞增殖(P<0.05);与低氧对照组相比,干扰OPN表达后其增殖能力减低(P<0.05);而在OPN过表达后细胞增殖能力未发生明显改变(P>0.05)(表2)。
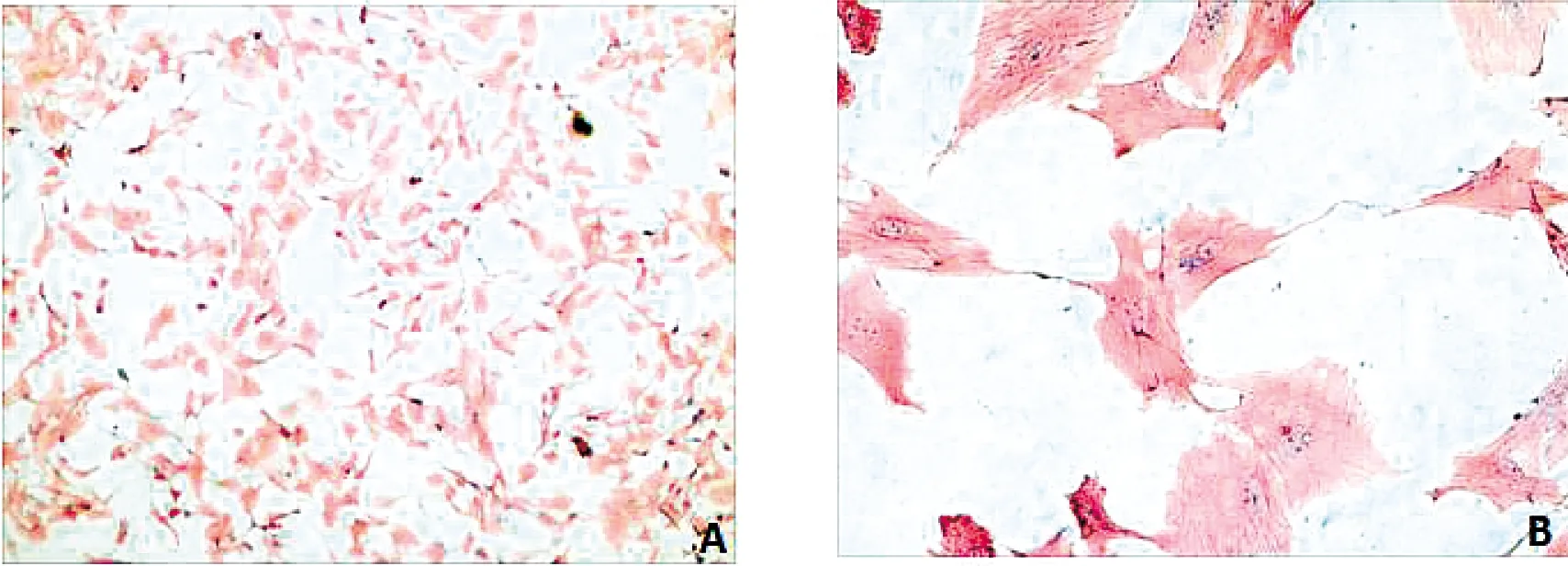
图1 α-SMA免疫组织化学染色鉴定图(A 100×,B 400×)Figure 1 α-SMA immunohistochemical staining(A 100×,B 400×)
表2 调控OPN对细胞增殖的影响Table 2 The effect of OPN on cell
* :与Normoxic组相比,P<0.05;#:与Hypoxia组相比,P<0.05
2.3 调控OPN对PASMCs细胞周期的影响
采用流式细胞术检测干扰或过表达OPN后PASMCs的细胞周期,结果显示:与常氧组相比,低氧能促进细胞周期进入S期(P<0.05);与低氧组相比,OPN被慢病毒干扰后细胞周期阻滞于G0/G1期(P<0.05);而OPN过表达后细胞周期无明显变化(P>0.05)(图2,表3)。

图2 调控OPN对PASMCs细胞周期影响图Figure 2 The effect of OPN on the cell cycle of PASMCs
表3 调控OPN对PASMCs细胞周期的影响结果Table 3 The effect of OPN on the cell cycle of
* :与Normoxic组相比,P<0.05;#:与Hypoxia组相比,P<0.05
2.4 低氧对PASMCs自噬的影响
为探讨低氧对PASMCs自噬的影响,采用Western Blot法检测相关自噬蛋白表达,结果显示:低氧处理后,能明显增加OPN表达(P<0.05),自噬相关蛋白Beclin、LC3B表达也增加(P<0.05)(图3,表4)。

图3 低氧对PASMCs自噬蛋白表达影响图Figure 3 Effect of hypoxia on the expression of PASMCs autophagy protein
表4 低氧对PASMCs自噬蛋白表达的影响Table 4 Effect of hypoxia on the expression of PASMCs autophagy
2.5 调控OPN对PASMCs自噬的影响
为探讨低氧下OPN干扰或过表达后对PASMCs自噬的影响,采用Western Blot法检测自噬相关蛋白表达,结果显示:与低氧组相比,低氧下OPN被慢病毒干扰后OPN表达明显降低(P<0.05),并引起自噬蛋白Beclin1、LC3B表达增加(P<0.05)(图4,表5);而在OPN过表达后OPN表达明显增加(P<0.05),并引起自噬蛋白Beclin、LC3B表达减少(P<0.05)(图5,表6)。

图4 干扰OPN对低氧下PASMCs自噬蛋白表达的影响图Figure 4 Effect of OPN interference on the expression of autophagy protein in PASMCs under hypoxia
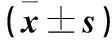
表5 干扰OPN对低氧下PASMCs自噬蛋白表达的影响Table 5 Effect of OPN interference on the expression of autophagy protein in PASMCs under
* :与Hypoxia组相比,P<0.05
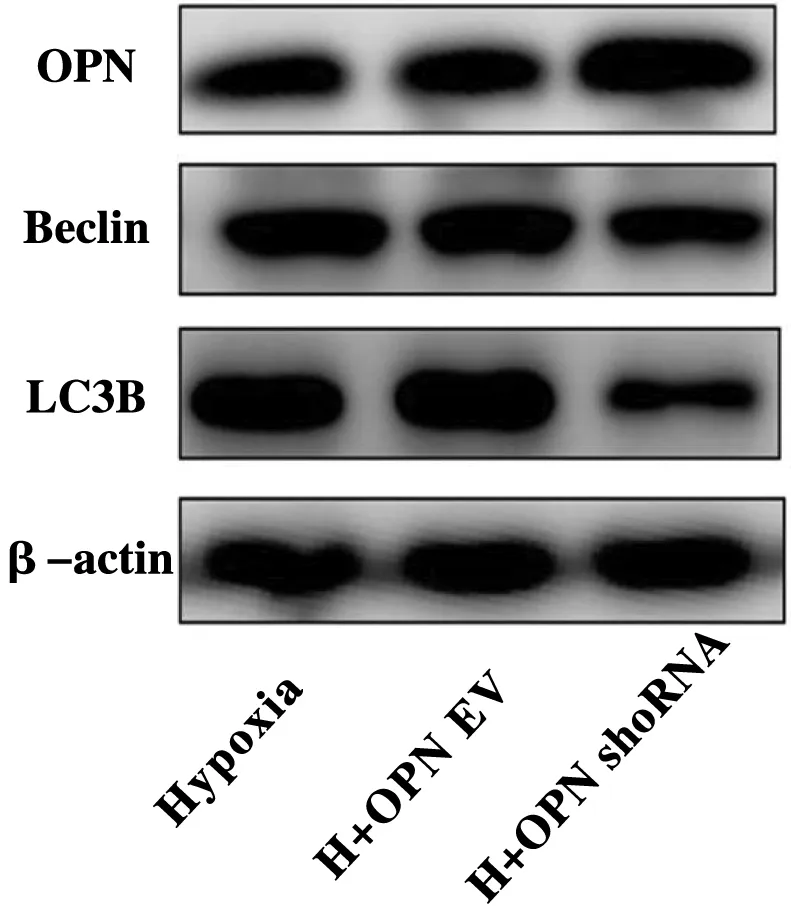
图5 过表达OPN对低氧下PASMCs自噬蛋白表达的影响图
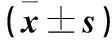
表6 过表达OPN对低氧下PASMCs自噬蛋白表达的影响结果Table 6 Effect of OPN overexpression on the expression of PASMCs autophagy protein under
* :与Hypoxia组相比,P<0.05
3 讨论
HPH是肺动脉高压(Pulmonary hypertens,PH)的一种常见类型,是低氧刺激导致的肺动脉压力增高,并伴有相应结构改变。短时间急性缺氧引起肺血管收缩,长时间慢性缺氧可导致肺血管重塑[21]。而PASMCs细胞增殖在驱动肺动脉高压血管重塑[22]发生中有着至关重要的作用。低氧涉及广泛的细胞反应,如细胞增殖、炎症等。低氧促进PASMCs增殖,此与我们的研究结果一致。但低氧引起PASMCs细胞增殖的机制不明,Zhu B等人发现MEG3可调控miR-21/PTEN通路来影响PASMCs细胞的增殖[23]。Jihui Lee 等证明miRNA可通过介导CKI来影响低氧引起的血管平滑肌的增殖(Vascular smooth muscle cells,VSMCs)[24],Gu Q等人研究表明低氧下PASMCs的细胞增殖可能与干细胞因子相关[25],但低氧到底如何促进PASMCs的细胞增殖,其具体机制还有待进一步研究。
OPN作为一种广泛存在于各种细胞中带负电的磷酸化糖蛋白[26-27],与心血管疾病、糖尿病和肿瘤密切相关[28]。OPN可以调控细胞的增殖、迁移、侵袭、凋亡和自噬过程[16]。OPN的表达被认为是VSMCs由收缩表型向合成表型转变的标志之一[29]。本研究发现低氧可促进OPN的表达,该结果与其他学者的结果不谋而合[30-31]。通过OPN特异性慢病毒感染OPN表达后,在低氧下能抑制PASMCs的细胞增殖,并将细胞周期阻滞于G0/G1期,此与其他学者的研究结果相一致[32-33]。但在OPN被过表达病毒转染后,PASMCs在低氧下的增殖并未进一步增加,细胞周期检测结果也与低氧下无差异,这可能是OPN与低氧通过参与相似的机制对PASMCs的增殖起促进作用。结果表明,OPN参与了低氧性肺动脉高压血管重塑的形成。
自噬作为机体一种保守的“自我吞噬”,自噬过程中细胞质组分被降解并循环利用以维持细胞稳态[34-36]。在哺乳动物中,LC3存在LC3A、LC3B和LC3C等三种亚型,但目前研究最广的还是LC3B,不少研究都将其视为自噬的关键基因,它与自噬体的成熟相关,是监测自噬活性的重要蛋白。Beclin是反映自噬活性的重要基因,参与自噬调控。这两者能很好地反映自噬的活性。OPN可以通过调控细胞自噬参与许多疾病的发生。在蛛网膜下腔出血中,OPN可增强自噬、减少凋亡[37],减轻早期脑损伤;在结直肠癌中,OPN对自噬和凋亡都起到抑制作用[16]。由此可见OPN在调控自噬过程中表现出双向作用:既可抑制自噬,也可促进自噬的发生。OPN调控自噬的机制复杂,可能与p38MAPK信号通路有关[16];也与通过跟细胞表面的不同受体结合,诱导多种基因和信号通道蛋白的表达[38-40]有关;还可与CD44结合有关[20]。本实验对自噬的研究发现,单纯低氧干预下自噬相关蛋白Beclin1、LC3B表达增加,表明低氧刺激本身会引起自噬的发生,此与其他学者的研究结论一致[41-43]。而在低氧情况下使用OPN特异性干扰慢病毒降低OPN表达后,能促进自噬相关蛋白Beclin1、LC3B的表达;相反,在使用OPN过表达慢病毒后,其抑制了自噬相关蛋白Beclin1、LC3B的表达。由此推断,OPN对低氧下PASMCs的自噬过程有抑制作用,与其他学者的研究结论一致[16-18]。OPN调控低氧诱导的细胞自噬并影响细胞增殖的分子机制未完全阐明。有研究表明,低氧刺激下能促进组织血管新生[44];而在缺乏自噬蛋白Beclin1的小鼠表现出与低氧有关的促血管生成表型[45];在缺氧培养的人肺血管细胞中,自噬激活抑制了这些血管细胞的低氧增殖[46]。本研究中,低氧情况下使用OPN特异性干扰慢病毒减低OPN表达后,能减弱PASMCs细胞增殖,增强自噬相关蛋白Beclin1、LC3B表达。推断OPN的增强可抑制自噬的激活,从而增强PASMCs细胞增殖能力。
因此,我们证实低氧本身能促进PASMCs增殖,并诱发自噬的发生;同时OPN参与了低氧下肺动脉平滑肌细胞的自噬过程。OPN表达增加可能以直接或间接方式抑制PASMCs自噬发生,共同促进PASMCs增殖。OPN可能是调控低氧性肺动脉高压肺血管重塑的药物靶标。但OPN调控低氧诱导的PASMCs自噬的分子机制还有待进一步研究。

