泛素E3连接酶对多发性骨髓瘤细胞增殖、克隆形成能力的影响
纪 超,马炬雷,舒 鹏
宁波市北仑区人民医院 浙江大学附属第一医院北仑分院 1检验科 2手足外科 3分子实验室,浙江宁波 315800
多发性骨髓瘤(multiple myeloma,MM)是骨髓中浆细胞异常增生的一种恶性肿瘤,属于成熟B细胞肿瘤,其特征是单克隆浆细胞过度增生(超长增生),并产生单克隆免疫球蛋白,骨髓中单克隆浆细胞的异常增生及侵犯骨髓,引起骨骼破坏、骨痛或骨折、贫血、高钙血症、肾功能不全及免疫功能异常。MM的预后极差,复发率极高,被认为是一种不可治愈的疾病[1]。MM依赖的信号通路十分复杂,其中重要的信号通路为核因子-κB(nuclear factor-κB,NF-κB)通路,在MM中有50%~70%患者存在NF-kB信号通路的持续异常激活[2],同时NF-κB通路的抑制与MM细胞活性密切相关[3],因此运用靶向治疗药物硼替佐米抑制NF-κB通路能够收到很好的效果,但随着靶向治疗药物不断地运用于治疗,肿瘤的耐药以及肿瘤的复发成为亟待解决的问题[4],MM的耐药中,泛素化通路至关重要,泛素是存在于细胞中的一种小分子,泛素分子能够通过泛素激活酶E1、泛素结合酶E2和泛素连接酶E3等一系列酶的催化从而结合到靶蛋白,同时泛素的解离主要通过去泛素化酶完成[5],泛素与靶蛋白的结合最早被认为通过泛素-蛋白酶体途径降解靶蛋白,随着研究的深入,泛素被认为是一种重要的翻译后修饰方式,参与了蛋白的定位、细胞周期等过程[6],泛素化通路对于MM耐药的研究主要集中于泛素连接酶E3与去泛素化酶,其中泛素连接酶E3 Pirh2可通过c-myc、p53参与硼替佐米诱导的细胞增殖、凋亡和周期调控[7],去泛素化酶USP7抑制剂则已投入到临床的使用中,泛素E3连接酶(denticleless E3 ubiquitin protein ligase,DTL)则属于泛素连接酶E3的一种[8],其在MM中的表达研究较少。本研究主要阐述DTL在多发性骨髓瘤患者中的表达及其相应的生物学意义,并简要探讨其相关机制。
材料和方法
材料1640基础培养基(货号:11875127)与胎牛血清(货号:11573397)购自美国Gibco公司,人淋巴细胞分离液购自天津灝洋生物技术有限公司(货号:LTS1077N),CD138+细胞磁珠分选试剂盒购自美国Stem cell公司(货号:18000),人MM细胞系RPMI8226购自北京协和细胞库,对照(control,CON)组与DTL敲低(DTL-short hairpin RNA,DTL-shRNA)组慢病毒载体购自美国Sigma公司,CCK8细胞增殖检测试剂盒购自日本同仁化学研究所(货号:CK04),甲基纤维素粉末购自美国Sigma公司(货号:M0512),实时定量PCR引物由北京奥克鼎盛公司合成,DTL一抗购自美国赛默飞公司(货号:PA5- 42842),P65(货号:8242)、磷酸化P65(货号:3033)、抑制因子κBα(inhibitory subunit-κBα,IκBα)(货号:5209)、磷酸化IκBα(货号:2859)、GAPDH(货号:5174)、β-actin(货号:3700)一抗均购自美国Cell Signal Technology,相应二抗均购自北京中杉金桥公司,所有一抗二抗均为单抗,ECL发光液购自美国赛默飞司(货号:NCI5080),膜联蛋白 V别藻蓝素/碘化丙啶双染试剂盒购自天津三箭生物公司(货号:AO2001- 11P-G),细胞周期中高浓度碘化丙啶染料购自美国Sigma公司(货号:P4170),核蛋白提取试剂盒购自上海生工生物工程股份有限公司(货号:C500009),NF-κB与有机阳离子转运蛋白- 1对照生物素标记探针购自碧云天公司,序列为NF-κB 正向:5’-AGTTGAGGGGACTTTCCCAGGC- 3’ NF-κB 反向:5’-TCAACTCCCCTGAAAGGGTCCG- 3’;有机阳离子转运蛋白- 1 正向:5’-TGTCGAATGCAAATCACTAGAA- 3’,反向:5’-ACAG-CTTACGTTTAGTGATCTT- 3’。
细胞培养与分组初发MM患者与健康志愿者骨髓标本来自宁波市北仑区人民医院,RPMI8226 37 ℃、5% CO2培养于1640+10% 胎牛血清,RPMI8226分别分为CON与DTL-shRNA组,分别感染10感染复数(病毒∶细胞=10∶1)的CON与DTL-shRNA慢病毒。
CD138+细胞分离提取健康志愿者和骨髓瘤患者骨髓标本使用PBS溶液稀释4倍后,加入到等体积的淋巴细胞分离液中,1500 r/min(转子半径116 mm)密度梯度离心后,吸取位于中间的淋巴细胞层,从而得到单个核细胞,骨髓瘤标本单个核细胞进一步CD138+细胞磁珠分选试剂盒分离提取CD138+细胞,操作步骤按照试剂盒说明书进行。
CON与DTL-shRNA慢病毒包装纯化CON与DTL-shRNA慢病毒包装采用Addgene第3代慢病毒包装系统:VSV-G包膜质粒∶HIV- 1病毒骨架质粒∶目的质粒=1∶3∶4转染至293t细胞中,分别收取36、48、72 h病毒上清,聚乙二醇沉淀纯化并分装。
CCK8检测骨髓瘤细胞增殖骨髓瘤细胞系RPMI8226感染CON与DTL-shRNA慢病毒48 h后,分别种于96孔板中,每孔3000细胞,设立副孔,加入1/10体积的CCK8试剂,37 ℃孵育3 h,酶标仪检测450 nm吸光度,分别在0、24、48、72、96 h检测,并以0 h为对照,分别计算24、48、72、96 h与0 h的比值,实验重复3次,取平均值以判定细胞增殖的变化。
克隆形成实验(1)取4000个CON与DTL-shRNA RPMI8226细胞置于2 ml完全培养基中,并加入白介素- 6使终浓度为40 ng/ml。(2)细胞悬液与2 ml 甲基纤维素1640溶液混合。2 ml 甲基纤维素1640溶液配制:8 g甲基纤维素粉末加入200 ml超纯水中,转子搅拌至甲基纤维素溶解,将1640粉末按2倍的量加入到100 ml超纯水中,二者等体积混合得到2 ml 甲纤1640溶液。(3)将上述混合液加入到24孔板中,每孔1 ml,即设立3副孔。(4)10 d后倒置相差显微镜观察克隆形成情况,大于50个细胞的细胞群即认为是克隆。
实时定量PCR细胞总RNA使用RNA提取试剂盒提取,使用 实时定量PCR检测两组细胞中DTL mRNA的表达水平,DTL 正向:5’-ATTGCTACCTGTTCTGATGA- 3’,DTL 反向:5’-CTGGCTACTCGTTACTGTT- 3’;GAPDH 正向 5’-GTCTCCTCTGACTTCAACAGCG- 3’,反向5’-ACCACCCTGTTGCTGTAGCCAA- 3’ 。按染料法荧光定量试剂盒反应体系进行PCR扩增反应。以GAPDH基因为内参,并采用2-△△Ct法计算DTL在mRNA的相对表达量,实验重复3次,取平均值。
免疫印迹采用Western blot法,CON与DTL-shRNA RPMI8226细胞放射免疫沉淀法缓冲液细胞裂解液冰上裂解30 min,加入相应体积的蛋白上样缓冲液,煮沸10~15 min后得到Western blot样本,按照30 μg的量加入Western blot预制胶,50 V恒压待样本溴酚蓝至积层胶与分离胶分界线时,切换至120 V恒压,溴酚蓝至胶板底部时,400 mA恒流将蛋白样本转至聚偏二氟乙烯膜上,加DTL(1∶1000)、P65(1∶1000)、磷酸化-P65(1∶1000)、IκBα(1∶1000)、磷酸化-IκBα(1∶1000)、β-actin(1∶1000)一抗,37 ℃孵育4 h,孵育相应二抗(1∶5000),电化学发光免疫测定液显影,Quantity One 1-D分析软件对蛋白质印迹条带进行定量。目的蛋白相对表达量=目的蛋白测定值/ GAPDH,实验均重复3次,取平均值。
凝胶迁移实验
RPMI8226骨髓瘤细胞核蛋白提取:使用上海生工生物工程股份有限公司核蛋白提取试剂盒,操作步骤参照试剂盒说明书进行。
凝胶迁移实验:(1)生物素标记探针与核蛋白结合后,按照8 μg的上样量加入到凝胶迁移实验(electrophoretic mobility shift assay,EMSA)胶中,60 V恒压,待溴酚蓝至胶板底部时,中止电泳。(2)安装转膜三明治,将核蛋白转至尼龙膜上,使用紫外灯在距膜5~10 cm处照射10 min进行紫外交联反应。(3)样本使用封闭液封闭15 min,洗涤液洗3次后,加入电化学发光免疫测定发光液,后续步骤同Western曝光。
细胞凋亡实验RPMI8226 CON和shRNA细胞在感染病毒48 h后,选取20 万细胞,使用PBS洗两次,并使用凋亡试剂盒中结合缓冲液洗1次,100 μl结合缓冲液 重悬后,加入 5 μl 膜联蛋白 V 别藻蓝素和5 μl 碘化丙啶染料,冰上标记10 min后,流式细胞仪检测细胞凋亡的变化,凋亡细胞的比例即为膜联蛋白 V阳性细胞的比例。
细胞周期实验RPMI8226 CON和shRNA细胞在感染病毒48 h后,选取100万细胞,使用PBS洗两次后,使用300 μl 5%胎牛血清的PBS重悬,并加入700 μl无水乙醇(最终比例为70%)固定过夜,PBS洗两次后,加入终浓度为1 μg/ml的RNA酶,37 ℃水浴30 min,加入终浓度为50 μg/ml的碘化丙啶染料,避光室温孵育20 min,流式细胞仪检测细胞周期的变化。
统计学处理使用SPSS 20.0软件进行分析,采用两独立样本t检验,P<0.05为差异有统计学意义,对于重复测量数据,使用重复测量方差分析,P<0.05为差异有统计学意义,本研究全部流式数据使用FLOWJO 7.6.1软件进行分析[9]。
结 果
DTL在骨髓瘤患者CD138+细胞中的表达选取14例健康志愿者骨髓单个核细胞以及34例初发骨髓瘤患者CD138+细胞,34例多发性骨髓瘤患者中,年龄平均(68.43±10.29)岁,其中男28例、女6例,CD138+细胞比例为(38.21±26.47)%,M蛋白为(36.63±15.85)g/L,14例健康志愿者骨髓单个核细胞与34例骨髓瘤患者CD138+细胞中,DTL的表达量分别为1.00±0.12 和 9.36±3.71(t=3.65,P=0.0024),并同时选取其中12例骨髓瘤样本,以2例健康志愿者骨髓单个核细胞为对照,Western blot检测DTL在骨髓瘤样本中的蛋白水平的表达,结果显示相对于健康志愿者骨髓单个核细胞,DTL在骨髓瘤患者中的表达显著提高。
DTL-shRNA慢病毒感染效率与敲低水平CON与DTL-shRNA组RPMI8226骨髓瘤细胞系感染病毒48 h后,首先使用流式细胞仪检测绿色荧光蛋白阳性细胞的比率,结果显示两种病毒对于骨髓瘤细胞系的感染效率均为90%(图1A),使用实时定量PCR检测DTL在RNA水平的改变后显示,CON组与DTL-shRNA组的DTL相对表达量分别为1.00±0.01 和 0.21±0.04(t=33.19,P<0.0001),使用Western blot检测DTL在蛋白水平的改变后显示,CON组与DTL-shRNA组的DTL相对表达量分别为0.52±0.13 和 0.11±0.02(t=5.399,P=0.0057)(图1B)。

CON:对照组;DTL-shRNA:DTL泛素E3连接酶敲低组;Mr:相对分子质量
CON:control group;DTL-shRNA:denticleless E3 ubiquitin protein ligase-short hairpin RNA group;Mr:relative molecular mass
A.流式细胞仪检测感染效率;B.Western blot检测在蛋白水平的敲除效率
A.detection of the infection efficiency by flow cytometry;B.detection of kock-down efficicency at protein level by Western blot
图1RPMI8226感染10 感染复数 CON和DTL-shRNA组慢病毒48 h后DTL-shRNA对人多发性骨髓瘤细胞系RPMI8226感染及敲除效率
Fig1DTL-shRNA infection and knock-down efficiencies in human multiple myeloma cell line RPMI8226 after RPMI8226 is infected by 10 folds of CON and DTL-shRNA lentivirus for 48 hours
骨髓瘤DTL的下调抑制细胞增殖和细胞克隆形成,并促进凋亡与细胞周期阻滞CON与DTL-shRNA组 0、24、48、72、96 h的细胞相对数量分别为1.00±0.03比 1.00±0.02、2.19±0.28 比 1.47±0.13、3.50±0.14 比 2.24±0.19、5.43±0.41比 3.08±0.14、7.42±0.17 比 4.29±0.13,Mauchly球形检验P=0.006,因此采用多变量方差分析方法,结果显示不同组之间随时间变化差异有统计学意义(F=24.58,P=0.001)。将CON与DTL-shRNA细胞分别培养于半固体培养基中10 d,倒置相差显微镜检测克隆形成后发现,CON组细胞克隆形成能力正常,视野中有大于50个细胞的克隆形成(白色箭头处),而DTL-shRNA组细胞的克隆形成能力受到完全抑制,镜下大于50个细胞的克隆不可见,同时凋亡形态细胞显著增加(白色箭头处)(图2A),而CON与DTL-shRNA克隆形成数量分别为76±4比0(P<0.01)。同时检测CON与DTL-shRNA 细胞周期的变化,结果显示CON与DTL-shRNA组G1期细胞比例为(28.61±8.64)%比(57.25±10.37)%(t=3.675,P=0.0213)(图2B),在细胞凋亡中,CON与DTL-shRNA组膜联蛋白 V+细胞比例为(3.21±0.89)%比(34.71±18.68)%(t=2.895,P=0.0443)(图2C)。
DTL-shRNA对增殖、克隆形成的抑制与NF-κB通路的下调RPMI8226感染10感染复数 CON与DTL-shRNA慢病毒48 h后,使用Western blot检测NF-κB通路P65亚基磷酸化的水平后显示,CON与DTL-shRNA组磷酸化-P65相对表达量分别为1.52±0.14 和 0.82±0.11(t=6.81,P=0.0024),而P65的表达分别为0.25±0.04和0.24±0.08(t=0.19,P=0.85),差异无统计学意义,CON与DTL-shRNA组磷酸化-IκBα的相对表达量分别为0.19±0.03 和 0.13±0.02(t=2.882,P=0.0449),而IκBα的相对表达量分别为0.22±0.05和1.01±0.06(t=17.52,P<0.0001)(图3A)。以有机阳离子转运蛋白- 1探针为对照,进一步使用EMSA检测DTL-shRNA NF-κB转录活性的变化,结果表明DTL-shRNA组NF-κB转录活性显著下调(图3B)。
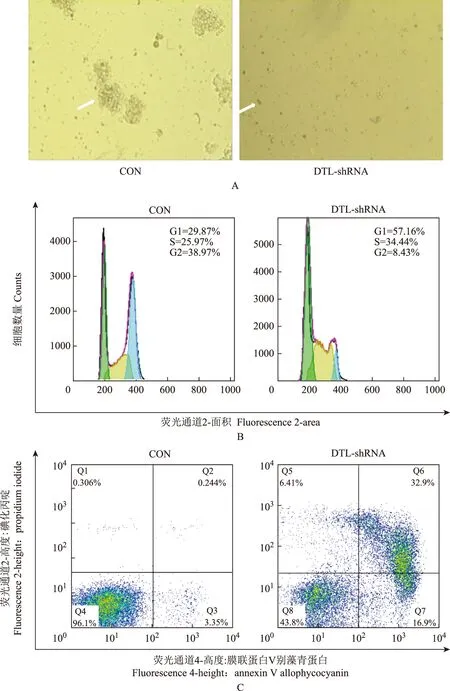
A.半固体培养基中培养10 d倒置相差显微镜观察克隆形成(白色箭头处:典型克隆或凋亡细胞)(×100);B.碘化丙啶染色法检测细胞周期的变化;C.膜联蛋白 V/碘化丙啶双染法检测细胞凋亡的变化
A.culture in semisolid medium for 10 days and detection of the change of colone formation using inverted phase contrast microscope(white arrow:classic colone or apoptosis cells);B.detection of the change of cell cycle by propidium iodide staining;C.detection of the change of cell apoptosis by annexin V/propidium iodide double staining
图2RPMI8226感染10 感染复数 CON和DTL-shRNA慢病毒48 h后,DTL-shRNA抑制RPMI8226增殖、克隆形成,促进凋亡与细胞周期阻滞
Fig2DTL-shRNA inhibits RPMI8226 proliferation and colone formation and induces apoptosis and cell cycle arrest after RPMI8226 is infected by CON and DTL-shRNA lentivirus for 48 hours
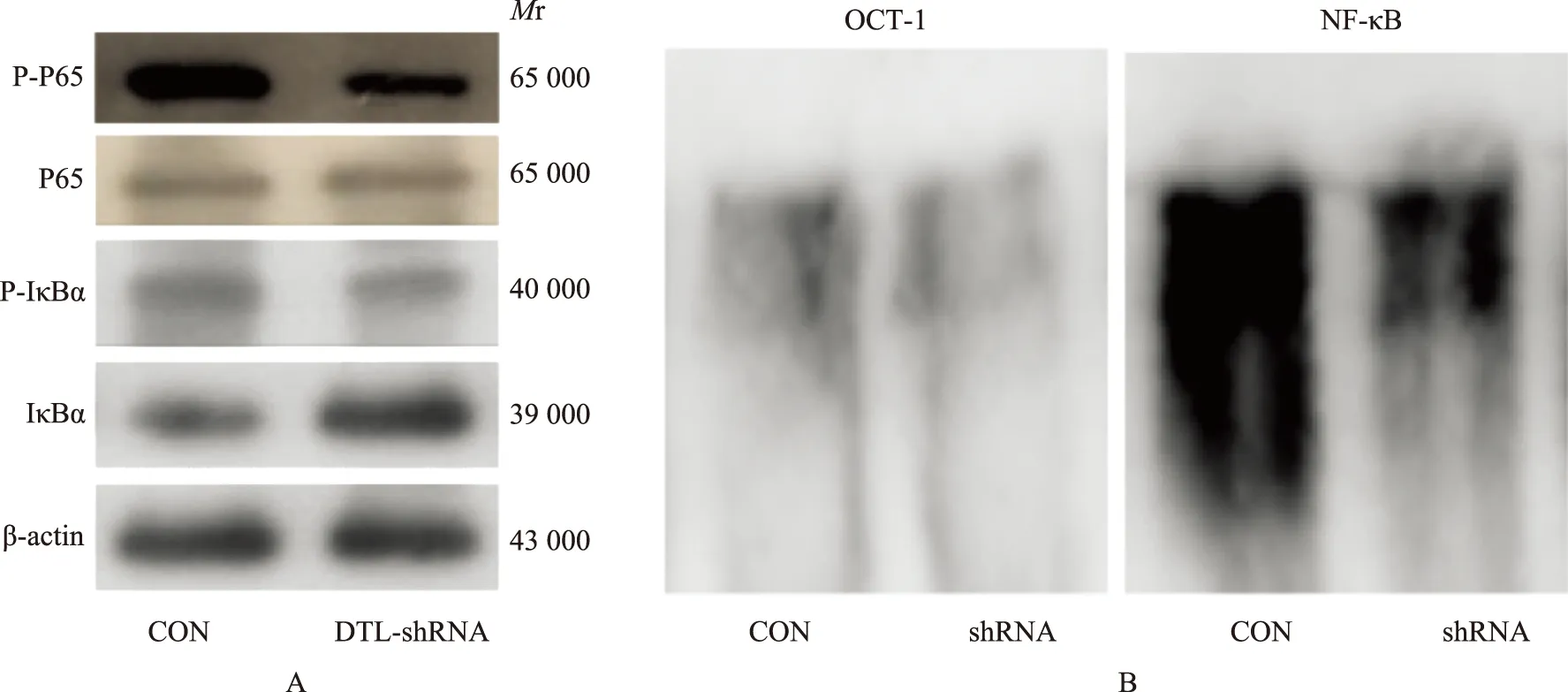
NF-κB:核因子-κB;P-P65:磷酸化P65;IκBα:抑制因子κBα;P-IκBα:磷酸化IκBα;EMSA:凝胶迁移实验;OCT- 1:有机阳离子转运蛋白- 1
NF-κB:nuclear factor-κB;P-P65:phosphorylation P65;IκBα:inhibitory subunit-κBα;P-IκBα:phosphorylation IκBα;EMSA:electrophoretic mobility shift assay;OCT- 1:organic cation transporter- 1
A.使用Western blot检测NF-κB通路P65、IκBα磷酸化水平变化;B.EMSA检测NF-κB转录活性的变化
A.detection of P65 and IκBα phosphorylation change in NF-κB pathway by Western blot;B.detection of the change of NF-κB transcriptional ability by EMSA
图3RPMI8226感染10感染复数 CON和DTL-shRNA慢病毒48 h后,DTL-shRNA引起细胞增殖改变与NF-κB通路改变相关
Fig3Effect of DTL-shRNA on cell prolieration is related with NF-κB pathway alteration after RPMI8226 is infected by CON and DTL-shRNA lentivirus for 48 hours
讨 论
尽管以硼替佐米为代表的MM靶向治疗具有很好的效果,随着耐药的逐渐增多,开发新的靶向治疗药物成为研究的热点,越来越多的研究表明泛素化通路与MM的发生发展密切相关,其中usp7特异性抑制剂已在临床应用,同时泛素E3连接酶Pirh2也被证实与MM的硼替佐米耐药相关。DTL做为一种泛素E3连接酶,其作用主要为将泛素分子与靶蛋白连接,继而介导靶蛋白的降解、定位等生物学进程,DTL同时也是反式维甲酸介导的人畸胎瘤细胞系nt2分化中重要的下游基因[10],同时DTL也是一种备受关注的癌基因,在胃癌中,DTL的表达与淋巴结侵袭、肿瘤复发及患者生存率相关且与p53的突变无相关性[11],在结肠癌中DTL高表达且作为MiR- 30a- 5p的靶点进而调控细胞的增殖[12]。而DTL在MM中的表达以及与增殖、克隆形成能力的关联则报道较少。
本研究首先选取34例MM患者与14例健康志愿者骨髓,在分离出单个核细胞后,由于MM中CD138+细胞表达异常升高,因此使用磁珠分选试剂盒分选出CD138+细胞,使用实时定量PCR检测DTL的表达后显示,DTL在骨髓瘤患者CD138+细胞中高表达,在确定了DTL mRNA水平的高表达后,由于Western blot所需细胞数量较多(需100万细胞),部分骨髓瘤患者CD138+细胞比例较低,且每例患者仅获得5 ml骨髓,获得细胞较少,因此选取其中12例CD138+细胞比例较高患者,同时受Western胶上样数量的限制,选取2例健康志愿者骨髓单个核细胞为对照,2例对照样本DTL mRNA表达量位于中间水平,结果表明相对于健康志愿者血液单个核细胞,DTL在蛋白水平同样高表达,初步证实DTL可能为MM中的癌基因。因此进一步使用RPMI8226细胞系分别感染CON与DTL-shRNA病毒,并使用CCK8方法检测骨髓瘤细胞增殖变化,结果表明DTL的下调能够显著抑制细胞增殖,在48、72 h差异具有统计学意义,细胞克隆形成能力能够很好地反映细胞增殖、侵袭和对杀伤因素敏感性,结果表明DTL-shRNA使骨髓瘤细胞系克隆形成能力完全受限,镜下DTL-shRNA组克隆不可见,DTL的敲低同时能够促进RPMI8226的凋亡,并使得细胞周期中G1期细胞比例显著降低,证实了DTL的过表达对于骨髓瘤细胞系生物学功能的维持至关重要。NF-κB是骨髓瘤发生发展中起到关键作用的通路,NF-κB因子包括P65、P50等5种亚基,通常情况下两种亚基形成的二聚体与抑制因子IκBα结合而以无活性的状态存在[13],各种胞外信号如肿瘤坏死因子α[14]、白介素- 2[15]等作用于膜受体后,激活磷酸化κB抑制蛋白激酶的作用,磷酸化κB抑制蛋白激酶使得IκBα与NF-κB亚基磷酸化,IκBα随机与泛素分子结合并降解,NF-κB亚基则磷酸化激活并入核,进而转录下游分子[16]。使用蛋白印迹与EMSA实验检测骨髓瘤细胞中NF-κB通路的变化,结果表明DTL敲低后,NF-κB通路P65亚基磷酸化受到抑制,抑制因子IκBα磷酸化同时降低,且IκBα表达升高,IκBα磷酸化以及随后的泛素化直接导致IκBα的降解[17],因此,DTL-shRNA使得IκBα降解受到了抑制,EMSA实验检测NF-κB转录活性的变化后发现NF-κB转录活性显著降低,DTL对NF-κB通路影响的机制可能如下:(1)DTL的功能主要为介导泛素分子与靶蛋白的结合,已有研究证实,与DTL具有相似功能的鼠双微基因2蛋白能够通过与慢性粒细胞中的P65基因的启动子转化蛋白1结合,从而诱导P65亚基的表达[18],DTL可能通过相似的机制影响NF-κB通路。(2)本研究同时观察到DTL的敲除能够诱导IκBα亚基的磷酸化,同时促进IκBα的降解,IκBα降解的增加通常与泛素化水平的升高密切相关[19],DTL敲除能够使肿瘤细胞泛素通路受损,IκBα降解降低,进而使NF-κB通路受到抑制。因此,DTL敲低对于骨髓瘤细胞增殖、克隆形成能力的影响与NF-κB通路的抑制有关。
综上,本研究结果显示DTL在MM中的表达,并论证了DTL对骨髓瘤细胞增殖、克隆形成能力的影响及相关机制,为后续开发DTL特异性抑制剂提供了依据,缺点在于本研究纳入骨髓瘤标本数量较少(mRNA 34例、蛋白水平12例),对于DTL在骨髓瘤患者中的表达水平论证不充分,因此,在今后的研究中,需进一步纳入新的骨髓瘤患者病例,并尝试在癌症和肿瘤基因图谱、基因表达汇编公共数据库中得到验证。

