贝莱斯芽孢杆菌E69预防稻瘟病等多种真菌病害的潜力
沙月霞,隋书婷,曾庆超,沈瑞清
贝莱斯芽孢杆菌E69预防稻瘟病等多种真菌病害的潜力
沙月霞1,隋书婷2,曾庆超2,沈瑞清1
(1宁夏农林科学院植物保护研究所,银川 750011;2中国农业大学植物保护学院,北京 100193)
【】明确水稻内生菌贝莱斯芽孢杆菌()菌株E69对多种植物病原真菌的拮抗作用,尤其是对稻瘟病的生物防治效果,减少化学农药的使用。贝莱斯芽孢杆菌菌株E69和枯草芽孢杆菌(,稻瘟病生物防治最常用微生物)菌株E66分离于水稻叶片内生细菌,采用对峙培养法测试菌株E69和E66及其发酵液、无菌上清液对稻瘟病菌()的拮抗作用,并测试两株内生芽孢杆菌对立枯丝核菌()、镰孢菌(spp.)、番茄灰霉病菌()、草莓炭疽病菌()、烟草黑胫病菌(var.)、链格孢菌()、西瓜枯萎病菌()等11种植物病原菌的拮抗作用,温室条件下检测对水稻叶瘟的预防效果,田间试验检测对水稻叶瘟和穗颈瘟的预防效果,常规抑菌测试法研究对稻瘟病菌分生孢子萌发和附着胞形成的抑制作用。采用激光共聚焦显微镜观察绿色荧光蛋白标记后的工程菌株E69在水稻茎部的定殖情况。菌株E69和E66对稻瘟病菌菌丝生长具有显著拮抗作用,温室条件下两个菌株对稻瘟病的预防效果分别为83.24%和76.57%,对叶瘟的田间预防效果分别为85.97%和79.76%,对穗颈瘟的田间预防效果分别为69.67%和68.82%,E69对叶瘟的预防效果显著高于75%的三环唑可湿性粉剂,对穗颈瘟的预防效果与三环唑无显著差异。菌株E69和E66对立枯丝核菌、镰孢菌、番茄灰霉病菌、草莓炭疽病菌、烟草黑胫病菌、叶枯病菌、西瓜枯萎病菌等11种植物病原菌有显著拮抗作用,E69的拮抗作用明显高于E66。菌株E69和E66能够强烈抑制稻瘟病菌分生孢子萌发和附着胞的形成,E69发酵液的抑菌效果分别为95.28%和94.16%,无菌上清液的抑菌效果分别为85.36%和84.31%;E66发酵液对分生孢子萌发和附着胞形成的抑菌效果分别为89.15%和87.38%,无菌上清液的抑菌效果分别为79.65%和72.45%。绿色荧光蛋白GFP78标记后的工程菌株E69在水稻茎部具有较好的定殖能力,可以稳定定殖在水稻茎部表皮、薄壁组织和维管束。贝莱斯芽孢杆菌菌株E69是一种潜在的、预防效果明显的生防菌株,具有预防稻瘟病兼防纹枯病等多种真菌病害的应用潜力。
贝莱斯芽孢杆菌;稻瘟病;植物病原真菌;生物防治;定殖能力
0 引言
【研究意义】水稻是世界范围内重要的粮食作物,稻瘟病(rice blast)是危害水稻生产最严重的病害,其病原菌的无性态为无性菌类丝孢目梨孢属灰梨孢菌,有性态为子囊菌门巨座壳目巨座壳属[1]。稻瘟病发生范围广泛,平均每年造成20%—30%的产量损失,流行年份损失达到50%以上,严重的甚至绝产[2]。水稻抗病品种选育、农艺措施和化学农药防治是目前生产上最常用的措施,由于稻瘟病菌生理小种易变异,抗病品种选育一般时间较长;化学农药的使用容易使病原菌产生抗药性且对生态环境和人类健康有一定影响。因此,寻找一种安全、环境友好并具有良好防治效果的新型生防菌对水稻产业可持续发展具有重要意义。【前人研究进展】芽孢杆菌产生抗逆性极强的芽孢,对生态环境无污染,可以与环境中的其他微生物互作,具有广谱的抑菌活性,诱导植株产生抗病性,是稻瘟病防治研究的热点之一[3]。目前在稻瘟病防治中应用较多的芽孢杆菌包括枯草芽孢杆菌()[4]、解淀粉芽孢杆菌(.)[5]、短小芽孢杆菌(.)[6]、地衣芽孢杆菌(.)、多粘类芽孢杆菌()和坚强芽孢杆菌(.)等。但是已报道的芽孢杆菌大多来源于根际促生菌(plant growth promoting rhizobacteria)[7]、土壤[8]和植株表面[9],较少来源于植物内生菌。植物内生菌是植物微生态系统的重要组成部分[10-11],具有非常重要的生态功能[12-13],包括具有较强且广谱的抑菌防虫作用[14-15]、促生增产作用[16-17]、促进植株体内氮等营养元素的转化与吸收[18-19]、增强寄主抗逆性[20-21]、降解重金属污染和农药残留[22]等,可以用于研制生物杀菌剂[23]和微生物肥料[24]。关于植物内生菌防治稻瘟病的研究国内外虽有不少报道,但是植物内生芽孢杆菌防治稻瘟病的研究尚处于探索阶段。Jha等[25]研究表明,分离于水稻根系内生菌的类产碱假单胞菌()GJ17对稻瘟病菌的生防效果明显高于根际促生菌短小芽孢杆菌;Zhu等[26]研究表明,内生真菌柿假尾胞菌()和菌核青霉()对稻瘟病菌菌丝生长的抑制率分别达78.02%和62.81%。生防微生物在植株上的定殖、扩散和生存竞争能力是考核生防作用的重要指标之一[27-28]。【本研究切入点】植物内生菌贝莱斯芽孢杆菌()菌株E69为笔者实验室前期从宁夏回族自治区水稻叶片中分离得到,其对稻瘟病菌、立枯丝核菌()等多种病原真菌的拮抗作用和生防应用潜力有待明确。【拟解决的关键问题】探明贝莱斯芽孢杆菌菌株E69对稻瘟病的预防效果和对立枯丝核菌等11种病原真菌的拮抗作用,明确其对稻瘟病菌孢子萌发和附着胞形成的抑制作用以及在水稻茎部的定殖情况,为应用E69菌株预防稻瘟病、纹枯病、灰霉病、叶枯病等真菌病害提供理论依据。
1 材料与方法
1.1 试验田概况
田间试验于2018年在宁夏回族自治区平罗县姚伏镇(106.52°E,38.91°N)水稻种植主栽地区进行。试验地常年种植水稻,稻瘟病每年普遍发生,行距为30 cm,正常肥水管理,试验期间不喷施其他杀菌剂。土壤类型为草甸土,碳酸钙含量5—78 g·kg-1,全磷含量:0.32—0.49 g·kg-1,全钾含量:16.7—29.5 g·kg-1,全氮含量:0.14—0.94 g·kg-1,pH 7.2—8.8,有机质含量1.2—13.1 g·kg-1。
1.2 生防菌、病原菌及其培养
稻瘟病菌P131由中国农业大学植物保护学院提供。尖镰孢()N16-2-1、茄镰孢()N18-1-2、串珠镰孢()N19-2-2、立枯丝核菌RS8由笔者实验室分离;西瓜枯萎病菌(f. sp.)M8、番茄灰霉病菌()ZDP4、草莓炭疽病菌()ZDP21、苹果叶枯病菌链格孢菌()BJ-A5、海棠叶枯病菌链格孢菌BJ-H9、烟草黑胫病菌(var.)T15、草莓叶枯病菌链格孢菌BJ-ST24由北京市农林科学院植物保护环境保护研究所分离。田间试验水稻品种宁粳47,温室试验水稻品种G19,均为宁夏水稻种植地区主栽品种。
水稻内生芽孢杆菌菌种:贝莱斯芽孢杆菌E69和枯草芽孢杆菌E66是从宁夏回族自治区水稻叶片中分离得到的内生菌,GFP标记菌株为采用绿色荧光蛋白GFP78标记后的E69。
2个水稻内生芽孢杆菌在牛肉膏蛋白胨固体培养基平板上活化,在37℃黑暗条件下培养。稻瘟病菌P131的活化和培养在番茄燕麦培养基上进行。11种其他植物病原真菌菌株在PDA平板上活化和培养。
1.3 对峙培养
在番茄燕麦平板培养基中央放置稻瘟病菌菌饼(1 cm),待稻瘟病菌菌落生长2 d后,分别在菌落边缘相距2 cm处接种芽孢杆菌菌饼(5 mm),有一侧为空白对照,置于培养箱28℃黑暗培养,4次重复。4 d后测量病原菌菌落直径。
在PDA培养基平板上中央放置上述11种植物病原菌的菌饼(1 cm),分别在菌落边缘两侧相距2 cm处接种芽孢杆菌菌株(划线2 mm),置于培养箱28℃黑暗培养,5 d后测量病原菌菌落直径和抑菌带。
1.4 水稻内生芽孢杆菌对稻瘟病的防治效果
温室试验设计5个处理:处理Ⅰ-CK为清水对照;Ⅱ-菌株E66发酵液;Ⅲ-菌株E69发酵液; Ⅳ-75%三环唑可湿性粉剂(陶氏益农农业科技(中国)有限公司);Ⅴ-绿地康1号(中农绿康(北京)生物技术有限公司)。每处理4个重复。水稻种植28 d后,CK喷施无菌水,处理Ⅱ、Ⅲ喷施内生芽孢杆菌发酵液,喷雾芽孢浓度为1×108CFU/mL,处理Ⅳ喷施20%的三环唑水溶液,处理Ⅴ喷施绿地康1号的100倍稀释液,每个水桶种植5株水稻,喷施20 mL。24 h后所有处理均喷施20 mL稻瘟病菌孢子悬浮液(1×106CFU/mL)。7 d后调查叶瘟发生情况。
田间试验地点在平罗县姚伏镇,试验设计5个处理:CK为清水对照;菌株E66和E69,喷雾芽孢浓度为1×108CFU/mL;75%三环唑可湿性粉剂;绿地康1号。分别在水稻插秧后30、45、60、75和90 d叶面喷施菌剂发酵液、75%三环唑可湿性粉剂和绿地康1号。75%三环唑可湿性粉剂的用药量为1.05—1.20 kg·hm-2,药液量为600—750 kg·hm-2。绿地康1号的用药量为7.50 L·hm-2(有效活菌数≥1×109/mL),药液量为2 400 kg·hm-2。稻瘟病在试验田每年均有发生,插秧后45 d调查试验田叶瘟的发生情况,插秧后100 d调查穗颈瘟的发生状况,调查分级标准采用中华人民共和国国家标准(GB/T15970—1995)。试验小区采取随机排列,小区平均面积50 m2,每处理4个重复小区。
1.5 水稻内生芽孢杆菌对稻瘟病菌孢子萌发的抑制作用
枯草芽孢杆菌E66和贝莱斯芽孢杆菌E69的发酵液(芽孢浓度为1×108CFU/mL)、无菌上清液(发酵液离心后的上清液经0.22 μm抽滤)分别与稻瘟病菌孢子悬浮液(1×106CFU/mL)以1﹕1的比例混匀,混合液在无菌12孔板中28℃对峙培养24 h,在激光共聚焦显微镜下观察稻瘟病菌P131分生孢子萌发和附着胞形成情况,每次观察200个分生孢子。
1.6 贝莱斯芽孢杆菌E69在水稻植株上的定殖
水稻种植20 d时,用已成功标记绿色荧光蛋白GFP的贝莱斯芽孢杆菌E69发酵液(芽孢浓度为1×108CFU/mL)喷施植株,7 d后用LEICA 3050S冷冻切片机做水稻茎部横切面和纵切面的冷冻切片,厚度约20 μm,用LEICATCS SP8激光共聚焦显微镜观察供试菌株在水稻植株的定殖情况。激发光是绿光,波长为488 nm,采用Photoshop11.0图片编辑软件编辑照片。
1.7 数据处理与分析
所有数据在Excel 2007中计算平均值±标准误,采用DPS15.0统计软件进行分析,方差分析选用单因素分析中的最长距离法计算(<0.05)。
计算公式:病情指数=[∑各级病叶(穗)数×相对级数值]/[调查总叶(穗)数×9]×100;预防效果(%)=[(CK 病情指数-处理病情指数)/CK病情指数]×100。
2 结果
2.1 水稻内生芽孢杆菌对稻瘟病菌的拮抗作用
水稻内生芽孢杆菌菌株E69和E66均能够显著抑制稻瘟病菌P131的生长,拮抗作用明显,相对菌丝抑制率分别达到90.36%和92.56%,其发酵液和无菌上清液的抑菌作用也较为明显(图1)。

A:稻瘟病菌P131生长9 d的菌落形态The colony morphology of M. oryzae P131 growing for 9 d;B:拮抗菌E69与稻瘟病菌P131对峙培养The colony of M. oryzae P131 inhibited by strain E69;C:拮抗菌E66与稻瘟病菌P131对峙培养The colony of M. oryzae P131 inhibited by strain E66;D:稻瘟病菌P131生长6 d的菌落形态The colony morphology of M. oryzae P131 growing for 6 d;E:拮抗菌E69发酵液与稻瘟病菌P131对峙培养The colony of M. oryzae P131 inhibited by fermented liquid of strain E69;F:拮抗菌E69无菌上清液与稻瘟病菌P131对峙培养The colony of M. oryzae P131 inhibited by sterile supernatant of strain E69;G:拮抗菌E66发酵液与稻瘟病菌P131对峙培养The colony of M. oryzae P131 inhibited by fermented liquid of strain E66;H:拮抗菌E66无菌上清液与稻瘟病菌P131对峙培养The colony of M. oryzae P131 inhibited by sterile supernatant of strain E66
2.2 水稻内生芽孢杆菌对稻瘟病的预防效果
2株水稻内生芽孢杆菌在温室条件下对稻瘟病有显著预防效果(表1),贝莱斯芽孢杆菌E69对稻瘟病的预防效果为83.24%,与对照生物农药绿地康的预防效果(84.51%)无显著差异(>0.05),显著高于化学农药75%三环唑可湿性粉剂的预防效果(77.91%)(<0.05)。枯草芽孢杆菌E66的预防效果与三环唑无显著差异(>0.05),显著低于菌株E69的预防效果(<0.05)。
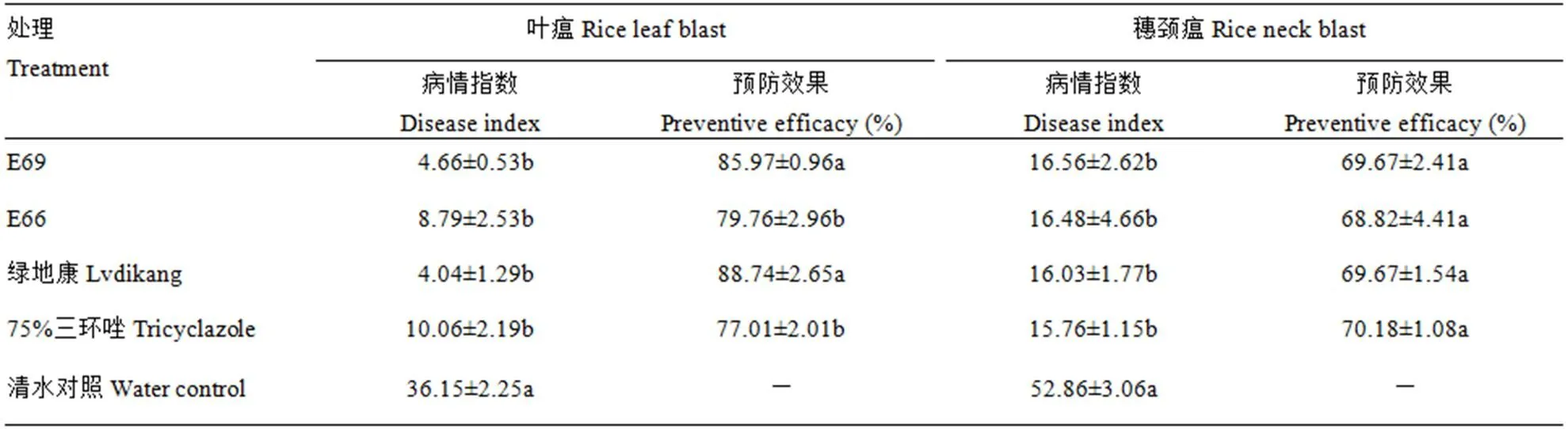
2株水稻内生芽孢杆菌对叶瘟的田间预防效果显著(表2)。贝莱斯芽孢杆菌E69预防水稻叶瘟的效果达到85.97%,与绿地康的预防效果无显著性差异(>0.05),与三环唑的预防效果差异显著(<0.05)。菌株E66对叶瘟的田间预防效果与三环唑无显著性差异(>0.05)。各处理对穗颈瘟的效果无显著性差异(>0.05)。对穗颈瘟的田间预防效果较低,分析原因主要是试验田在施肥管理上出现失误,生产过程中误施过量尿素,导致穗颈瘟大发生,影响了E69的田间应用效果。

表1 水稻内生芽孢杆菌在温室条件下对稻瘟病的预防效果
数据后不同小写字母表示差异显著(<0.05)。下同
Different lowercases after the data indicate significantly different (<0.05). The same as below
表2 水稻内生芽孢杆菌预防稻瘟病的田间效果
Table 2 The preventive efficacy of rice endophytic bacteria against rice blastin the field
2.3 水稻内生芽孢杆菌对立枯丝核菌等病原菌的拮抗作用
2株水稻内生芽孢杆菌对多种植物病原菌具有显著抑菌作用(表3)。贝莱斯芽孢杆菌E69对尖镰孢、茄镰孢和串珠镰孢的抑菌效果>80%,对立枯丝核菌、番茄灰霉病菌、苹果叶枯病菌和海棠叶枯病菌的抑菌效果在71%—80%,对草莓炭疽病菌、西瓜枯萎病菌和烟草黑胫病的抑菌效果在61%—70%,对草莓叶枯病菌的抑菌效果<60%。枯草芽孢杆菌E66对立枯丝核菌的抑菌效果在71%—80%,对尖镰孢、苹果叶枯病菌、海棠叶枯病菌和西瓜枯萎病菌的抑菌效果在61%—70%,对其他病原菌的抑菌效果<60%。枯草芽孢杆菌E66对11种植物病原菌具有拮抗作用,但是抑菌效果明显小于菌株E69。

表3 菌株E69和E66对多种植物病原菌的拮抗作用
+、++、+++和++++代表相对菌丝抑制率分别为50%—60%、61%—70%、71%—80%和>80%
+, ++, +++ and ++++ represent relative inhibition rates against mycelia growth of each fungal colony on the PDA medium to the extent of 50%- 60%, 61%-70%, 71%-80% and >80%, respectively
2.4 水稻内生芽孢杆菌对稻瘟病菌孢子萌发和附着胞形成的抑制作用
2株水稻内生芽孢杆菌对稻瘟病菌孢子萌发和附着胞形成具有显著的抑制作用(表4)。贝莱斯芽孢杆菌E69发酵液对稻瘟病菌分生孢子萌发和附着胞形成的抑制作用分别是95.28%和94.16%,无菌上清液的抑制作用分别是85.36%和84.31%。枯草芽孢杆菌E66发酵液和无菌上清液对稻瘟病菌分生孢子萌发和附着胞形成也具有明显抑制作用,但是抑菌效果较菌株E69低。
2.5 贝莱斯芽孢杆菌E69在水稻茎部的定殖
采用CLSM观察贝莱斯芽孢杆菌E69在水稻茎部的定殖(图2)。喷施后第7天,在水稻茎部检测到菌株E69的GFP绿色荧光。在纵切面的表皮、基本组织和维管束中观察到标记菌株,尤其是表皮的绿色荧光较强,向内逐步减弱。在横切面的表皮、薄壁组织和中央维管束系统中也观察到的绿色荧光,强弱程度与纵切面一致。说明E69从表皮进入茎部组织,向薄壁组织和中央维管束系统扩展迁移。在无菌水喷雾处理的水稻茎部组织中未发现有荧光标记的E69。
表4 水稻内生芽孢杆菌对稻瘟病菌孢子萌发和附着胞形成的抑制作用
Table 4 Inhibitory activity of rice endophytic bacteria against conidial germination and appressorial formation of

3 讨论
芽孢杆菌对植物病原菌的生防机制主要包括竞争作用、拮抗作用和诱导抗病性,有的菌株以一种生防机制为主,有的菌株则以多种生防机制协同作用相互增强了对病原菌的拮抗作用[29]。芽孢杆菌具有防治植物病害的优良特性,在世界范围内被广泛用作商品化的生防制剂。一般来源于植物内部组织的芽孢杆菌抗菌谱较广,抑菌效果明显,受环境因素影响较小,是广大植物病理工作者研究的热点之一。但是目前植物内生芽孢杆菌的商品化研发还处于探索阶段,获得对多种植物病原菌具有拮抗作用的内生芽孢杆菌并用做生防制剂,一直是植物病害生物防治研究的重要内容。
目前,在水稻生产上用于稻瘟病生物防治的芽孢杆菌主要包括枯草芽孢杆菌、解淀粉芽孢杆菌、短小芽孢杆菌、地衣芽孢杆菌等,已有研究表明贝莱斯芽孢杆菌对多种植物病原菌有较强的拮抗作用[30-31],但国内还未有学者研究过其对稻瘟病菌的拮抗作用,本研究证实了贝莱斯芽孢杆菌对稻瘟病具有较明显的预防效果,不仅为稻瘟病杀菌剂的研发提供了新型微生物资源,而且拓宽了贝莱斯芽孢杆菌的应用领域。生防芽孢杆菌大多来源于植株根际、非根际土壤或植株体表,而采用植物内生菌预防稻瘟病的研究报道较少。贝莱斯芽孢杆菌E69和枯草芽孢杆菌E66菌株均来源于水稻叶片内生菌,研究结果进一步印证了植物内生菌具有广泛的生物活性,具备应用于防治稻瘟病等多种真菌病害的生防潜力。
水稻内生芽孢杆菌对稻瘟病菌分生孢子萌发和附着胞形成具有显著抑菌作用,贝莱斯芽孢杆菌E69发酵液几乎完全抑制孢子萌发和附着胞的形成;无菌上清液的抑菌作用也较明显,对孢子萌发和附着胞形成的抑菌率达到84%以上。此结果进一步证实拮抗作用是E69菌株防治稻瘟病的机制之一。芽孢杆菌对病原菌的拮抗作用主要包括抑菌作用和溶菌作用[32-33],之所以会产生不同的拮抗机制源于菌株产生的抗菌活性物质,包括酶类、细菌素、脂肽类以及挥发性物质等[34]。之前的研究表明,贝莱斯芽孢杆菌E69产生蛋白酶、淀粉酶、纤维素酶和葡聚糖酶,挥发性物质对稻瘟病菌菌丝生长的抑制效果达到95%以上,但具体哪类抗菌活性物质抑制了孢子萌发和附着胞形成有待于深入研究。
在稻瘟病的田间防治中,一般环境中微生物会与生防菌竞争营养、空气和生态位点,可能会影响生防菌在植株体内的定殖,进而导致防治效果下降[35-36]。而植物内生生防菌与寄主体内的微生物相容性好,比土壤和其他来源的生防菌在植物体内更容易定殖、扩展和迁移。大量的研究证实,生防菌能否有效在植株体内定殖是生防效果能否稳定、持效的重要因素[37-38]。本研究检测了绿色荧光蛋白(GFP)标记后的贝莱斯芽孢杆菌E69在水稻茎部的定殖状况,在水稻表皮组织、薄壁组织和维管束中具有较好的定殖能力。GFP是广泛应用的标记分子,不会改变细胞的结构和活性[39],对细胞无毒,常被研究人员作为标记基因用来研究微生物在植株体内的定殖规律[40]。笔者还研究了GFP标记后的菌株与原始菌株之间在生长曲线、抑菌作用之间的差异,证实GFP标记的工程菌株与原始菌株在抑菌活性和生长动力学方面没有明显差异(另文发表),因此可以用GFP作为标记基因研究贝莱斯芽孢杆菌在水稻植株上的定殖情况。
筛选并利用具有多种拮抗机制的芽孢杆菌作为生防菌剂是植物病害生物防治研究的重要内容。NG等[41]研究表明,解淀粉芽孢杆菌UPMS3和多种微生物混配的微生物菌肥可以显著提高生防菌的活性;Kanjanamaneesathian等[42]将巨大芽孢杆菌()浸种和叶面喷雾,结合施用氮肥,可以有效预防穗颈瘟;Kyung-Seok等[43]发现萎缩芽孢杆菌()EXTN-1诱导作物PR基因的表达,进而诱导产生抗病性,防治稻瘟病效果达52.11%。本研究结果证实了贝莱斯芽孢杆菌E69具有广谱抗菌活性,温室条件下对稻瘟病的预防效果明显,为应用于稻瘟病的防治提供了依据。田间大区试验进一步证实,E69预防水稻叶瘟的效果较好,与绿地康的预防效果相当,对穗颈瘟也有一定的效果,显示出E69良好的生防应用价值。另外,对11种植物病原真菌的菌丝抑制试验表明,该菌株作为生防制剂可能同时具有防治纹枯病、番茄灰霉病等多种真菌病害的潜力。
4 结论
贝莱斯芽孢杆菌菌株E69对稻瘟病具有明显的生防效果,并且具有广谱的抑菌活性,能够稳定定殖在水稻植株体内,具有在稻瘟病的田间防治中推广应用的潜力。E69发酵液和无菌上清液均可显著抑制稻瘟病菌的分生孢子萌发和附着胞形成。因此,贝莱斯芽孢杆菌E69是一种潜在的、有效的生防菌株,具有防治稻瘟病、纹枯病、叶枯病、炭疽病、灰霉病、土传病害和烟草黑胫病等多种真菌病害的潜力。
[1] DAGDAS Y F, YOSHINO K, DAGDAS G, RYDER L S, BIELSKA E, STEINBERG G, TALBOT N J. Septin-mediated plant cell invasion by the rice blast fungus,e., 2012, 336(6088): 1590-1595.
[2] HUANG J, SI W, DENG Q, LI P, YANG S. Rapid evolution ofgenes in rice blast fungus., 2014, 15: 45.
[3] CHAIHARN M, CHUNHALEUCHANON S, LUMYONG S. Screening siderophore producing bacteria as potential biological control agent for fungal rice pathogens in Thailand., 2009, 25(11): 1919-1928.
[4] MENG X K, YU J J, YU M N, YIN X L, LIU Y F. Dry flowable formulations of antagonisticstrain T429 by spray drying to control rice blast disease., 2015, 85: 46-51.
[5] 沙月霞,曾庆超, 王昕, 沈瑞清, 刘浩, 王喜刚. 防治稻瘟病芽胞杆菌的筛选及效果评价. 中国生物防治学报, 2018, 34(3): 414-422.
SHA Y X, ZENG Q C, WANG X, SHEN R Q, LIU H, WANG X G. Screening and control efficiency evaluation ofagainst rice blast., 2018, 34(3): 414-422. (in Chinese)
[6] 刘诗胤. 生防菌MF-91对水稻主要病害防治效果、根际微生物多样性及稻米品质的影响[D]. 杭州: 杭州师范大学, 2012.
LIU S Y. Effects of biocontrol bacteria MF-91 on the control efficiency of main diseases, rhizosphere microbial diversity and rice quality of[D]. Hangzhou: Hangzhou Normal University, 2012. (in Chinese)
[7] RAIS A, SHAKEEL M, MALIK K,HAFEEZ F Y, YASMIN H, MUMTAZ S, HASSAN M N. Antagonisticspp. reduce blast incidence on rice and increase grain yield under field conditions., 2018, 208: 54-62.
[8] SAIKIA R, GOGOI D K, MAZUMDER S, YADAV A, SARMA R K, BORA T C, GOGOI B K.strain BPM3, a potential biocontrol agent isolated from a natural hot water spring of Assam, India., 2011, 166(3): 216-225.
[9] 沙月霞, 王琦, 李燕. 稻瘟病生防芽胞杆菌的筛选及防治效果. 中国生物防治学报, 2016, 32(4): 474-484.
SHA Y X, WANG Q, LI Y. Screening and prevention ofbiocontrol against rice blast., 2016, 32(4): 474-484. (in Chinese)
[10] TAGHAVI S, GARAFOLA C, MONCHY S, NEWMAN L, HOFFMAN A, WEYENS N, BARAC T, VANGRONSVELD J, VAN DER LELIE D. Genome survey and characterization of endophytic bacteria exhibiting a beneficial effect on growth and development of poplar trees., 2009, 75(3): 748-757.
[11] PRASANNA R, NAIN L, PANDEY A K, SAXENA A K. Microbial diversity and multidimensional interactions in the rice ecosystem., 2012, 58(7): 723-744.
[12] TANG Q, PURI A, PADDA K P, CHANWAY C P. Biological nitrogen fixation and plant growth promotion of lodgepole pine by an endophytic diazotrophand its GFP-tagged derivative., 2017,95(6): 611-619.
[13] JI S H, GURURANI M A, CHUN S C.Isolation and characterization of plant growth promoting endophytic diazotrophic bacteria from Korean rice cultivars., 2014, 169(1): 83-98.
[14] OWNLEY B H, GWINN K D, VEGA F E. Endophytic fungal entomopathogens with activity against plant pathogens: ecology and evolution., 2010, 55(1): 113-128.
[15] LIU Y, BAI F R, LI N, WANG W P, CHENG C. Identification of endophytic bacterial strain RSE1 from seeds of super hybrid rice Shenliangyou 5814 (L.) and evaluation of its antagonistic activity., 2017, 82(3): 403-408.
[16] SHYLLA A, SHIVAPRAKASH M K, SHASHIDHAR H E, VISHWAKARMA P, SUDRADHAR M. Production of phytohormones by endophytic bacteria isolated from aerobic rice., 2016, 10(3): 2127-2133.
[17] SHAHZAD R, WAQAS M, KHAN A L, AL-HOSNI K, KANG S M, SEO C W, LEE I J. Indoleacetic acid production and plant growth promoting potential of bacterial endophytes isolated from rice (L.) seeds., 2017, 68(2): 175-186.
[18] 杨波, 陈晏, 李霞, 任承钢, 戴传超. 植物内生菌促进宿主氮吸收与代谢研究进展. 生态学报, 2013, 33(9): 2656-2664.
YANG B, CHEN Y, LI X, REN C G, DAI C C. Research progress on endophyte-promoted plant nitrogen assimilation and metabolism., 2013, 33(9): 2656-2664. (in Chinese)
[19] RANGJAROEN C, RERKASEM B, TEAUMROONG N, SUNGTHONG R, LUMYONG S. Comparative study of endophytic and endophytic diazotrophic bacterial communities across rice landraces grown in the highlands of northern Thailand., 2014, 196(1): 35-49.
[20] PHAM V T K, REDIERS H, GHEQUIRE M G K, NGUYEN H H, DE MOT R, VANDERLEYDEN J, SPAEPEN S. The plant growth-promoting effect of the nitrogen-fixing endophyteA15., 2017, 199(3): 513-517.
[21] SHAHZAD R, KHAN A L, BILAL S, WAQAS M, KANG S M, LEE I J. Inoculation of abscisic acid-producing endophytic bacteria enhances salinity stress tolerance in., 2017, 136: 68-77.
[22] KLAYRAUNG S, NIAMSUP P, POONNOY P, TOPOONYANONT N. Diversity and control of bacterial contamination of plants propagated in temporary immersion bioreactor system., 2017, 1155: 439-446.
[23] XU T, LI Y, ZENG X D, YANG X L, YANG Y Z, YUAN S S, HU X C, ZENG J R, WANG Z Z, LIU Q, LIU Y Q, LIAO H D, TONG C Y, LIU X M, ZHU Y H. Isolation and evaluation of endophyticOsiSh-2 with potential application for biocontrol of rice blast disease., 2017, 97(4): 1149-1157.
[24] DEFEZ R, ANDREOZZI A, BIANCO C. The overproduction of indole-3-acetic acid (IAA) in endophytes upregulates nitrogen fixation in both bacterial cultures and inoculated rice plants., 2017, 74(2): 441-452.
[25] JHA Y, SUBRAMANIAN R B. Endophyticshows better response against thethan a rhizosphericin(rice).
[26] Zhu X J, Hu Y F, Chen X, Wang Y H, Fang W P, Li X H. Endophytic fungi fromshow an antimicrobial activity against the rice blast pathogen., 2014, 83: 57-63.
[27] 李永刚, 宋兴舜, 赵雪莹, 马凤鸣. 生防枯草芽孢杆菌L1特性的初步研究. 植物保护, 2008, 34(1): 57-61.
LI Y G, SONG X S, ZHAO X Y, MA F M. Preliminary characterization ofstrain L1., 2008, 34(1): 57-61. (in Chinese)
[28] 王光华, RAAIJMAKERS J M. 生防细菌产生的拮抗物质及其在生物防治中的作用. 应用生态学报, 2004, 15(6): 1100-1104.
WANG G H, RAAIJMAKERS J M. Antibiotics production by bacterial agents and its role in biological control., 2004, 15(6): 1100-1104. (in Chinese)
[29] PALAZZINI J M, DUNLAP C A, BOWMAN M J, CHULZE S N.RC 218 as a biocontrol agent to reducehead blight and deoxynivalenol accumulation: Genome sequencing and secondary metabolite cluster profiles., 2016, 192: 30-36.
[30] 宗英, 赵月菊, 刘阳, 杨庆利. 一株贝莱斯芽孢杆菌抑制禾谷镰刀菌的研究. 核农学报, 2018, 32(2): 310-317.
ZONG Y, ZHAO Y J, LIU Y, YANG Q L. Study on the inhibitory effect ofon., 2018, 32(2): 310-317. (in Chinese)
[31] 孙平平, 崔建潮, 贾晓辉, 王文辉. 贝莱斯芽孢杆菌L-1 对梨灰霉和青霉病菌的抑制作用评价及全基因组分析. 微生物学报, 2018, 58(9): 1637-1646.
SUN P P, CUI J C, JIA X H, WANG W H. Complete genome analysis ofL-1 and its inhibitory effect on pear gray and blue mold., 2018, 58(9): 1637-1646. (in Chinese)
[32] SHAN H Y, ZHAO M M, CHEN D X, CHENG J L, LI J, FENG Z Z, MA Z Y, AN D R. Biocontrol of rice blast by the phenaminomethylacetic acid producer ofstrain BC79., 2013, 44: 29-37.
[33] SHA Y X, WANG Q, LI Y. Suppression ofand interaction betweenand rice plants in the control of rice blast., 2016, 5(1): 1238.
[34] 徐婷, 朱天辉, 李姝江, 谯天敏. 贝莱斯芽孢杆菌YB15-葡聚糖酶的抑菌作用与基因克隆. 中国生物防治学报, 2014, 30(2): 276-281.
XU T, ZHU T H, LI S J, QIAO T M. Fungus-inhibitory activity and gene cloning of-glucanase fromYB15., 2014, 30(2): 276-281. (in Chinese)
[35] 李湘民, 许志刚, MEW T W. 稻株上拮抗细菌的定殖及其对土著细菌的影响. 生态学报, 2008, 28(8): 3868-3874.
LI X M, XU Z G, MEW T W. Colonization of antagonistic bacteria on rice plants and their influence on native bacteria., 2008, 28(8): 3868-3874. (in Chinese)
[36] 赵达, 傅俊范, 裘季燕, 刘伟成. 枯草芽孢杆菌在植病生防中的作用机制与应用. 辽宁农业科学, 2007(1): 46-48.
ZHAO D, FU J F, QIU J Y, LIU W C. Bio-control mechanism and application ofin plant disease., 2007(1): 46-48. (in Chinese)
[37] RENGPIPAT S, WONGTANGPRASERT N, PALAGA T. The use of green fluorescent protein as a marker for monitoring a probioticS11 in the black tiger shrimp,2009, 15(3): 297-305.
[38] PADDA K P, PURI A, ZENG Q W, CHANWAY C P, WU X Q. Effect of GFP-tagging on nitrogen fixation and plant growth promotion of an endophytic diazotrophic strain of., 2017, 95(9): 933-942.
[39] ZIMMER M. Green fluorescent protein (GFP): application, structure, and related photophysical behavior., 2002, 102(3): 759-781.
[40] LIU X M, ZHAO H X, CHEN S F. Colonization of maize and rice plants by strainC4., 2006, 52(3): 186-190.
[41] NG L C, SARIAH M, SARIAM O, RADZIAH O, ZAINAL ABIDIN M A. Bio-efficacy of microbial-fortified rice straw compost on rice blast disease severity, growth and yield of aerobic rice., 2012, 41(5): 541-549.
[42] KANJANAMANEESATHIAN M, CHUMTHONG A, PENGNOO A, WIWATTANAPATAPEE R.suppresses major Thailand rice diseases., 2009, 2(Special Issue): S154-S159.
[43] KYUNG-SEOK P, DIBY P, WAN-HAE Y.EXTN-1-mediated growth promotion and disease suppression in rice., 2006, 22(3): 278-282.
Biocontrol Potential ofStrain E69 Against Rice Blast and Other Fungal Diseases
SHA YueXia1, SUI ShuTing2, ZENG QingChao2, SHEN RuiQing1
(1Institute of Plant Protection, Ningxia Academy of Agriculture and Forestry Sciences, Yinchuan 750011;2College of Plant Protection, China Agricultural University, Beijing 100193)
【】The objective of this study is to clarify the antagonistic effect ofstrain E69 isolated from rice endophytic bacteria against various fungal plant pathogens, especially the control efficacy ofE69 on rice blast, and to reduce the use of chemical pesticides.【】E69 and(most commonly used microorganisms in biological control of rice blast) E66 strains were isolated from endophytic bacteria of rice leaf tissue. The antagonistic effect of strains E69 and E66 and their fermented liquid, sterile supernatant againstwas tested by confrontation culture method. Also, the antagonistic effect of strains E69 and E66 against other 11 pathogenic fungi, such as,spp.,,,var.,,,., was determined. The preventive efficacy of E69 and E66 was tested for the control of rice leaf blast under greenhouse condition. The field experiments were conducted to evaluate the preventive efficacy of E69 and E66 against rice leaf blast and neck blast. The inhibitory effect of E69 and E66 against conidial germination and appressorial formation ofwas assessed in laboratory. The colonization of gfp-marked strain E69 in rice stem was observed by laser scanning confocal microscope.【】Strains E69 and E66 significantly suppressed the mycelia growth rate ofP131, the preventive efficacy against rice blast under greenhouse condition was 83.24% and 76.57%, respectively. The preventive efficacy of E69, E66 against rice leaf blast and neck blast in field was 85.97%, 79.76% and 69.67%, 68.82%, respectively. The preventive effect of E69 on leaf blast was significantly higher than that of 75% tricyclozole wettable powder, but there was no significant difference between the preventive efficacy of strain E69 and 75% tricyclazole powder against rice neck blast. E69 and E66 had significant antagonistic effects against 11 plant pathogens, such as,spp.,,,var.,,,. The antagonistic effect of E69 was higher than that of E66. E69 and E66 could strongly inhibit the conidial germination and appressorial formation ofP131, the inhibitory effect of E69 fermented liquid was 95.28% and 94.16%, respectively, and the inhibitory effect of E69 sterile supernatant was 85.36% and 84.31%, respectively. The inhibitory effect of E66 fermented liquid was 89.15% and 87.38%, respectively, and the inhibitory effect of E66 sterile supernatant were 79.65% and 72.45%, respectively. The gfp-marked strain E69 showed good colonization ability in rice stem, and could be stably colonized in rice stem epidermis, parenchyma and vascular bundles. 【】strain E69 is a potential biocontrol strain with obvious preventive effects, which has the application potential of preventing rice blast, sheath blight and other fungal diseases.
; rice blast; plant pathogenic fungi; biological control; colonization ability
10.3864/j.issn.0578-1752.2019.11.006
2019-01-29;
2019-03-11
宁夏农林科学院科技先导资金项目(NKYJ-16-26)、国家重点研发计划(2017YFD0201606)、宁夏回族自治区重点研发计划(2018BBF02018-06)、宁夏农林科学院全产业链创新示范项目(QCYL-2018-09)
沙月霞(通信作者),E-mail:yuexiasha@126.com
(责任编辑 岳梅)

