海洋细菌低温葡萄糖氧化酶基因克隆及其在大肠杆菌中的表达
刘春莹,胡善松,张庆芳,李美玉,于爽,迟乃玉*
1(大连大学 生命科学与技术学院,辽宁 大连,116622) 2(辽宁省海洋微生物工程技术研究中心,辽宁 大连,116622)
葡萄糖氧化酶(glucose oxidase, GOD)的系统名称为β-D-葡萄糖氧化还原酶(E.C.1.1.3.4)[1],最先于1904年在黑曲霉和灰绿青霉中发现[2-4]。它能够催化β-D-葡萄糖被氧化成葡萄糖酸-δ-内酯,进而被水解成葡萄糖酸,并生成过氧化氢[5]。因此,GOD因其具有脱氧和防腐的功能,而应用在食品保鲜方面。GOD还具有消除肠道病原菌、解除肠道霉菌毒素中毒、改善肠道酸性消化环境、保护肠道上皮完整的功能[6-7],被广泛应用在畜牧业和养殖业[8-9]。由于GOD的专一氧化葡萄糖的特性,在生物传感器、医学检验等领域是重要分析用酶[10-13]。
野生菌株中GOD活力较低,利用基因工程进行改造成为一种有效的手段。20世纪KOVACEVIC等[14]与GUO等[15]在毕赤酵母中成功表达黑曲霉GOD。PULCI等[16]也将青霉GOD的基因成功克隆到酵母中并实现表达。随着GOD需求的增加,我国相关研究也逐渐增多。周亚凤等[17]将黑曲霉GOD基因克隆到酵母中并高效表达。高庆华等[18]也将青霉GOD基因克隆到酵母中并表达。大肠杆菌一直作为外源蛋白表达的首选系统[19],但很少应用在GOD外源表达方面。现有报道仅WITT等[20]及顾磊等[21]尝试在大肠杆菌中表达黑曲霉GOD。细菌与大肠杆菌的同源性更高,可能更适合在大肠杆菌中表达,但此类的研究此前未见报道。
本研究以海洋细菌Citrobacterssp. 8-III为出发菌株,采用E.coliBL21(DE3)为表达宿主,构建GOD高产大肠杆菌工程菌株,实现GOD在大肠杆菌中的高效表达,并对重组GOD酶学性质进行分析。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
Citrobacterssp. 8-III:辽宁省海洋微生物工程中心提供(分离自大连渤海海域,深度约30 m的海泥中。);E.coliDH5ɑ:构建和克隆目的基因;E.coliBL21(DE3):表达宿主;质粒pMD9-T:克隆载体;质粒pET-28a(+):表达载体。
1.1.2 试剂与仪器
PCR相关试剂、克隆相关试剂和限制性内切酶:Takara公司;PCR产物纯化试剂盒等:上海生工生物有限公司;琼脂糖、辣根过氧化物酶和邻联茴香胺等试剂:Sigma公司。
PCR仪和电转化仪,Eppendorf公司;Multiskan1510酶标仪,Thermo Fisher Scientific;LDZX-40BI立式压力蒸汽灭菌锅,上海申安医疗器械厂;LTI-700恒温培养箱,上海爱郎仪器有限公司;HZP-250全温振荡培养箱,上海精宏实验设备有限公司;HD-1360 超净工作台,北京东联哈尔仪器制造有限公司;AL-204电子天平,梅特勒-托利多仪器有限公司;RDY-SP1Z型核酸电泳仪,北京荣阳静电科技有限公司
1.1.3 培养基
LB培养基:10 g/L NaCl、5 g/L酵母提取物、10 g/L蛋白胨;种子培养基:10 g/L蛋白胨、5 g/L牛肉膏、10 g/L NaCl;发酵培养基:60 g/L葡萄糖、3 g/L蛋白胨、2 g/L K2HPO4、0.7 g/L MgSO4、0.5 g/L KCl、4 g/L NaNO3,pH 6.5。
1.2 实验方法
1.2.1 菌株8-III GOD基因的获取
挑取菌株8-III的单菌落于8 mL种子培养基,于25 ℃下160 r/min振荡培养48 h,以2%的接种量接种到含有100 mL种子培养基的250 mL摇瓶中,160 r/min,25 ℃摇床中培养48 h。取2 mL的菌液于8 000 r/min离心,去掉上清液,用PBS洗涤2次,再次离心收集菌体。利用基因组大量提取试剂盒(powermax TMSoil DNA isolation kit)提取基因组DNA。所提DNA送到北京百迈克生物科技有限公司进行DNA质量检测,并使用Illumina Hiseq X10高通量测序平台进行双端测序(PE150),得基因组草图。对测序数据过滤低质量后,利用Velvet软件[18]进行初步组装,得到最终基因组框架图(draft genome)。根据GenBank公布GOD基因序列通过BLAST比对确定目的基因。交由Synbio Technologies公司对8-III菌株的GOD基因进行基因全长合成,并构建于克隆载体pMD-9-T,命名pMD-9-T-GOD。
1.2.2 目的基因的克隆
5′端引物序列P1为:5′-ATGAAGTCCACTATTATCACCTCCA-3′,其3′端引物序列P2为:5′-CTAGGCACTTTTGGCA-TAGTCTTCA-3′,用这对引物以pMD-9-T-GOD为模板进行PCR扩增。反应体系为50 μL:基因组DNA 100 ng,引物各0.2 μmol/L,dNTPs 250 μmol/L,5×Q5高保真DNA聚合酶缓冲液10 μL,Q5高保真DNA聚合酶0.5 μL。PCR反应条件:98 ℃、5 min;98 ℃、 30 s,65 ℃、30 s,72 ℃、60 s,共30个循环;72 ℃、10 min。PCR产物于1%琼脂糖凝胶上电泳鉴定纯度和分子量的大小。PCR产物经DNA回收试剂盒回收。
1.2.3 原核表达载体的构建
将pET-28a(+)用NcoⅠ和XhoⅠ进行双酶切,与目的基因连接,重组质粒命名为pET-28a(+)-GOD。该表达质粒的构建方式删除了pET-28a(+)质粒载体上的全部标签,可用来构建无标签的基因表达工程菌。将该表达质粒转化至E.coliBL21(DE3)感受态细胞,阳性的转化菌命名为E.coliBL21(DE3)/pET-28a(+)-GOD。送至Synbio Technologies公司测序验证,保存测序正确的菌株。
1.2.4 目的蛋白的诱导表达与纯化
将E.coliBL21/pET-28a(+)-GOD接种于10 mL含卡那霉素的LB液体培养基中,160 r/min,25 ℃,过夜培养。取上述菌液按2%接种量接种于100 mL含卡那霉素的LB液体培养基中,160 r/min,25 ℃培养4 h,加入IPTG诱导表达。收集菌体发酵液于10 000 r/min,4 ℃,离心20 min,弃上清。菌体沉淀以pH 7.4的PBS洗涤,重复洗涤3次。洗涤后用10 mL的PBS重悬。将重悬液超声裂解15 min(开3 s,间隔5 s,功率200 W)。将裂解液以10 000 r/min,4 ℃,离心20 min,上清液为粗酶液。粗蛋白用Ni2+-NTA柱(Novagen)进行亲和层析纯化,洗脱的蛋白液4 ℃保存,蛋白样品经变性聚丙烯酰胺凝胶电泳(SDS-PAGE)检测,同时以空载体和未诱导作对照,记录并分析结果。
1.2.5 酶活力测定[22]
于96孔板中依次加入5%葡萄糖溶液150 μL,邻联茴香胺溶液150 μL,辣根过氧化物酶溶液10 μL,25 ℃反应10 min,加入待测液10 μL。酶标仪波长460 nm,每间隔1 min测定1次,共测定5次。以在25 ℃,pH 6.5的磷酸缓冲溶液的反应条件下,每分钟将1 μmol的葡萄糖催化氧化为葡萄糖酸和过氧化氢所需要的GOD的量定义为1个GOD的活力单位。根据公式计算酶活[19]。
1.2.6 酶学性质研究
温度对重组GOD影响:将适当稀释的酶液分别在15、20、25、30、35、40、45、50、55、60和65 ℃下进行反应,以酶活最高者为100%计算相对酶活,从而确定该酶的最适作用温度。将适当稀释的酶液分别放到0、10、20、30、40、50和60 ℃下保温1 h,每隔30 min取样,在冰上放置5 min后进行酶活测定。以未进行热处理的酶液的酶活为100%计算相对酶活,确定重组GOD的热稳定性。
pH值对重组GOD影响:配制pH值分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的PBS缓冲体系,将酶液分别用这些缓冲液稀释后进行反应,以酶活最高者为100%计算相对酶活,从而确定GOD酶的最适pH值。分别将酶液在pH值为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5和10.0的PBS缓冲液中保温30 min(温度为25 ℃),以未经保温处理的酶活为100%计算残余酶活力,从而确定GOD酶的pH稳定性。
金属离子对酶活影响:在GOD酶与其底物进行反应的体系中,加入Na+、K+、Ca2+、Mg2+、Fe2+、Cu2+、Mn2+、Fe3+、Zn2+、Ba2+及乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA),使其终浓度为0.35 mmol/L,然后按照1.2.5的方法进行酶活测定。以不加金属离子的反应体系的酶活定义为100%,表示不同金属离子或化合物下的相对酶活。
1.2.7 鸡饲料的应用
将重组GOD纯化后与SiO2以4∶1比例复配后,以0.05%加入鸡饲料中,喂养A组雏鸡;只加入GOD未与SiO2复配的鸡饲料喂养B组雏鸡;以未加入GOD的鸡饲料喂养C组雏鸡。每组12只,喂养14 d,记录平均每日增重、平均每日摄取量、饲料利用率和腹泻率。
1.2.8 幼犬饲料保鲜
将重组GOD纯化后与SiO2以4∶1比例复配后,以0.05%加入幼犬饲料中,为实验组A;以陆生霉菌GOD与SiO2以4∶1比例复配后,以0.05%加入幼犬饲料中,为实验组B;以未加入GOD的幼犬饲料为实验组C。每组50份0.5 kg饲料,4 ℃储藏14 d,记录饲料霉变情况。
2 结果与分析
2.1 目的基因PCR扩增
以pMD-9-T-GOD为模板PCR扩增GOD基因,见图1。

M-DNA Marker;1~4-PCR扩增产物图1 目的基因克隆PCR电泳检测结果Fig.1 PCR assay of the targetgene
目的基因条带单一、浓度较高。经测序其全长为1 292 bp,提交至Genbank所获序列登录号是MK054202,与Genbank中其他GOD基因序列的相似度在92%~98%,预期能够编码含有428个氨基酸残基的蛋白质。对序列进行分析,发现序列中不含有内含子和基因原有的信号肽序列,不含有SacⅠ、NotⅠ和SnabⅠ酶切位点,含有NcoⅠ和XhoⅠ酶切位点,符合之前的预测。
2.2 重组表达载体的构建
分别用NcoⅠ和XhoⅠ对pET-28a-GOD做分步酶切,预期得到大小分别为5.4 kb的载体片段和1.3 kb的目的基因片段。通过1%琼脂糖凝胶电泳对双酶切产物进行检验,结果见图2。泳道1为重组质粒的酶切鉴定结果,大小与预期结果一致,将鉴定正确的质粒进行测序,最终确定重组表达质粒pET28a-GOD。

M-DNA Marker;1-酶切处理的质粒;2-质粒DNA图2 重组质粒pET-28a-GOD的酶切鉴定Fig.2 Restriction pattern of recombinant pET-28a-GOD
2.3 诱导表达与纯化
将经鉴定正确的原核重组表达质粒载体pET28a-GOD转化至表达宿主菌E.coliBL21(DE3)中诱导表达。通过SDS-PAGE分析目标蛋白表达情况。加入IPTG后成功诱导外源蛋白的表达。以没有装载GOD的E.coliBL21/pET28a菌体作为对照,在E.coliBL21/pET28a-GOD菌体裂解液全菌、上清液和沉淀的约46 kDa位置出现一条蛋白带(图3),该蛋白带分子质量与重组GOD的理论分子质量(46 kDa)相一致,由此推测该蛋白带为诱导表达的GOD。此外,由图(图3泳道2)可见菌体裂解后的可溶部分也检测到GOD蛋白条带,说明克隆菌株不仅能有效表达GOD,而且重组GOD为可溶性表达。
2.4 NI+-NTA柱亲和纯化
通过Ni+-NTA亲和层析柱进行GOD纯化,SDS-PAGE检测洗脱收集液,如图4所示。目标蛋白被150 mmol/L和200 mmol/L咪唑溶液洗脱下来,大小在46 kDa左右,且洗脱液中杂蛋白较少。
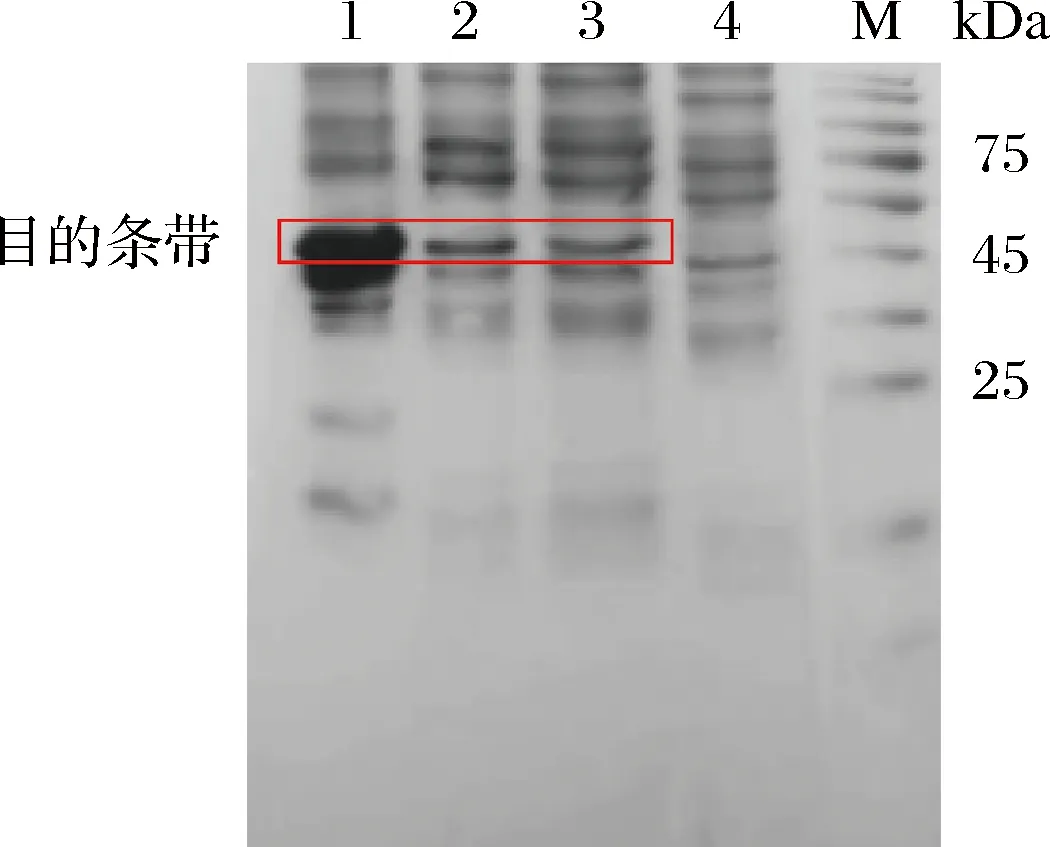
M-标准蛋白;1-E. coli BL21/pET28a-GOD菌体裂解液沉淀;2-E. coli BL21/pET28a-GOD菌体裂解液上清液;3-E. coli BL21/pET28a-GOD菌体裂解液全液;4-E. coli BL21/pET28a(+)菌体裂解液上清液图3 目的蛋白GOD的SDS-PAGE检测结果Fig.3 SDS-PAGE analysis of GOD protein

M-蛋白质分子量标准;1-150 mmol/L咪唑溶液洗脱目标蛋白;2-200 mmol/L咪唑溶液洗脱目标蛋白图4 纯化后E. coli BL21/pET28a-GOD的SDS-PAGEFig.4 SDS-PAGE of E. coli BL21/pET28a-GOD after purification
2.5 酶学性质分析
2.5.1 酶最适作用温度
将重组GOD在10~60 ℃处理5 min,结果如图5-a所示。酶的最适反应温度为25 ℃,20~35 ℃相对酶活可以保持在80%以上,40 ℃后相对酶活快速降低。此外该酶在0 ℃时可保持50%相对酶活,符合海洋细菌低温酶特性,在较短的时间产生大量GOD。如图5-b所示,10~35 ℃时,相对酶活可保持80%以上,表明在该温度范围内酶的温度稳定性良好,其中25 ℃酶活最稳定,相对酶活保持在90%以上,40 ℃后稳定性迅速下降。该酶在0 ℃时可保持60%以上酶活力且稳定性快速提升,10 ℃后可达到60%以上酶活力,说明该酶具有低温酶特性,且温度稳定性良好。

a-酶最适作用温度;b-酶的温度稳定性图5 温度对酶活影响Fig.5 Effect of temperature on enzyme activity
2.5.2 酶最适作用pH
如图6-a所示,重组GOD的最适pH值为6.0,在pH值为5.5~6.5时,保持85%以上的相对酶活,表明该酶属于偏酸性GOD。如图6-b所示,该酶在pH 6.5时稳定性最好,在pH 6.0~7.0时相对酶活可保持80%以上,pH 7.5以后稳定性快速降低。推测GOD中可能存在酸性基团,碱性条件下不能稳定存在。在pH 7.5以上会产生结构变化,影响酶活。

a-最适pH值; b-pH稳定性图6 pH对酶活影响Fig.6 Effect of pH on enzyme activity
2.5.3 金属离子及螯合剂对酶活的影响
由图7可知,K+、Ni2+对重组GOD的活性有明显促进作用;Na+、Zn2+、Fe3+、Cu2+、Ag+、Ca2+、Fe2+、Mg2+和EDTA对GOD活性有抑制作用,其中Cu2+、Ag+、Ca2+、Fe2+和Mg2+严重抑制重组GOD酶活性。推测这可能是由于这些离子与酶中心的功能基团结合,进而引起酶失活。

图7 金属离子及螯合剂对酶活力的影响Fig.7 Effects of metalions and chelating agents on enzyme activity
2.6 鸡饲料中应用
将重组GOD添加到鸡饲料中,饲养结果如表1所示。A组雏鸡的平均日增和饲料利用率重要大大高于B、C两组,其中B组又比C组要高。腹泻率C组最高,A组最低。结果表明,重组GOD可以通过改善肠道菌群提升对饲料的有效吸收,从而提升鸡体重。此外,重组GOD需要与相应载体联合使用,单独使用重组GOD效果并不理想。
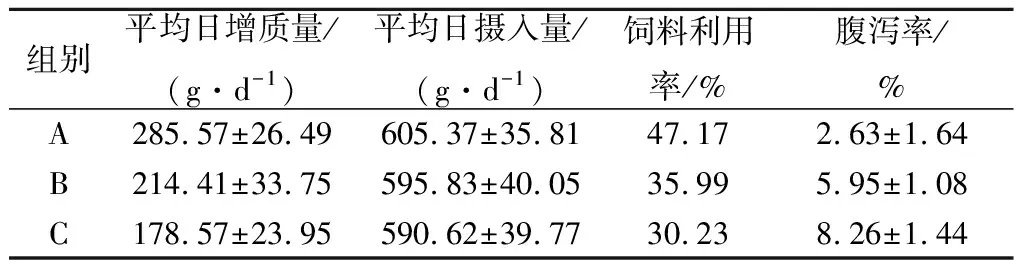
表1 重组GOD在鸡饲料中应用Table 1 Application of recombinant GOD in chicken feed
2.7 幼犬饲料中应用
重组GOD添加到幼犬饲料中,结果如图8所示。A组的霉变情况最好,C组最差,B组稍好于C组。说明重组GOD确实具备防腐的作用,并且在低温环境也能有很好的作用,这是陆地来源GOD所不具备的。

图8 幼犬饲料霉变情况Fig.8 Mildew of puppy feed
3 结论
GOD是一种重要的应用酶,国内外学者在其外源表达方面已进行大量研究[22-26]。葡萄糖氧化酶最适作用温度为40~45 ℃,在35~50 ℃酶活稳定,属于中高温酶。本文首次尝试将海洋细菌GOD基因在大肠杆菌中表达,并将酶活提升2.72倍。重组GOD分子质量为46 kDa,在25 ℃,pH 6.5的环境下酶活最高,10~20 ℃酶活保持稳定。结果表明,重组GOD具备低温酶特性,可以填补传统陆地来源GOD在饲料保鲜等方面的不足。此外大肠杆菌可用于细菌GOD外源表达。同时,克隆菌株自身具有培养条件简单经济、生长繁殖快速、蛋白表达水平高等优势、遗传背景清晰、基因改造工具多样等特点[15],与工业生产相契合。
将重组GOD添加到动物饲料中,可起到防腐作用,并提升饲料利用率。重组GOD通过杀灭或抑制病原微生物的生长繁殖维持动物肠道菌群平衡,自身及代谢产物对动物和环境均无毒副作用,且不易诱发耐药菌产生,也不易诱发交叉耐药菌的产生,具备加工为饲料添加剂的潜力。此外,已报到的GOD饲料添加剂绝大多数自身不具备防腐功效[27-28],重组GOD的低温酶特性,可填补传统GOD在低温领域的空白。在食品保鲜与以低温检测方面有良好的应用前景。

