嗜热拟青霉糖化酶的性质及其在黄酒酿造中的应用
刘双平,谢雅茜,江正强,闫巧娟,毛 健,4
(1.江南大学食品学院粮食发酵工艺与技术国家工程实验室,江苏无锡 214122;2.中国农业大学工学院,北京100083;3.中国农业大学食品科学与营养工程学院,北京100083;4.浙江古越龙山绍兴酒股份有限公司,国家黄酒工程技术研究中心,浙江绍兴 312000)
黄酒是世界三大古酒之一,经过制曲、浸米、蒸 煮、前酵、后酵、压榨、澄清、煎酒、陈化、勾兑等生产工艺酿造而成,黄酒除饮用外,也可用作食醋酿造的原料。传统黄酒制作过程中通过加入麦曲形成复杂的微生物群落结构和多酶复合体系(α-淀粉酶[1]、糖化酶[2]、普鲁兰酶[3]、蛋白酶[4]、纤维素酶[5]、脂肪酶[6-7]),从而降解原料中的蛋白质、淀粉、脂肪、粗纤维等成分为细胞所利用,但是由于麦曲质量不稳定、发酵控制不系统等因素会导致黄酒发酵速率缓慢,从而会影响出酒率及黄酒的品质,甚至出现酸败现象。
随着酿酒科学技术的进步,科研人员对黄酒酿造过程的深入研究,黄酒酿造工艺得到大幅改进,特别是酶制剂在黄酒生产中的应用,使得黄酒的品质得到大幅提升[8-9]。而糖化酶在黄酒生产中的应用则恰好弥补了传统工艺中的不足之处,解决了麦曲中酶系和微生物产糖化酶活力不足的问题。在减少麦曲用量的同时,使原料的糖化速率不会降低,在降低成本的同时又很好的保证了出酒率和黄酒的品质。因此,寻找新型糖化酶用于黄酒酿造具有重要价值。
糖化酶[EC 3.2.1.3]即葡萄糖淀粉酶,属于酸性单链糖苷水解酶,具外切酶活性。该酶能水解淀粉、糊精、糖原等碳水化合物非还原末端的α-1,4-糖苷键生成β-D-葡萄糖,同时也能缓慢水解α-1,6-葡萄糖苷键、少量α,β-(1,1)-、α-(1,2)-键和极少量α-1,3-键[10],在黄酒生产中有广泛的应用[11-12]。团队前期研究中筛选到1株能够产糖化酶的嗜热拟青霉(Paecilomyces thermophila)J18,并在毕赤酵母中对该糖化酶进行了过量表达。本文将对表达得到的嗜热拟青霉来源糖化酶(PtGA15)的酶学性质做进一步探究,并考察其在黄酒酿造中的应用价值。
1 材料与方法
1.1 材料、试剂
原料:糯米,购自超市。
糖化酶PtGA15:嗜热拟青霉(P.thermophila)J18来源,毕赤酵母表达;分子量67 kDa,比酶活148.5 U/mg。
麦曲:上海金枫酒业股份有限公司。
活性干酵母:安琪酵母股份有限公司。
α-淀粉酶:樟绒枝霉来源,毕赤酵母表达,实验室分离纯化保存;酶活11895 U/g,最适pH 6.5,最适温度65℃,50℃以下能保持90%以上酶活力,pH5~10内稳定。
其他试剂:分析纯,国药集团化学试剂有限公司。
1.2 仪器和设备
TU-1800PC紫外-可见分光光度计,北京普析通用仪器设备有限责任公司;HZQ-F-160全温振荡培养箱,江苏太仓实验设备厂;LRH-250S恒温恒湿培养箱,上海一恒科学仪器有限公司;HWS24型电热恒温水浴锅,上海一恒科学仪器有限公司;HGJR-02红外加热炉,河南中良科学仪器有限公司;PB21型pH计,德国赛多利斯公司。
1.3 试验方法
1.3.1 糖化酶(PtGA15)的酶学性质
酶活力测定方法:取13 g/L可溶性淀粉溶液(以10 mM pH 6.0的醋酸缓冲液为溶剂)0.l mL,70℃预热5 min,加入0.l mL酶液,70℃反应20 min,加入1.0 mL DNS试剂,沸水浴反应15 min,速冷,在540 nm波长下测定吸光值,0.l mL蒸馏水代替酶液做对照。酶活力定义:以1 min催化底物生成l μmol的葡萄糖所需酶量定义为一个酶活单位。
1.3.1.1 最适pH值及其稳定性
最适pH值测定:在70℃条件下,以pH值及不同体系的缓冲液(Citrate,pH3.0~6.0;Mcilvaine,pH3.0~7.0;Acetate,pH4.0~6.0;Phosphate,pH6.0~8.0;HEPES,pH7.0~8.0;Tricine,pH7.5~8.5;CHES,pH8.5~10.0)配制底物13 g/L可溶性淀粉溶液,按照标准酶活力方法测定酶活力,以酶活力最高点作为100%。
pH值稳定性:以不同pH值及不同体系的缓冲液将纯酶稀释适当倍数,40℃保温30 min,冰水浴冷却30 min后于最适pH值条件下测定酶活力,以未处理的酶液作为对照,计算残余酶活占对照的百分含量。
1.3.1.2 最适温度及热稳定性
最适温度测定:用50 mM pH 5.0 Citrate缓冲液配制底物,分别在不同温度(50~80℃)下与底物反应,按照标准方法测定糖化酶的酶活力,以酶活力最高点为100%。
热稳定性:纯酶用最适pH值体系适当稀释后于45~80℃保温30 min,冰水浴冷却30 min,采用标准方法测定酶活力,以未处理的酶液作为对照,计算残余酶活占对照的百分含量。
1.3.1.3 金属离子和化合物对酶活的影响
糖化酶于50 mM pH 5.0的Citrate缓冲液中稀释一定倍数,分别加入不同的金属离子,使其终浓度为1 mM,将酶液在25℃下保温30 min,在最适条件下测定糖化酶的残余酶活力,以没有添加金属离子及化合物的酶液作为对照。
1.3.1.4 底物特异性
分别以可溶性淀粉、糯米淀粉、大米淀粉、糖原、支链淀粉、糊精、普鲁兰糖为底物测定其底物特异性,所有底物浓度均为1.3%(w/v),反应条件为50 mM pH5.0 Citrate缓冲液,在70℃下反应20 min后测定酶活。
1.3.1.5 水解特性
将浓度为10 mg/mL的可溶性淀粉、糯米淀粉、大米淀粉、支链淀粉,溶于50 mM pH 5.0 Citrate缓冲液中,酶添加量为2.0 U/mL,60℃水浴中反应1 h,在不同时间(0、20 min、40 min和60 min)取样。TLC条件:硅胶板(60 F 254,E.Merk,德国)在正丁醇-乙醇-水系统中展层2次,在表面均匀喷洒5%硫酸甲醇溶液,吹干并在130℃显色;以麦芽寡糖混合物为标准。
1.3.2 糖化酶(PtGA15)在黄酒中的应用
采用如图1所示的黄酒酿造工艺进行黄酒发酵,并测定成品酒的理化指标。
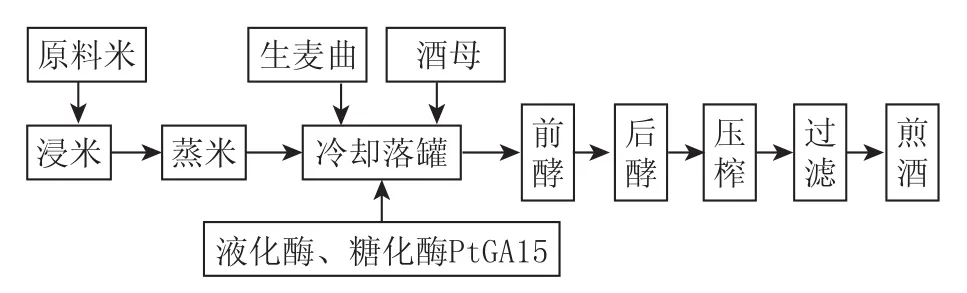
图1 糖化酶在黄酒中的应用
还原糖的测定采用DNS法[13];酒精度、总酸、氨基态氮、pH值均按照《GB/T 13662—2008黄酒》[15]中的方法测定;干物质含量的测定采用折射仪法[14],葡萄糖值(Dextrose Equivalent,DE)[16]的计算公式如下:

1.3.2.1 糖化时间对糖化效果的影响
糯米经液化处理后,迅速降温至50℃,按150 U/g原料加入糖化酶PtGA15,保温糖化,分别糖化30 min、60 min、90 min、120 min、150 min、180 min、210min、240min,取样并迅速冷却,稀释后10000r/min离心3 min取上清液,测定上清液中还原糖含量及DE值随时间的变化情况。
1.3.2.2 糖化阶段糖化温度的确定
糯米经液化处理,迅速降温至50℃,按150 U/g原料加入糖化酶PtGA15,分别在50℃、55℃、60℃下保温糖化3 h,糖化完成后迅速冷却,10000 r/min,离心3 min取上清液,并测定上清液中还原糖含量及DE值随温度的变化情况。
1.3.2.3 添加量对黄酒理化指标的影响
分别按 0、50 U/g、100 U/g、150 U/g、200 U/g、300 U/g、400 U/g原料的量添加糖化酶PtGA15进行黄酒酿造,于28~30℃前酵4 d,转15℃后酵15 d,测定最终黄酒的残糖含量、酒精度、氨基态氮、总酸等理化指标,以确定糖化酶PtGA15的最佳添加量。
2 结果与分析
2.1 糖化酶(PtGA15)的酶学性质
2.1.1 最适pH值及其稳定性
已报道的真菌来源糖化酶,多在酸性条件下保持稳定,最适pH值大多集中在4.5~6.5[17-18],pH值稳定性范围差别不大,与之前的研究相似,糖化酶PtGA15在pH4.5~6.5范围内酶活较稳定。如图2a所示,糖化酶PtGA15在pH5.0的柠檬酸缓冲液中,酶活性最高,在乙酸缓冲液中,pH5.5时酶活最高,但比在柠檬酸缓冲液中的酶活低了近10%;当pH>6时,酶活随着pH值的升高而迅速降低。酶液在pH4.5~6.5之间时稳定性最好,酶活稳定性依然是在柠檬酸缓冲液中最高,在磷酸缓冲液中次之,并且发现在此pH值范围内处理30 min后,酶活力保持在80%以上(图2b)。
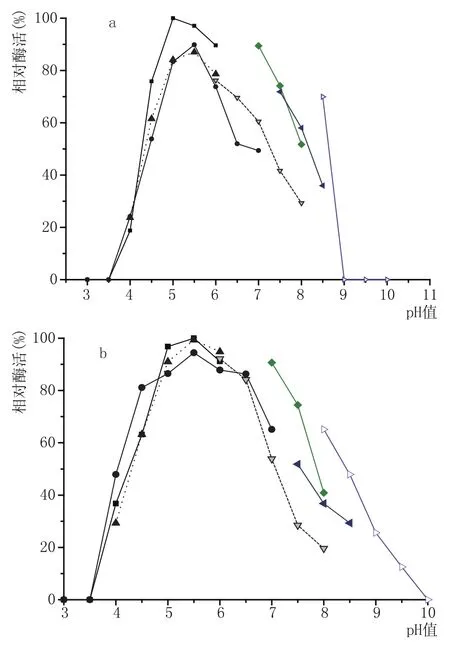
图2 糖化酶PtGA15最适pH值(a)及pH值稳定性(b)
2.1.2 最适温度和温度稳定性
多数真菌来源的糖化酶在65~70℃时酶活最高,在65℃以内都能维持较好的酶活力[17-19]。结果表明,糖化酶PtGA15最适反应温度为70℃,在65~70℃范围内表现出较高的酶活力,在70℃时能保持90%以上的酶活(图3a、图3b)。
2.1.3 金属离子及化合物对酶活力的影响(表1)
在 Marlida[20]、Kumar[21]及 Li[22]等的研究中发现,糖化酶活力对Ca2+表现出依赖性。然而,研究结果表明(表1),糖化酶PtGA15对金属离子的敏感性一般,无明显依赖性。除Li+对酶活有很弱的抑制作用外,金属离子对其酶活都有一定的提高,其中Ba2+提高效果最大,为127.2%,Mg2+次之,为125.3%。另外DTT、EDTA、SDS存在时,其酶活力未受到明显影响。
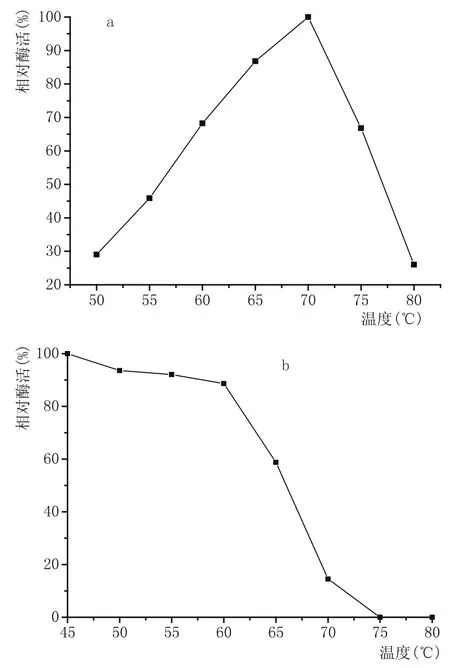
图3 糖化酶PtGA15的最适温度(a)和温度稳定性(b)
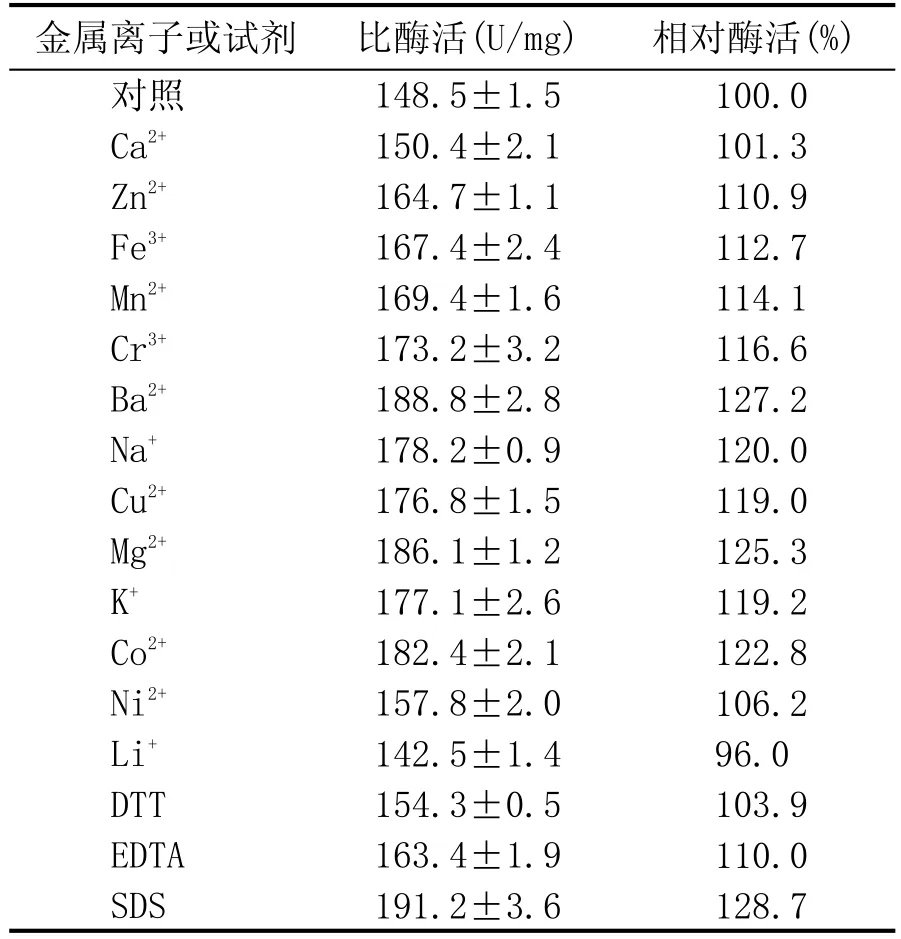
表1 金属离子及部分试剂对糖化酶PtGA15酶活的影响
2.1.4 糖化酶PtGA15的底物特异性(表2)
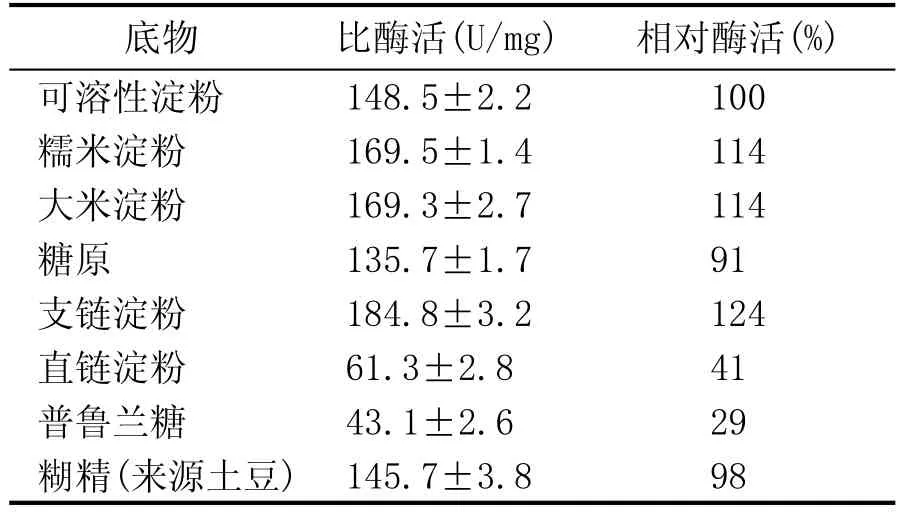
表2 糖化酶PtGA15的底物特异性
如表2所示,糖化酶PtGA15对支链淀粉表现出较高的水解活性(184.8 U/mg),糯米和大米淀粉次之(169.5 U/mg),对糖原(135.7 U/mg)的水解能力比可溶性淀粉和土豆来源的糊精略低,对可溶性淀粉和糊精的水解活性无明显差异,对普鲁兰酶的水解活性最低(43.1 U/mg)。
2.1.5 糖化酶PtGA15的水解特性分析(图4)
糖苷水解酶对底物的水解能力主要受该酶对不同糖苷键水解能力高低的影响,相比其他底物,支链淀粉有更多的非还原末端和α-1,4-糖苷键,而糖化酶主要水解α-1,4-糖苷键[10,23]。如图4所示,糖化酶PtGA15水解支链淀粉、大米淀粉、可溶性淀粉、糯米淀粉的产物通过TLC分析,发现糖化酶Pt-GA15对支链淀粉表现出较高的水解活性,对普鲁兰糖的水解活性最低,并且该酶水解各类淀粉的产物唯一,为葡萄糖;而且在反应一段时间后,当溶液中仅有葡萄糖的情况下,反应时间加长,没有其他高于葡萄糖的聚合度的高分子寡糖生成,说明该酶转糖苷能力很弱或没有。

图4 糖化酶PtGA15水解支链淀粉、大米淀粉、可溶性淀粉和糯米淀粉的TLC分析
2.2 糖化酶(PtGA15)在黄酒中的应用
2.2.1 糖化时间的优化(图5)
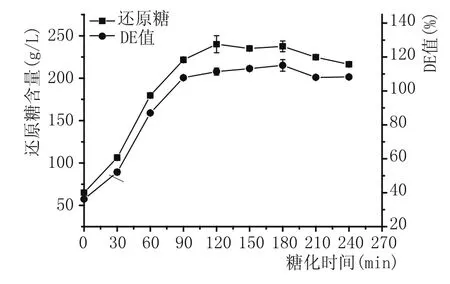
图5 糖化时间对糖化酶糖化效果的影响
由图5可看出,当糖化酶PtGA15的添加量为150 U/g原料,糖化时间为180 min时,糖化液的DE值达到最高,为115.1%,随后DE值出现一定的下降,另外还原糖含量在120 min后没有明显的增加。适量的寡糖和还原糖为酵母细胞迅速生长繁殖提供营养,综合DE值和还原糖含量情况确定最适的糖化时间为180 min。
2.2.2 糖化温度的优化(图6)
由图6可知,温度能够显著影响酶促反应。糖化180 min时,当糖化温度为50℃时,所得糖化液中还原糖含量最高,随着糖化温度上升,还原糖含量降低。糖化阶段,糖化酶的热稳定性对其糖化能力有明显的影响,糖化酶PtGA15在50~60℃内,随着温度升高,酶的热稳定性降低,高于60℃后迅速失活,从而影响糖化水解能力。由于还原糖含量直接影响酵母生长繁殖的速度,继而影响发酵产酒精的能力,故确定糖化阶段温度为50℃。
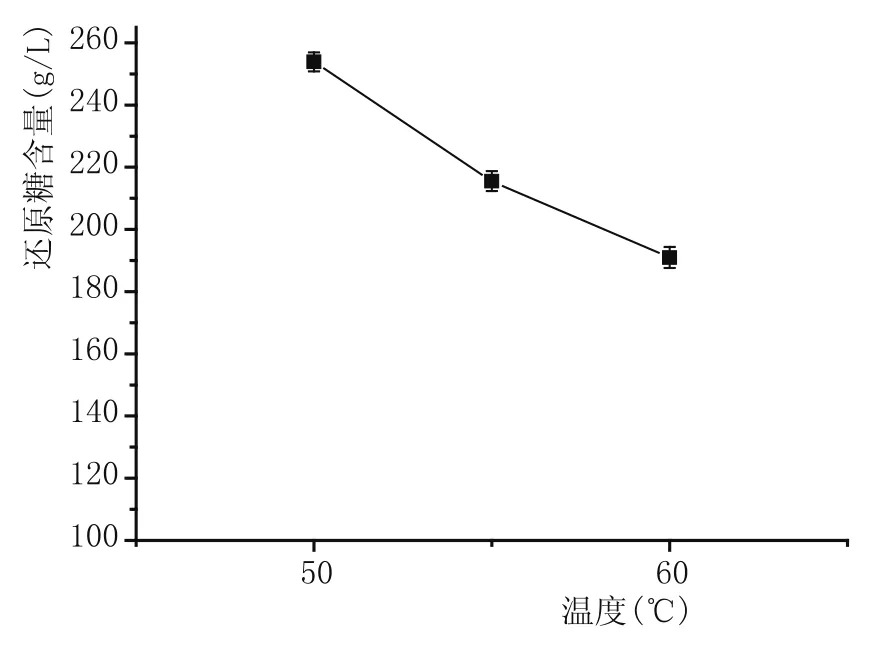
图6 糖化温度对糖化酶糖化效果的影响
2.2.3 糖化酶(PtGA15)添加量的优化(图7)
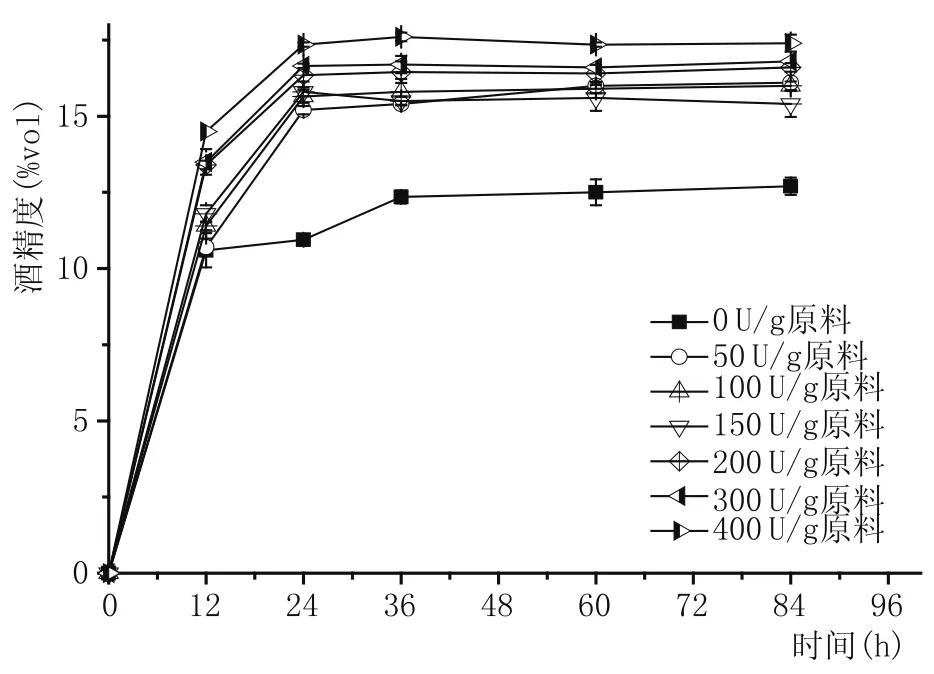
图7 糖化酶PtGA15加酶量对黄酒前酵阶段酒精生成的影响
不同的糖化酶PtGA15添加量对黄酒理化指标的影响的实验结果如图7和表3所示。发酵初期12 h内所有样品的酒精度都已经占总的酒精产量的一半以上,而且加酶量越大,酒精度上升越快,发酵效率越高。由于液化和糖化同时进行,α-淀粉酶和糖化酶之间存在明显的协同作用,促进还原糖含量的增加,经酵母生长繁殖及时消耗,底物抑制不明显,酒精度含量上升速度与加酶量正相关。相比不加酶时发酵36 h后酒精度基本保持稳定,加酶的样品只需要24 h左右。
由表3可知,酿制的黄酒各项常规理化指标达到传统型国标《GB/T 13662—2008黄酒》的要求。结果表明加酶量越大,残还原糖含量越低,酒精度越高;加酶量为200 U/g原料时酒精度达16.6%vol,相比不加酶时的12.7%vol,提高了30.7%,随后酒精度增长减缓。另外,添加糖化酶PtGA15的黄酒,最终α-氨基态氮含量也较不加酶时明显提高,150 U/g原料添加时提高最多,为32.7%。添加糖化酶PtGA15有利发酵的进行,能够提高发酵效率,增加原料利用率。加酶量为200 U/g原料时酒精度和α-氨基态氮含量相比300 U/g、400 U/g原料不存在显著性差异,与Devantier等[24]、Shen等[25]的研究结果相近,故确定加酶量为200 U/g原料时,发酵效果最好。
3 结论
应用糖化酶PtGA15于黄酒酿造,发现添加糖化酶PtGA15有利于发酵的进行,能够提高发酵效率,增加原料利用率。当糖化温度为50℃,糖化时间3 h时,糖化液中还原糖和干物质含量最高;酶添加量为200 U/g原料时,各项指标与添加量为300 U/g、400 U/g原料时不存在显著性差异。添加糖化酶PtGA15生产的黄酒酒精度达16.6%vol,相比不加酶时的12.7%vol,提高了30.7%;与工厂样品相比,酒精度有所上升,残糖含量略高,pH值和总酸含量略低,但综合来说相差不大,各项理化指标均达到国标《GB/T 13662—2008黄酒》的要求。生产中一般糖化工艺温度控制在60~65℃,pH4.5左右,对酶的耐酸性及热稳定性有较高的要求,而糖化酶PtGA15不仅在pH4.5时具有较好的稳定性,而且在50℃就表现出较高的酶活性,该酶应用于生产,不仅对出酒率及黄酒品质有所保证,同时还能起到节能减排的效果。
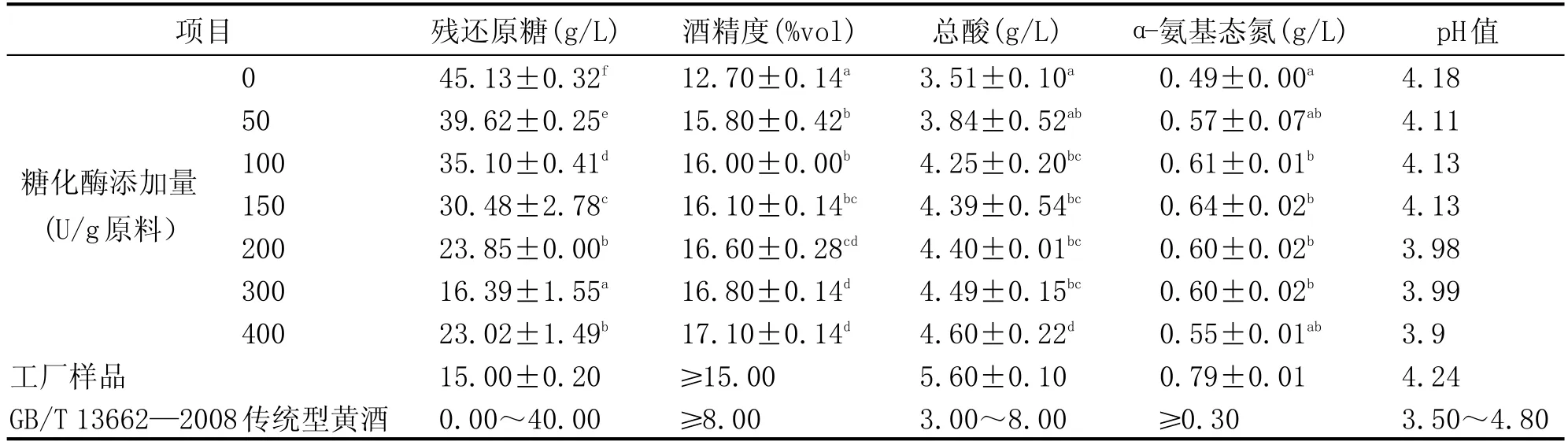
表3 糖化酶 PtGA15添加量对黄酒理化指标的影响

