中华鲟免疫分子CD22的克隆及生物信息学挖掘
来璇 金钰婷 金语嫣 廖志勇

摘要 为研究中华鲟免疫分子CD22的结构及其可能对应的功能,克隆中华鲟CD22 cDNA(CsCD22),进行生物信息学分析,根据结构推测功能。结果表明,成功克隆中华鲟CD22 cDNA序列,该序列全长1 748 bp,包含1个1 170 bp的开放阅读框,共编码389个氨基酸,包含3个Ig超家族结构域和3个潜在的N-糖基化位点。综上所述,中华鲟CD22分子具有高度保守的结构特征,推测其具有与其他动物CD22分子相似的免疫学功能。
关键词 中华鲟;CD22;序列分析;功能预测
中图分类号 S917.4 文献标识码 A 文章编号 1007-5739(2019)09-0204-03
Abstract In order to study the structure of CD22 and its possible corresponding functions,the Acipenser sinensis CD22 cDNA(CsCD22)was cloned and analyzed by bioinformatics.The results showed that the CD22 cDNA sequence of Acipenser sinensis was successfully cloned.The full length of the sequence was 1 748 bp and it contained a 1 170 bp open reading frame encoding a total of 389 amino acids,including three Ig superfamily domains and three potential N-glycosylation sites.In summary,the Acipenser sinensis CD22 molecule has a highly conserved structural feature and is presumed to have immunological functions similar to those of other animal CD22 molecules.
Key words Acipenser sinensis;CD22;sequence analysis;functional prediction
CD是位于細胞膜上的一类分化抗原的总称,是白细胞(以及血小板、血管内皮细胞等)分化为不同谱系和分化成熟的不同阶段及活化过程中出现的细胞表面标志[1]。CD22为Ⅱ型跨膜蛋白,是唾液酸结合免疫球蛋白样凝集素家族成员[2]。在哺乳动物体内,CD22维持B细胞抑制的基线水平,以控制体液免疫[3]。CD22限制了BCR的信号传递,使其在强直信号传递、对病原体的反应和自身免疫的预防之间达到平衡[4]。
作为B细胞受体的抑制性共受体,CD22对中华鲟B细胞激活信号具有负性调节作用,特别是抑制细胞内Ca2+信号[5]。中华鲟免疫分子CD22对于控制B细胞的信号传导阈值特别是对B细胞早期发育起重要调节作用,对其凋亡的调控及阴性选择尤为重要[6]。此外,能够与包含2-2,6连接唾液酸的糖蛋白配体特异性结合,抗原激活BCR,也使CD22胞质区免疫受体酪氨酸抑制基序中的酪氨酸迅速磷酸化,并激活下游信号分子抑制钙离子内流而减弱BCR信号。CD22参与B细胞的归巢过程。因CD22相对特异地表达于B细胞表面,已成为调节B细胞免疫以及治疗某些B细胞肿瘤的良好靶标[2]。
中华鲟(Acipenser sinensis)在动物分类上隶属于鱼纲鲟形目鲟科鲟属,别名鲟鱼、鳇鱼、苦腊子、鳣等[7],是上垩纪遗留至今的古老鱼种,已有1.4亿年的历史,是我国独有的古老珍稀物种,也是脊椎动物中较原始的鱼类,在其身上能够探寻出物种进化的陈迹,中华鲟被人们称为鱼类始祖的“活化石”[8]。鲟鱼肉质鲜美,营养丰富,具有极高的食用价值与药用价值。中华鲟在食品、科研等方面的大规模应用使其在现代社会中的经济价值逐渐凸显。中华鲟主要分布于我国东南沿海的大陆架水域和长江中下游的干流内[9];喜好在粗糙的河床底质产卵,需要有一定速度的水流,对环境条件的要求较高,这是中华鲟在长期进化过程中产生的生态适应[10]。然而,随着栖息地的减少、环境的恶化,中华鲟新产卵地的有效繁殖种群数量和环境容量减少[11],许多中华鲟品种面临灭绝的危险。为了保护生态多样性,自 1983年开始,国家明令禁止对长江中华鲟的商业捕捞,1984年从葛洲坝下捕捞的中华鲟亲鱼的人工繁殖获得成功,开始人工放流并且持续至今[12],在这些过程中疾病防治问题不可避免。对中华鲟免疫的研究不仅有利于加强人们对免疫学的了解,还能为中华鲟人工养殖、野生保护过程中出现的疾病防治问题提供理论基础。
1 材料与方法
1.1 试验试剂
RNeasy Plus Mini Kit(Qiagen,德国),SMART cDNA libr-ary construction kit(Clontech,美国),DH10B Competent cell(Tiangen,北京),Vitagene 96-easy plasmid Miniprep kit(Vi-tagene,意大利),其他化学试剂均为国产分析纯。
1.2 试验方法
1.2.1 中华鲟脾脏CD22基因克隆。于-80 ℃取出中华鲟脾脏组织,在液氮中充分研磨,称取100 mg左右脾脏组织于1.5 mL无菌离心管,加入1 mL TRIpure充分混匀;FORTEX涡旋振荡15 s充分混匀,于室温静置5 min,从而保证核蛋白体充分裂解;4 ℃,最高速11,000×g离心10 min,小心吸取上清至新的无核酸酶离心管中,加0.2 mL氯仿,盖紧管盖,涡旋振荡15 s,室温静置3 min;4 ℃,最高速冷冻离心15 min,离心后的混合液分为3层(由下至上),第1层为红色有机苯酚氯仿层(蛋白质),第2層为DNA,第3层为无色水样层(RNA);将水样层转移至无核酸酶离心管中,加入等体积异丙醇,上下颠倒混匀5~10次,室温静置10 min;4 ℃,最高速11,000×g冷冻离心3 min,弃上清;重复离心步骤1次,小心用移液枪吸出多余液体;室温静置3 min,晾干沉淀,加入50 μL无核酸酶充分溶解RNA,利用NanoDrop 2000测RNA浓度及OD260/OD280;抽提的RNA于-70 ℃保存,避免降解。
1.2.2 中华鲟CD22 cDNA(CsCD22)文库构建。使用SMART cDNA library construction kit构建中华鲟脾脏全长cDNA文库。将长度大于500 bp的cDNA片段连接至pDNR-LIB载体,转化DH10B感受态细胞。随机挑取cDNA阳性克隆菌,直接接种于含有1 mL YT培养基的96孔板中,37 ℃孵育过夜。利用Vitagene 96-easy plasmid Miniprep kit抽提菌液中的DNA,送往上海生工生物公司完成测序工作。使用T7引物,从5端测序,筛选中华鲟CD22 cDNA序列[13]。
1.2.3 生物信息学分析。用Bioxm 软件分析中华鲟CsCD22 cDNA序列开放阅读框;通过SMART(http://smart.emblhei-delberg.de)在线分析CsCD22功能结构域;通过http://www.cbs.dtu.dk/services/NetNGlyc/在线预测CsCD22糖基化位点;通过NetNGIyc 1.0 Server(http://www.cbs.dtu.dk/services/NetN
Glyc/)在线预测CsCD22的磷酸化位点;通过http://www.cbs.dtu.dk/services/SignalP/在线预测CsCD22信号肽序列;通过ExPASy-COILS进行CsCD22的蛋白质卷曲螺旋预测(embnet.vital-it.ch/software/COILS_form.html);利用BioEdit软件进行氨基酸同源性比对及保守结构的分析;CsCD22蛋白空间结构模型由SWISS-MODEL(https://swissmodel.expasy.org/)在线预测。
2 结果与分析
2.1 CsCD22 cDNA序列及功能域分析
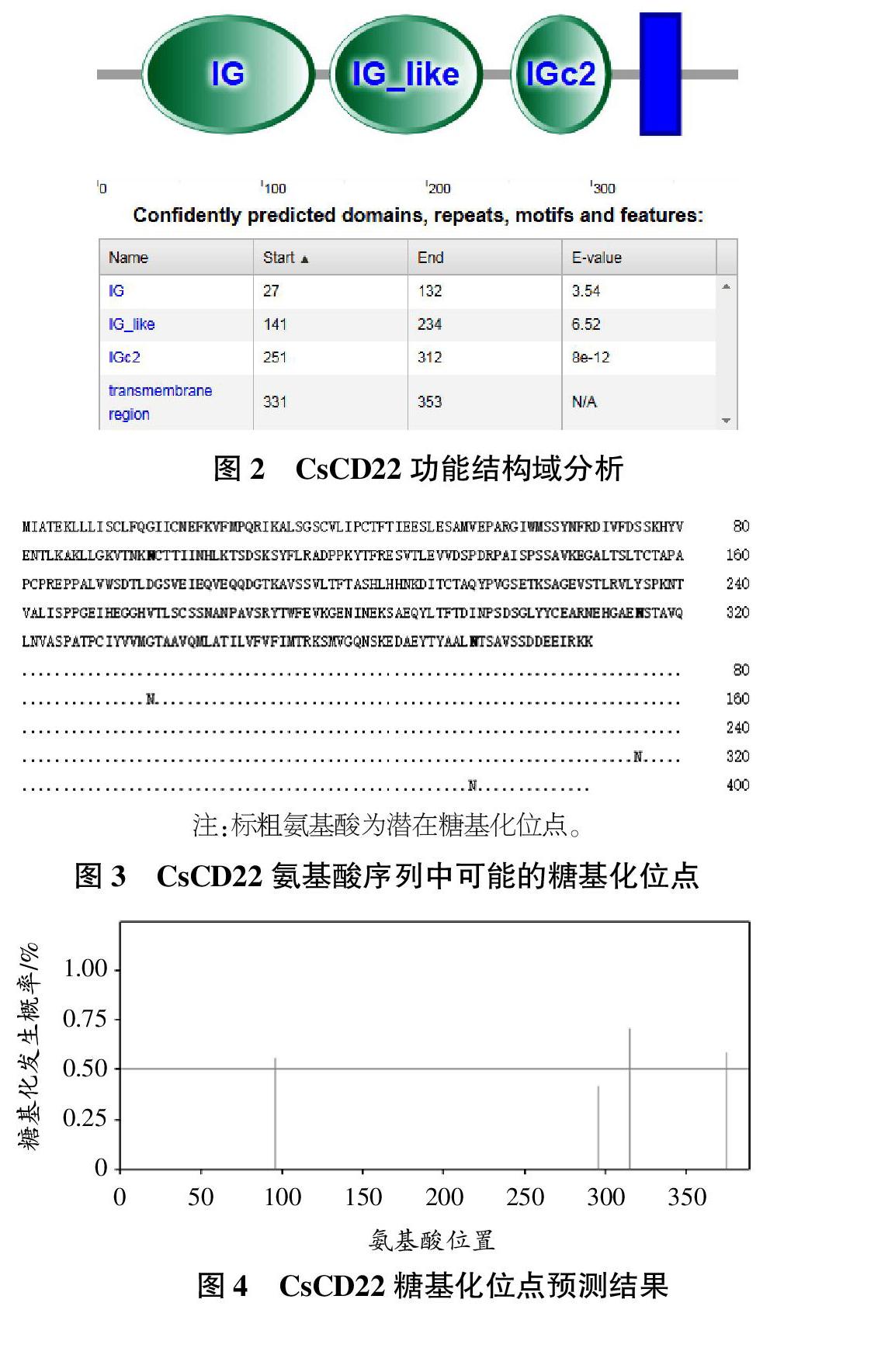
CsCD22全长为1748 bp,其中包括1个65 bp的5′非编码区、1 170 bp的开放阅读框和488 bp的3′非编码区。3′端有1个典型的polyA尾巴,其上游附近有1个加尾信号(AA-TAAA)。CsCD22的开放阅读框编码389个氨基酸(图1),预测其等电点为4.78、分子量为42.8 kDa。同时,其N端包含1个由11个氨基酸组成的信号肽。SMART在线预测结果显示(图2),CsCD22含有3个Ig超家族结构域(Ig superfamily),该结构域提供与不同球状结构多肽或化学基团粘附的部位,从而发挥免疫学功能。
2.2 CsCD22糖基化位点预测
通过NetNGIyc 1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)在线预测CsCD22的糖基化位点。结果如图3、4所示,96、315、374位天冬酰胺处的信号超过了临界值,是潜在的糖基化位点。
2.3 CsCD22磷酸化位点预测
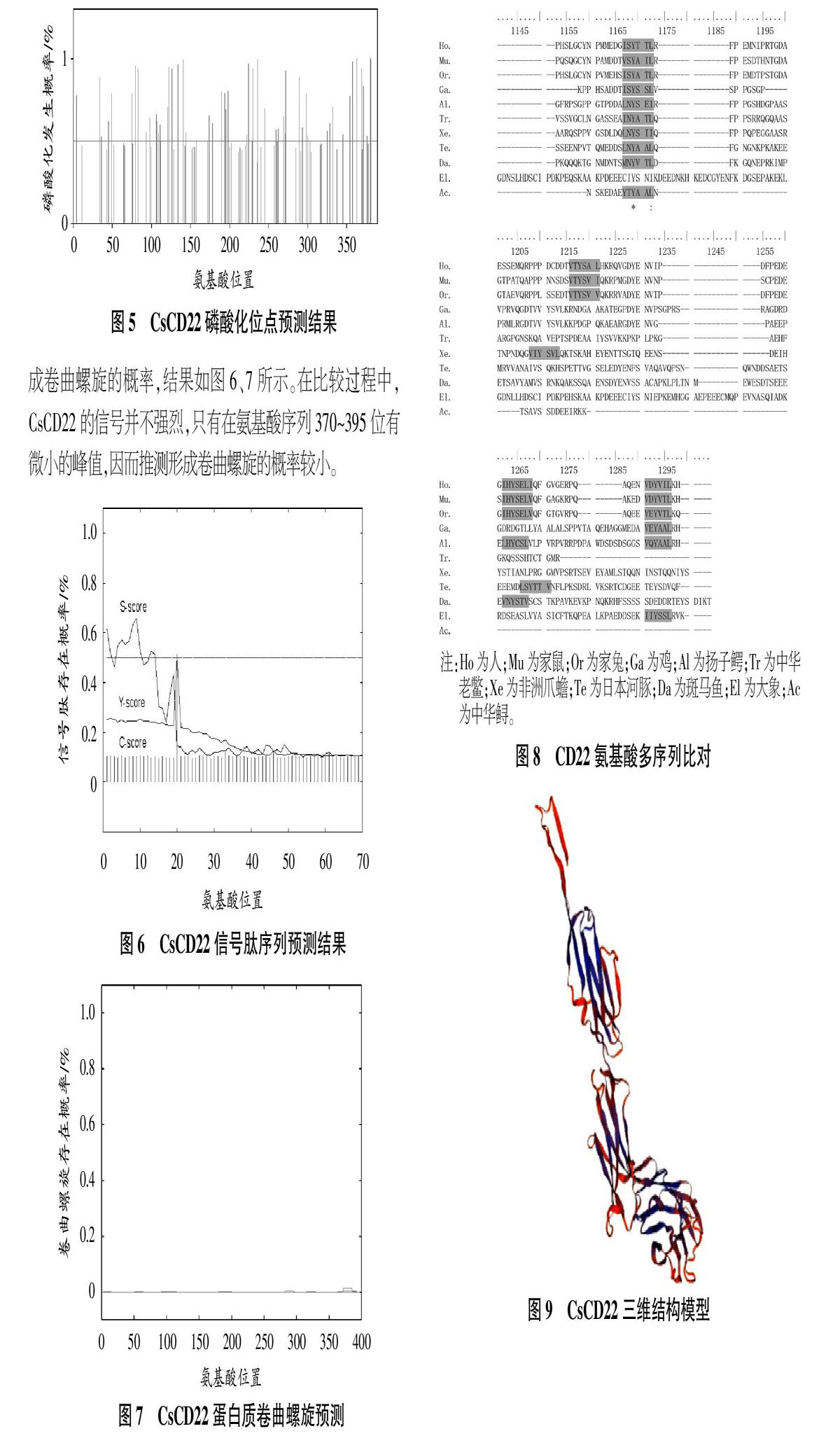
引入磷酸基团之后,CsCD22的分子构象发生变化,造成酶活力的缺失或者获得。磷酸化导致CsCD22核内特定基因的表达,成功完成对外界信号的应激性。利用NetNGIyc 1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)在线预测CsCD22的磷酸化位点,结果如图5所示。
2.4 CsCD22信号肽序列及蛋白质卷曲螺旋预测
CsCD22的信号肽位于疏水氨基区上游,长约11个氨基酸残基。负责把CsCD22引导到细胞内不同膜结构的亚细胞器内,这与它跨膜的性质相吻合。利用Coils Server在线(https://embnet.vital-it.ch/software/COILS_form.html)进行CsC
D22蛋白质卷曲螺旋预测,将序列与已知的平行双链卷曲螺旋数据库进行比较,得到相似性得分,并据此算出序列形成卷曲螺旋的概率,结果如图6、7所示。在比较过程中,CsCD22的信号并不强烈,只有在氨基酸序列370~395位有微小的峰值,因而推测形成卷曲螺旋的概率较小。
2.5 CsCD22三维结构模型分析
CD22氨基酸多序列比对结果如图8所示,可以看出,CD22氨基酸在进化过程中是保守的。多物种中具有典型的ITIM结构域,这与使信号通路上的分子去磷酸化,从而向细胞内传递抑制性信号达到下调细胞的活性作用密切相关,也是CD22分子具有免疫活性的关键所在。基于序列保守性这一前提,模拟了CD22的三维结构模型(图9)。
3 结论与讨论
通过分子生物学、生物信息学研究手段,鉴定得知CsCD
22 cDNA全长为1 748 bp,其开放阅读框有1 170 bp,共编码389个氨基酸。CsCD22的开放阅读框编码389个氨基酸,预测其等电点为4.78、分子量为42.8 kDa,包含3个Ig超家族结构域和3个潜在的N-糖基化位点。生物信息学结果显示,96、315、374位天冬酰胺是CsCD22的潛在糖基化位点。CsCD22的信号肽位于疏水氨基区上游,长约11个氨基酸残基。氨基酸多序列对比及功能域分析结果显示,CsCD22在物种进化过程中高度保守,与其他物种的CD22具有较高的同源性,其中具有典型的ITIM结构域,这与使信号通路上的分子去磷酸化,从而向细胞内传递抑制性信号达到下调细胞的活性作用密切相关,暗示它们在免疫防御方面的功能可能是相近的。
4 参考文献
[1] 邓子新,陈峰.微生物学[M].北京:高等教育出版社,2017:245.
[2] 徐洪来,肖敏,刘强,等.CD22分子机制的研究进展[J].医学综述,2015,21(15):2720-2722.
[3] ERE?譙O-ORBEA,J,SICARD,T,CUI,H,et al.Molecular basis of human CD22 function and therapeutic targeting[J].Nature Communications,2017,8(1):1-11.
[4] DEPOIL,D,DUSTIN,M L.Agile CD22 nanoclusters run rings around fenced BCR[J].The EMBO Journal,2016,35(3):237-238.
[5] CHEN,J,WANG,H,XU,W,et al.Besides an ITIM/SHP-1-dependent pathway,CD22 collaborates with Grb2 and plasma membrane calcium-ATPase in an ITIM /SHP-1-independent pathway of attenuation of Ca 2+i signal in B cells[J].Oncotarget,2016,7(35):56129-56146.
[6] 葛新顺,廖晓龙.CD22分子的生物学功能研究进展[J].交通医学,2007(1):24-26.
[7] 吴剑峰.中华鲟的过去,现在和将来[J].生物学教学,1993(7):36-38.
[8] 云文.“活化石”:中华鲟[J].中国钓鱼,1995(2):41.
[9] 张辉,危起伟.命运堪忧的中华鲟[J].大自然,2016(6):8-11.
[10] 常剑波,曹文宣.中华鲟物种保护的历史与前景[J].水生生物学报,1999(6):712-720.
[11] HUANG Z,WANG L.Yangtze Dams increasingly threaten the survival of the Chinese sturgeon[J].Curr Biol,2018,28(22):3640-3647.
[12] 肖慧.葛洲坝水利枢纽与珍稀鱼类保护的实践[M]//黄真理.21世纪长江大型水利工程中的生态与环境保护.北京:中国环境科学出版社,1998:199-209.
[13] 刘榴,石君玲,尤修玲,等.大鲵泛素结合酶cgsUBE2L3基因克隆及其在免疫应答中的表达分析[J].安徽农业科学,2017,45(22):93-97.
基金项目 浙江省大学生科技创新活动计划暨新苗人才计划(2018R42 9034)。
*通信作者
收稿日期 2019-01-11

