基于NIHSS、NDS评分的银杏蜜环口服溶液治疗进展性缺血性脑卒中的疗效评估
何敏 刘志强 蒋玲霞 朱晓钢
(江西省人民医院二部神经内科 南昌330006)
进展性缺血性脑卒中(Progressive Ischemic Stroke,PIS)是缺血性脑卒中的临床常见类型,主要表现为发病后6 h~7 d内,虽经常规抗血小板聚集、神经保护、活血化瘀等治疗,神经功能缺损仍呈阶梯式加重或逐渐进展,美国国立卫生研究院脑梗死量表评分(National Institute of Health Stroke Scal,NIHSS)增加2分,且持续至少24 h[1],致死、致残率高。我院在近年的临床实践中应用银杏蜜环口服溶液对进展性缺血性卒中进行治疗,取得了良好的疗效。本研究分析了基于NIHSS、中国脑卒中临床神经功能缺损程度评分分量表(NDS)评分的银杏蜜环口服溶液对进展性缺血性卒中治疗疗效及对血清淀粉样蛋白a(Serum Amyloid A,SAA)和白细胞介素6(Interleukin-6,IL-6)水平的影响。现报道如下:
1 资料与方法
1.1 一般资料 选取2016年1月~2018年1月在我院神经内科住院治疗的160例首次发生进展性缺血性脑卒中患者作为研究对象,采用随机数字表法分为治疗组和对照组,每组80例。治疗组男42例,女 38例;年龄 66~78岁,平均年龄(69.6±2.4)岁;收缩压 130~160 mm Hg,平均收缩压(143.5±13.1)mm Hg;舒张压 75~100 mm Hg,平均舒张压(87.5±8.2)mm Hg;空腹血糖 5.3~7.8 mmol/L,平均空腹血糖 (6.3±1.1)mmol/L;餐后 2 h血糖 7.5~15.0mmol/L,平均餐后 2 h 血糖(9.7±2.3)mmol/L;甘油三酯 2.1~4.5 mmol/L,平均甘油三酯(3.2±1.1)mmol/L;总胆固醇4.5~6.9 mmol/L,平均总胆固醇(5.6±1.2)mmol/L;NIHSS 评分 21~24 分,平均NIHSS 评分(22.3±1.1)分;NDS 评分 23~29分,平均NDS评分(26.3±3.5)分。对照组男41例,女39例;年龄 67~79 岁,平均年龄(70.7±3.6)岁;收缩压132~163 mm Hg,平均收缩压(146.5±12.4)mm Hg;舒张压78~98mmHg,平均舒张压(88.5±9.2)mmHg;空腹血糖 5.4~7.6 mmol/L,平均空腹血糖(6.4±1.2)mmol/L;餐后2 h血糖7.3~14.8 mmol/L,平均餐后2 h 血糖 (10.3±3.1)mmol/L;甘油三酯 2.4~4.4 mmol/L,平均甘油三酯(3.4±1.2)mmol/L;总胆固醇 4.8~7.2 mmol/L,平均总胆固醇 (5.8±1.3)mmol/L;NIHSS评分 21~24分,平均 NIHSS评分(22.5±1.3)分;NDS评分 23~29分,平均 NDS 评分(26.4±3.6)分。两组患者的性别、年龄、血压、血糖、血脂、入院时NIHSS评分和NDS评分等资料相比较,差异均无统计学意义,P>0.05,具有可比性。所有患者均符合PIS诊断标准,均自愿参与本研究并签署研究知情同意书,本研究经我院医学伦理委员会批准。
1.2 纳入标准 首次发病,发病24 h内入院,年龄18~80周岁者;NIHSS评分 20~24分者。
1.3 排除标准 精神疾病患者或痴呆不合作者;脑肿瘤患者;严重心、肝、肾、肺功能不全者。
1.4 治疗方法
1.4.1 对照组 给予常规治疗。包括抗血小板聚集:给予拜阿司匹林片(国药准字J20080078)100 mg、1次/d;调制稳定斑块:给予立普妥片(国药准字H20051408)20 mg,1 次 /d;活血化瘀:给予注射用丹参多酚酸注射液(国药准字Z20110011)0.13 g,1次/d;清除氧自由基:给予依达拉奉注射液(国药准字H20050280)30 mg,2次 /d;降糖:给予拜唐苹片(国药准字 H19990205)50 mg,3 次 /d,治疗 2 周。
1.4.2 治疗组 在对照组的基础上加用银杏蜜环口服溶液(国药准字 H20013079)10 ml/次,口服,3 次/d,治疗 2周。
1.5 观察指标及疗效评估标准 (1)评估治疗前,治疗1周后和治疗2周后神经功能缺损严重程度及神经功能恢复情况,采用NIHSS评分量表和NDS评分量表进行评分。(2)比较治疗前、治疗1周和治疗2周后血清SAA和IL-6水平:治疗前、治疗1周和治疗2周后,分别抽取两组患者静脉血5 ml,以转速3 000 r/min离心10 min,吸取上清液,采用透射比浊法,使用西门子BN prospect特定蛋白仪及德国西门子公司配套试剂测定血清SAA水平;采用酶联免疫吸附法(ELISA法)测定血清IL-6水平,试剂盒购于上海优宁维生物科技股份有限公司,操作过程严格按照试剂盒说明书进行。(3)所有患者在治疗前,治疗1周后和治疗2周后均行血常规、生化、凝血功能、心电图、头颅MRI+MRA等常规检查。
1.6 统计学处理 数据处理采用SPSS23.0统计学软件,计量资料以(±s)表示,行t检验,计数资料以%表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前、治疗1周后和治疗2周后NIHSS评分比较 治疗前,两组的NIHSS评分相比较,差异无统计学意义,P>0.05;治疗1周和治疗2周后,两组NIHSS评分均低于同组治疗前,差异有统计学意义,P<0.05;且治疗组的NIHSS评分低于对照组,差异有统计学意义,P<0.05。见表1。
表1 两组治疗前、治疗1周后和治疗2周后NIHSS评分比较(分,±s)

表1 两组治疗前、治疗1周后和治疗2周后NIHSS评分比较(分,±s)
注:与同组治疗前相比较,*P<0.05。
组别 n 治疗前 治疗1周 治疗2周对照组治疗组P 8 0 8 0 2 2.5 2±1.3 1 2 2.4 8±1.1 2>0.0 5 1 8.6 3±2.3 8*1 2.2 5±2.5 4*<0.0 5 1 1.7 6±1.3 8*5.6 5±1.5 2*<0.0 5
2.2 两组治疗前、治疗1周后和治疗2周后NDS评分比较 治疗前,两组的NDS评分相比较,差异无统计学意义,P>0.05;治疗1周和治疗2周后,两组NDS评分均低于同组治疗前,差异有统计学意义,P<0.05;且治疗组的NDS评分低于对照组,差异有统计学意义,P<0.05。见表2。
表2 两组治疗前、治疗1周后和治疗2周后NDS评分比较(分,±s)

表2 两组治疗前、治疗1周后和治疗2周后NDS评分比较(分,±s)
注:与同组治疗前相比较,*P<0.05。
组别 n 治疗前 治疗1周 治疗2周对照组治疗组P 8 0 8 0 2 6.3 2±3.5 4 2 6.4 5±3.6 3>0.0 5 1 9.5 3±2.3 8*1 2.6 7±2.4 6*<0.0 5 1 2.3 5±1.6 8*6.8 9±2.3 7*<0.0 5
2.3 两组治疗前、治疗1周后和治疗2周后血清SAA水平比较 治疗前,两组的血清SAA水平相比较,差异无统计学意义,P>0.05;治疗1周和2周后,两组血清SAA水平均低于同组治疗前,差异有统计学意义,P<0.05;且治疗组的血清SAA水平低于对照组,差异有统计学意义,P<0.05。见表3。
表3 两组治疗前、治疗1周后和治疗2周后血清SAA水平比较(mg/L,±s)
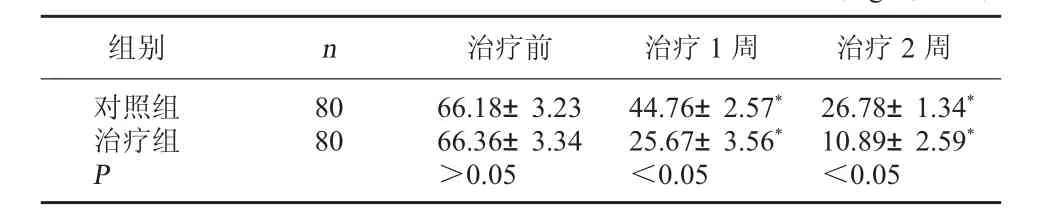
表3 两组治疗前、治疗1周后和治疗2周后血清SAA水平比较(mg/L,±s)
注:与同组治疗前相比较,*P<0.05。
组别 n 治疗前 治疗1周 治疗2周对照组治疗组P 8 0 8 0 6 6.1 8±3.2 3 6 6.3 6±3.3 4>0.0 5 4 4.7 6±2.5 7*2 5.6 7±3.5 6*<0.0 5 2 6.7 8±1.3 4*1 0.8 9±2.5 9*<0.0 5
2.4 两组治疗前、治疗1周后和治疗2周后血清IL-6水平比较 治疗前,两组的血清IL-6水平相比较,差异无统计学意义,P>0.05;治疗1周和治疗2周后,两组血清IL-6水平均低于同组治疗前,差异有统计学意义,P<0.05;且治疗组的血清IL-6水平低于对照组,差异有统计学意义,P<0.05。见表4。
表4 两组治疗前、治疗1周后和治疗2周后血清IL-6水平比较(pg/ml,±s)

表4 两组治疗前、治疗1周后和治疗2周后血清IL-6水平比较(pg/ml,±s)
注:与同组治疗前相比较,*P<0.05。
组别 n 治疗前 治疗1周 治疗2周对照组治疗组P 8 0 8 0 2 5 3.4 5±1 2.3 6 2 5 4.5 1±1 3.4 7>0.0 5 4 4.7 6±2.5 7*2 5.6 7±3.5 6*<0.0 5 2 6.7 8±1.3 4*1 0.8 9±2.5 9*<0.0 5
2.5 血清SAA与IL-6相关性分析 直线相关分析显示,血清SAA与血清IL-6水平呈正相关,r=0.845,P<0.001。
2.6 两组不良反应发生情况比较 治疗过程中,两组患者均无消化道反应、皮疹、肝肾功能异常等不适。治疗前、治疗1周后和治疗2周后,两组的血常规、凝血功能、生化指标和心电图等与治疗前相比较无明显变化。
3 讨论
进展性缺血性脑卒中是缺血性脑卒中的常见亚型,约占急性缺血性脑卒中的30%~40%,具有高发病率、高致残率和高致死率的特点[2]。进展性缺血性卒中主要表现为神经功能缺损呈阶梯式加重或逐渐进展、恶化,常预后不良。对进展性缺血性卒中的治疗多为抗血小板聚集、调脂稳定斑块、溶栓、清除氧自由基、建立侧支循环等对症治疗,但经各种规范治疗后,常常仍无法阻断病情进展,致残或致死。
许多学者发现,SAA、IL-6等免疫因子可介导缺血半暗带不可逆性损伤导致该病的发生[3]。Fullerton等发现,SAA与脑卒中事件的发生风险明确相关[4]。Pearson和Erta等的研究表明,血清IL-6水平可预测进展性卒中的发生和复发风险[5~6]。因此,血清SAA和IL-6水平可用于评估进展性缺血性卒中的病情、复发及治疗疗效。
在近几年的临床实践中,我们逐渐开始寻求中药制剂对该病的治疗方案。银杏蜜环口服溶液主要成分为银杏叶提取物和蜜环菌粉。银杏叶提取物的主要活性成分为银杏总黄酮和银杏总内酯。Luna等的研究表明,银杏总黄酮主要通过清除氧自由基及各类氧化基团,发挥抗氧化作用,同时保护细胞膜和线粒体,减少能量代谢及调控细胞凋亡[7]。而Boehme等学者发现,银杏总内酯通过抑制血小板活化和聚集,可促进血液循环,改善血流动力学异常,抵抗自由基,从而抑制血栓形成和扩张[8]。另外,Belviranli和Kudolo等学者分别通过各自的研究证实:银杏叶提取物具有控制IL-6、SAA、CRP和MCP-1等免疫因子表达,降低免疫因子水平的作用,且可抑制小动脉收缩,促进血管内皮舒张因子释放,扩张脑血管,增加脑血流,改善脑代谢,抑制脑细胞凋亡[9~10]。蜜环菌为天麻共生菌,其主要成分是天麻素、天麻苷等,具有中枢镇静,清除氧自由基,保护线粒体及脑细胞功能等功效。还有很多学者也通过研究证实,银杏蜜环口服溶液对于急性缺血性脑血管病具有良好的疗效[11~14]。
本研究在急性缺血性脑卒中常规治疗的基础上加用银杏蜜环口服溶液对进展性缺血性脑卒中进行治疗,采用NIHSS评分和NDS评分对治疗疗效进行了评估,并分析了银杏蜜环口服溶液对进展性缺血性卒中患者血清SAA和IL-6水平的影响。结果显示治疗1周和治疗2周后,两组的NIHSS评分和NDS评分均较同组治疗前改善,且治疗组的NIHSS评分和NDS评分均低于对照组,差异有统计学意义,P<0.05;两组血清SAA和IL-6水平均较治疗前下降,且治疗组的血清SAA和IL-6水平均低于对照组,差异有统计学意义,P<0.05。这说明加用银杏蜜环口服溶液治疗进展性缺血性卒中,可有效改善患者的NIHSS评分和NDS评分,显著降低血清SAA和IL-6水平,明显改善患者神经功能缺损,促进神经功能恢复。两组治疗前后的血常规、凝血功能和生化指标等相比较无明显变化,服药治疗过程中未发生任何药物不良反应。
综上所述,在急性缺血性脑卒中常规治疗的基础上加用银杏蜜环口服溶液可有效改善进展性缺血性脑卒中患者神经功能缺损,促进其神经功能恢复,降低血清SAA和IL-6水平,疗效显著。

