自然光暴露对PRK法单眼远视离焦幼年恒河猴角膜组织的影响
王 泳,刘良平,钟兴武,3
0引言
近视发病率近年全球性攀升,其发病呈低龄化和严重化趋势[1]。尽管近视的发病机制至今未能明确,但大部分学者认为它是屈光发育期异常视觉经历导致的屈光发育异常。流行病学研究证实增加户外活动时间是防控青少年近视的独立保护因素[2-5],每周增加1h日光下户外活动,近视发生风险下降2%。比较户外与室内环境的视觉因素,自然光暴露是两者区别之一。我们前期实验结果表明每天自然光暴露3h可延缓幼年恒河猴远视性光学离焦近视的发展,而且幼年期自然光暴露经历也有利于维持双眼的正视化[6]。因此自然光可作为保护因素在近视防控加以利用。然而,流行病学调查指出长期自然光暴露与翼状胬肉、慢性结膜炎、复发性单纯疱疹病毒性角膜炎等多种眼表疾病的发病率相关[7-8]。大量实验研究也证实自然光中的多种光学成分及自然光的高辐射强度特性可破坏眼部组织正常生理状态,造成光损伤[9-10]。为此,明确自然光对眼组织存在光损害,尽可能在防控近视和避免眼组织光损伤之间取得平衡,是制定合理近视防治措施的重要内容。本实验比较不同光照条件下幼年恒河猴泪液多种细胞因子表达量,角膜组织形态学改变、细胞凋亡状况及细胞氧化应激代谢产物含量,了解自然光是否在影响屈光系统发育的同时对眼表组织存在光损伤危险,为制定安全有效的近视防控手段提供更全面科学的实验数据和理论依据。
1材料和方法
1.1材料
1.1.1实验动物2月龄健康幼年恒河猴12只购于广东蓝岛生物技术有限公司,雌性2只,雄性10只。依体质量和性别配对后,随机分为两组:人工照明组(artificial light group,AL组,n=6只)和自然光组(natural light group,NL组,n=6只)。本实验获中山大学中山眼科中心动物实验伦理委员会审核批准(批准号:2014-069)。
1.1.2主要试剂QAH-CUST蛋白芯片试剂盒(RayBiotech),蛋白定量测试盒(南京建成生物工程研究所)、SOD测定试剂盒(南京建成生物工程研究所)、MDA测试试剂盒(南京建成生物工程研究所),In Situ Cell Death TMR Tunel试剂盒(Roche),DAPI染剂(Sigma),GTVisionTM Ⅲ通用型免疫组化试剂(DAKO),TGF-β抗体(ab53169, Abcam),α-SMA抗体(ab18147,Abcam)。
1.2方法
1.2.1实验设计12只幼猴均采用本课题组准分子激光角膜切削术(photorefractive keratectomy,PRK)制作单眼远视离焦动物模型[11-12],统一选择右眼为手术眼(PRK眼),矫正度数为-4.0D,切削直径为5.0mm,左眼为对照眼。所有手术操作均由同一经验丰富准分子激光医师实施。单眼PRK术后10d开始动物分组处理,12h∶12h光照周期,照明时间为8∶00~20∶00,光源为荧光日光灯(YK28RR16,28W,6500K)。AL组幼猴始终室内饲养,NL组幼猴除雨天外,每天随笼放置室外接受自然光照射4h(9∶00~11∶00和15∶00~17∶00),照度计每天分别于9∶00、10∶00、11∶00、15∶00、16∶00和17∶00测量幼猴双眼连线平面光照强度,范围1320~24380Lx,其中60%以上监测时间点光照度高于10 000Lx。其余时间与AL组饲养于同一动物房,实验时长共180d。
1.2.2幼猴haze分级比较于PRK术后3mo内每10d 1次,术后3~6mo内20~30d 1次裂隙灯显微镜检查所有实验幼猴术眼,按1990年Fantes分级标准[13]评估并记录角膜haze情况,比较不同时间点两组分级组成。
1.2.3泪液多因子蛋白质芯片检测每组随机选4只幼猴,于PRK术后50d戊巴比妥钠静脉全身麻醉下用毛细管虹吸收集双眼泪液行多因子蛋白芯片检测,每眼收集总量不少于10μL,标记离心后-80℃冰箱冷冻保存备用。按Ray Biotech公司QAH-CUST蛋白芯片试剂盒操作检测泪液多种因子含量,包括:神经生长因子(nerve growth factor, NGF)、表皮生长因子(epidermal growth factor,EGF)、γ-干扰素(interferon-γ,IFN-γ)、白介素-1(interleukin-1,IL-1)、白介素-17(interleukin-17,IL-17)、白介素-6(interleukin-6,IL-6)、白介素-23(interleukin-23,IL-23)、淋巴管内皮透明质酸受体-1(lymphatic vessel endothelial growth factor,LYVE-1)、转化生长因子-β1(transforming growth factor-beta1,TGF-β1 )、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α )和血管内皮生长因子(vascular endothelial growth factor,VEGF)。
1.2.4角膜病理组织及免疫组化检查PRK术后180d,戊巴比妥钠静脉注射过量麻醉处死两组幼猴,取1/2双眼角膜组织、肾脏及眼外肌组织。4%多聚甲醛固定液固定,常规石蜡包埋切片,HE染色,光学显微镜拍照对比组织结构。
1.2.5角膜免疫组织学检查组织切片常规脱蜡,抗原修复,3%过氧化氢避光孵育。50μL一抗稀释液(Anti-TGF-β1抗体1∶200;Anti-α-SMA抗体1∶80)于组织上,室温孵育60min,PBS漂洗。50μL A液(GTVisionTMⅢ抗鼠兔通用型免疫组化检测试剂盒内标记有辣根过氧化物酶和抗兔及抗小鼠免疫球蛋白的多聚体分子)于组织上,室温孵育30min,PBS漂洗。滴加显色剂DAB工作液50μL,室温孵育,光镜下控制显色,蒸馏水冲洗终止显色。苏木精复染,常规脱水透明,中性树脂封片。
1.2.6幼猴角膜TUNEL细胞凋亡检测取组织石蜡切片,常规脱蜡、复水,PBS漂洗。组织切片浸入20μg/mL蛋白酶K Tris-HCl工作液中重组DNaseⅠ溶于50mmol/L pH7.5的Tris-HCl,25℃处理10min,制作阳性对照样品。按说明书配制TUNEL反应混合液,每个组织样本滴加50μL TUNEL反应混合液,37℃避光湿盒中反应60min,PBS漂洗。5mg/mL DAPI核酸染液,滴50μL于样本,避光作用15min,PBS漂洗。50μL抗荧光淬灭封片剂,盖玻片封片,荧光显微镜检测信号。
表1 两组术后不同时间PRK眼haze分级比较例

组别20d≤0.5级≥1级30d≤0.5级≥1级40d≤0.5级≥1级50d≤0.5级≥1级60d≤0.5级≥1级AL组6060606060NL组6033152451 P10.1820.0150.0611


指标PRK眼(OD)AL组NL组tP对侧眼(OS)AL组NL组tPNGF0.144±0.1710.158±0.21-0.1840.8610.169±0.193.40±5.66-0.9880.379EGF119.0±42.0955.93±26.712.5330.04584.62±23.1540.50±19.912.5020.067IFN59.45±57.31103.65±76.08-1.0020.35524.26±11.2247.55±22.62-1.5980.185IL-18.48±6.686.6±5.680.4200.6895.21±13.610.44±2.74-2.9670.061IL-1717.46±27.327.67±9.290.6780.5230.81±1.142.25±2.03-1.0120.369IL-696.01±8.1193.09±73.490.0790.940415.32±612.81167.28±102.380.6910.527IL-2379.40±58.15114.51±26.01-1.2590.25555.29±48.3135.05±31.720.6070.577LYVE-1200.71±123.06176.08±133.50.2710.795211.13±67.34168.83±44.840.9090.415TGF-β11106.47±146.211596.51±341.39-2.6420.038641.09±164.72716.39±196.63-0.5080.638TNF-a52.07±55.2646.02±34.590.1850.85919.12±18.0318.81±3.460.0300.978VEGF2264.88±903.851937.20±1155.80.4470.6713625.65±584.552308.59±787.962.3230.081
1.2.7幼猴角膜上皮组织丙二醛和超氧化物歧化酶测定室温平衡保存于-80℃冰箱的角膜组织样本,小圆刀片刮除角膜上皮组织,电子天平称重,1∶9与4℃生理盐水混合冰上机械匀浆,2500r/min离心10min,去上清液混合生理盐水稀释成0.5%角膜上皮组织匀浆。按蛋白定量测定说明书指引考马斯亮蓝法,波长595nm,测OD值,按公式计算待测定蛋白浓度。按丙二醛(MDA)测试盒(TBA法)说明书配制试剂,按操作步骤,波长532nm测OD值,按公式计算组织MDA含量。按超氧化物歧化酶(SOD)测定试剂盒(WST-1法)说明书配制试剂,波长450nm测OD值,按公式计算SOD活力。
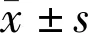
2结果
2.1幼猴PRK眼haze分级比较两组幼猴PRK术后4d内术眼角膜上皮均完全愈合。实验观察期间,AL组幼猴术眼全程无明显肉眼可见haze形成,即haze分级为0.5级及以下,50d仅2只幼猴haze为0.5级,其余角膜均透明;而NL组幼猴术后30~70d术眼发生不同程度haze,0.5级~2级不等,术后40~50d达高峰,此后逐渐减轻,70d后基本消退。两组haze分级评估于40d差异具有统计学意义(P<0.05),其余时间点无显著性差异,见表1。
2.2泪液多因子蛋白质芯片检测结果采用多因子蛋白质芯片检测PRK术后50d两组幼猴双眼泪液11种细胞因子表达量,各细胞因子在幼猴泪液中有不同程度的表达,见表2。分析结果发现AL组与NL两组间PRK眼泪液EGF和TGF-β1含量差异均具有统计学意义(P<0.05),进一步比较组内双眼泪液EGF含量无显著性差异(AL组:t=1.819,P=0.166;NL组:t=1.428,P=0.249),见图1A。TGF-β1的组内双眼泪液表达量则差异有统计学意义(AL组:t=8.757,P=0.003;NL组:t=3.620,P=0.036),见图1B。其余各细胞因子表达量组间和组内比较均无统计学差异,见表2。
2.3角膜免疫组织化学检查光照实验结束时(PRK术后180d),两组双眼角膜全层组织TGF-β1和α-SMA免疫组织化学染色均为阴性,随机取两组幼猴肾脏组织为TGF-β1阳性对照,取两组幼猴前臂肌肉组织为α-SMA阳性对照,排除角膜组织假阴性结果可能。结果表明术后180d,两组PRK眼全层角膜组织无明显TGF-β1(图2)和α-SMA表达(图3),与对侧眼一致。
2.4角膜病理组织学检查实验结束时AL组与NL组角膜病理组织学检查结果基本一致,NL组PRK眼除前弹力层缺失外,其余各层组织与两组对侧眼结构一致。角膜上皮细胞完整,形态规则,排列整齐,细胞间连接紧密,细胞层数约5~6层;角膜基质层纤维排列规整,其中散在角膜细胞,未见炎症细胞浸润及典型成纤维细胞;角膜内皮细胞单层排列整齐,细胞间连接紧密(图4)。
2.5角膜组织TUNEL检测结果光照实验结束时,两组双眼角膜全层组织偶见散在阳性染色细胞,两组间无明显差异,组间PRK眼与对侧眼阳性染色亦无明显差异(图5)。经DNaseⅠ处理同组角膜组织切片为阳性对照,结果示角膜上皮细胞层、基质层及内皮细胞层可见明显阳性染色(图5D),排除实验结果假阴性可能。
2.6幼猴角膜上皮组织MDA和SOD活力测定两组PRK眼和对侧眼角膜上皮细胞SOD活力和MDA含量差异均无统计学意义(PRK眼:MDA:t=0.504,P=0.632;SOD:t=-0.429,P=0.683;对侧眼:MDA:t=-1.161,P=0.297;SOD:t=-0.388,P=0.711),见表3。
图1两组组内泪液EGF和TGF-β1比较A:组内EGF比较:AL组:t=1.819,P=0.166;NL组:t=1.428,P=0.249;B:组内TGF-β1比较:AL组:t=8.757,P=0.003;NL组:t=3.620,P=0.036;aP<0.05 PRK眼vs对侧眼。

图2幼猴角膜组织及肾脏组织TGF-β1免疫组织化学染色 (×400)A:AL组PRK眼角膜组织;B:AL组对侧眼角膜组织;C:NL组PRK眼角膜组织;D:NL组对侧眼角膜组织;E:阳性对照幼猴肾脏组织,箭头所示为细胞浆内棕色阳性染色。

图3幼猴角膜组织和肌肉组织α-SMA免疫组织化学染色(×400)A:AL组PRK眼角膜组织;B:AL组对照眼角膜组织;C:NL组PRK眼角膜组织;D:NL组对侧眼角膜组织;E:阳性对照幼猴肌肉组织,箭头所示为细胞浆内棕色阳性染色。

图4两组双眼角膜病理组织学检查,均为角膜全层切片(×200)A:NL组PRK眼;B:NL组对侧眼;C:AL组对侧眼。

图5两组双眼角膜组织TUNEL染色(×200)A:AL组PRK眼;B:AL组对侧眼;C:NL组PRK眼;D:NL组对侧眼;E:阳性对照。箭头所示为散在阳性染色。


指标PRK眼AL组NL组tP对侧眼AL组NL组tPMDA含量(nmol/mgprot)3.45±0.523.24±0.660.5040.6322.97±0.613.38±0.38-1.1610.297SOD活力(U/mgprot)40.48±6.8242.60±7.17-0.4290.68340.16±5.2241.38±3.46-0.3880.711
3讨论
大量研究已证实增加户外活动时间是预防近视发生发展的保护因素,屈光发育期自然光暴露时间越长,近视风险越低[4, 14-15]。另一方面,过度自然光暴露可引起眼部组织的光损伤,其损伤程度取决于光源波长、光照强度、作用时间和组织生物学特性、代谢状态。以紫外光为例,自然光中90%的紫外光被角膜上皮组织选择性吸收,其光损伤的靶组织为角膜。鼠、兔和恒河猴的动物实验已证实一定累积量的紫外线辐射可造成以细胞凋亡为主,伴炎症细胞浸润的组织病理学改变。进一步分子生物学发病机制研究表明,光化学损伤是角膜光损伤的主要原因,即足够能量的光子破坏组织细胞的DNA、RNA或蛋白质结构,最终造成靶细胞凋亡[10, 16-17]。其中由光化学氧化应激产生的大量自由基、与凋亡相关的多种细胞因子失衡及信号通路改变被认为参与或介导了眼组织光损伤的细胞凋亡[18]。因此,在利用自然光防控近视的研究中,其安全性应引起足够重视。
本研究自然光照射时间为每天4h,共170d,观察自然光暴露对屈光发育期幼猴正常角膜组织的影响。实验早期光照50d,AL组与NL组对照眼的泪液11种因子含量分析均无统计学差异,提示自然光照射未引起正常眼表多种炎症、修复、免疫相关细胞因子改变。光照170d实验结果显示两组角膜组织学结构未见明显差异,TUNEL法检测组织凋亡细胞数量两组无明显差异,提示本研究的自然光辐射量并未引起角膜特征性的光损伤组织病理学改变及凋亡细胞数量增多。检测角膜上皮组织在氧化应激过程中重要的脂质过氧化产物MDA,以间接反映细胞氧化损伤的程度。两组MDA含量差异无统计学意义,提示自然光并未增加角膜上皮细胞氧化损伤的程度。分析原因可能与以下两个方面有关:(1)组织代谢状态:正常眼部组织含有多种抗氧化物,如:抗坏血酸、维生素E、谷胱甘肽、过氧化氢酶、SOD、谷胱甘肽还原酶和过氧化酶等,可一定程度上抵御光化学氧化应激损伤。当抗氧化物抗氧化能力不足以清除氧化应激自由基产物时,组织即发生光损伤改变,而组织抗氧化能力随年龄增加而降低[19]。本研究实验对象为2~8月龄的幼年恒河猴,尽管未进行不同年龄组恒河猴角膜上皮组织抗氧化酶活性的比较,但根据其他文献报道结果推测幼猴角膜上皮代谢功能旺盛,抗氧化物储备充足,能及时清除自然光照射产生的细胞内脂质氧化产物,可能是本研究最终角膜组织维持正常形态结构的原因之一。(2)辐射能量:日常生活中户外活动所接受的自然光辐射能量与所处纬度、海拔高度、季节、日时段、周围环境、地面情况及是否有日照防护措施有关[20-21]。Zigman等研究结果显示全年UVB最强辐射量出现在夏季中午11∶00~1∶00之间,北纬40度7月中午每小时UVB地面辐射量可高达1.1J/cm2[20]。但因为辐射量可被各种大气成分和周围环境植被和各种建筑物吸收和反射,而且在非直视太阳的情况下眼球组织有眼睑保护,实际上仅17%~30%地面紫外辐射量可影响角膜组织,因此实际组织辐射量远较地面辐射理论值低。本实验观察历时170d,选择上午9∶00~11∶00和下午15∶00~17∶00两个时间段进行自然光照射,避开光照辐射最强时间段;而且猴笼及周围绿色植被、建筑物也可一定程度降低辐射量,动态测量光照度发现仅个别时间点光照度高于20000Lx,远低于夏日中午阳光直射60000~70000Lx的光照强度。研究表明,相同辐射量的照射光,照射时间越长,光损伤的可能性越小。Sliney等指出每天8h紫外线辐射总量为0.3mJ/cm2是角膜的安全辐射量,不会引起角膜组织光损伤性病理改变[22]。而Cejka等[23]使用波长312nm紫外线光源,每天照射2.5min,共4d可达紫外线辐射总量为0.25mJ/cm2,能引起兔眼角膜组织明显水肿增厚,该辐射量相当于在紫外线辐射最强的夏日午间,人眼直视太阳2.56h角膜所接受的紫外线辐射总量。可见,角膜组织光损伤实验研究中使用的照射光辐射能量远高于人们日常生活进行的户外活动中所接受的自然光辐射能量。本研究干预措施与现实情况更为接近,较低的辐射能量可能是角膜未出现光损伤改变的另一原因。
除正常角膜组织外,本研究通过幼猴PRK模型,观察长期自然光暴露对角膜创伤愈合过程的影响。研究表明,PRK手术损伤后的角膜上皮细胞合成并分泌与炎症反应、细胞增殖、细胞转化和细胞外基质沉积等一系列修复相关的细胞因子,其中包括EGF、IL-1、IL-6、TGF、TNF-α、IFN-γ、NGF等。复杂的细胞因子网络及其相互之间的级联反应介导角膜上皮-基质相互作用,诱发并加重角膜基质细胞凋亡,激活伤口附近的角膜基质细胞增殖、移行,进而使其转化为肌成纤维细胞,合成细胞外基质以完成修复反应[24-25]。细胞凋亡水平越高,后续角膜组织修复反应越剧烈,临床表现为程度更为严重的角膜haze和屈光回退。因此动态评估术后角膜haze程度并检测组织中的各种细胞因子含量和细胞凋亡数量可从不同角度反映角膜组织损伤修复的状态。本研究AL组幼猴全过程无肉眼可见haze形成,组织修复反应轻,50d仅2只幼猴发生0.5级haze,与Zhong等[11-12]研究结果相符。而NL组在术后30~50d出现一过性haze形成,尽管未见3~4级严重haze发生,但术后40d的haze分级两组间仍有显著性差异,至术后70d NL组haze才基本消退,两组haze程度和消退时间的差别提示本研究的自然光照射量可能加重了PRK术后修复反应并延长修复反应时间,其结论与Nagy等[26]研究相近。
进一步检测术后50d泪液11种细胞因子含量,其中仅TGF-β1表达水平两组组内PRK眼均较对侧眼高,而且两组PRK眼间也有显著性差异,NL组高于AL组。TGF-β1是PRK术后角膜基质层修复最重要的细胞因子,在PRK术后的角膜上皮细胞、基质细胞、成纤维细胞中的表达增加,可诱导角膜细胞向肌成纤维细胞转型,促使胶原合成,加速伤口愈合。组织修复程度越严重,TGF-β1水平越高,与haze分级正相关[27]。本研究NL组40~50d为haze形成高峰,TGF-β1泪液表达水平两组间和组内双眼间均有显著性差异,提示PRK术后50d,角膜组织处于组织修复反应期,自然光照射通过增加TGF-β1表达水平加剧组织修复反应程度。如前所述,角膜组织吸收大部分自然光紫外线成分(波长295~400nm),其中中波长紫外线UVB对角膜组织最具危害,高强度的UVB可引起角膜上皮急性损伤,如电光性眼炎;长波长紫外线UVA组织损伤阈值较高但可长期积累,有慢性光损伤的风险。研究表明,细胞凋亡是光损伤的主要病理改变,鉴于细胞凋亡与PRK术后组织修复反应的密切关系,我们推测自然光照射增加了角膜组织细胞凋亡的程度,引起修复相关细胞因子表达增加,从而加重了组织修复反应程度。此外,两组PRK眼泪液EGF表达量差异有统计学意义,但两组组内双眼间表达量无显著性差异。EGF是维持角膜上皮细胞稳定性的主要细胞因子,临床上观察PRK术后早期EGF表达量升高,术后1mo泪液EGF分泌量与术前无明显差异[28],原因可能是PRK术后组织损伤程度轻,不足以引起长期泪液EGF含量的明显改变,与本研究两组组内双眼结果相符;而AL组PRK眼泪液EGF表达量高于NL组,有研究提示EGF与TGF-β在组织的表达量往往有相反的变化趋势[29],这一现象是否与细胞因子间的相互作用有关,还有待进一步研究验证。而其他与炎症和免疫相关的多种因子两组间未见明显差异,则提示PRK术后50d自然光照射并未加重角膜组织的炎症反应。
在实验结束时(PRK术后180d),两组PRK眼角膜组织结构病理学特征基本一致,组织内未见明显纤维修复细胞因子TGF-β1及成纤维细胞标志物α-SMA阳性表达,两组PRK眼凋亡细胞数量与对照眼均无明显差异,均表明PRK术后180d角膜组织修复已完成,且自然光照射量并未引起不可逆的角膜组织结构改变。从另一角度说明本研究中的自然光紫外线辐射量虽能加重PRK术后角膜损伤修复活动期的反应程度,但对修复反应也已完成的角膜组织无明显光损伤作用。
综上所述,本研究所采用的自然光照射在延缓幼年恒河猴近视发生的同时,对正常的幼猴角膜组织无明显光损伤作用。该自然光辐射量可加剧幼年恒河猴PRK术后修复早期的角膜组织修复反应,但远期未对角膜组织造成不可逆损伤。

